桑树SSR实验技术要点分析*
2018-07-13柯皓天
刘 玲 傅 晓 柯皓天 吕 银
(1.四川省丝绸工程技术研究中心,四川成都 610031;2.四川省丝绸科学研究院,四川成都 610031)
SSR(Simple Sequence Repeats)即简单重复序列DNA,又称微卫星DNA(Microsatellite DNA),由Moore 和Sollot terer 于1991 年提出,是以1-6 bp核苷酸为重复单位,多次串联重复组成的DNA序列[1]。SSR具有多态性高、实验操作简单、共显性等优点,目前已应用在桑树的遗传多样性分析、杂交组合亲本多态性及遗传背景等方面。本文就桑树SSR实验过程中的技术要点进行分析。
1 基因组DNA提取
桑树基因组DNA提取一般采用稍加改进的CTAB法[2]从硅胶干燥过的桑叶中提取,但当桑叶中含糖量过高时,这种方法不能将多糖完全除尽。
用4×CTAB法正式提取之前,加如下两个步骤:(1)在桑叶粉中加入1.5mL去糖buffer,震荡混匀,冰浴10min;(2)7000rpm,4℃离心10min;(3)去上清液,加入4×CTAB提取液,进行稍加改进的CTAB法的步骤。实践证明,去糖buffer能去除大量多糖(图1)。
M: Marker;1-7: 直接用4×CTAB法提取的样品;1’-7’:在正式提取前加了两个步骤的样品
去糖buffer配制:1M/L Tris-HCl 100 mL,0.5M/L EDTA 50mL,NaCl 7.305g,加去离子H2O定容至500mL,高压蒸汽灭菌后即可使用。
2 引物筛选
参考桑树SSR分析相关文献,如RAMESH K. AGGARWAL等[3],Weiguo Zhao等[4],Mathithumilan Balachandran等[5],选择其中的100多对引物,根据序列号在Genbank上查看引物信息,确定每对引物目的产物的长度,并下载。下载完毕,在https://blast.ncbi.nlm.nih.gov/Blast.cgi上比对,选出在川桑基因组中分布均匀的引物,引物合成以后用2-3个性状不同的桑树品种进行筛选。
3 PCR扩增
3.1 PCR反应体系优化
SSR是一种基于PCR技术的分子标记,实验结果易受反应组分的影响。由于研究方法、目的、实验材料、引物、技术要求不同,桑树SSR-PCR反应体系没有固定的标准。为了确保实验结果的准确性和重复性,在正式PCR扩增实验前,可采用单因素设计和正交设计任意一种,或者两种方法结合的方式,对PCR反应体系中的组分进行优化。
单因素分析处理组数多,且不能兼顾各因素之间的相互作用;正交设计可以分析因素间的交互作用,但受到的试验操作误差较大而且也不能顾及个别因素的影响。实验者应根据实际情况选择合适的方法优化。
3.2 引物退火选择
引物退火温度也是影响PCR扩增效果的一个关键因素。不同引物的退火温度需要摸索。单个引物的退火温度确定,可采用梯度PCR,设置温度:引物Tm值±4℃,PCR仪自动生成12个温度进行扩增。根据电泳检测结果确定每对引物的最适退火温度。但是这种方法比较繁琐耗时,仅适合引物少的情况采用。
多对引物同时扩增,反应程序可采用降落PCR。降落PCR能够避免或有效降低由退火温度过高或过低等因素引起的非特异性产物的产生[6],省去了摸索每对引物退火温度的繁琐步骤,节省了实验时间。
桑树SSR-PCR扩增,降落PCR程序可参照赵卫国的研究[7]:95℃预变性3min;然后94℃变性30 s,63℃退火1min,设置每个循环降低0.5℃,72℃延伸1min,共16个循环;94℃变性30s ,56℃退火1min,72℃延伸1min,共24个循环;最后72℃延伸5min,反应结束控制在10℃。
4 凝胶配制及电泳
SSR-PCR扩增产物采用非变性聚丙烯酰胺凝胶电泳检测。凝胶浓度根据扩增产物的大小确定,一般为5%-8%。
聚丙烯酰胺凝胶聚合是由四乙基乙二胺(TEMED)催化过硫酸铵产生的自由基引发丙烯酰胺单体聚合,同时甲叉双丙烯酰胺与丙烯酰胺产生甲叉键交联,形成三维网状结构。凝胶完全聚合需要1.5-2h。
过硫酸铵最好现配现用,配制好的放置应不超过3d。灌完胶后,剩余的凝胶溶液一般5min后显示聚合,如果30min后仍然没有聚合,则说明过硫酸铵量少或者质量不好,胶板易黏胶和漏胶。如果5min内开始凝固,则过硫酸铵过量,会造成梳子插入困难和气泡难以清除;过多的过硫酸铵还会导致电泳过程中DNA条带发虚和扭曲[8]。为了消除过硫酸铵对电泳的影响,在正式电泳之前需在200-220V下预电泳10-20min。一般50mL凝胶溶液中需加入10%过硫酸铵315μL,TEMED 25μL。
电泳缓冲液为1×TBE,配制好的缓冲液连续使用最多不超过4次;电泳电压一般为120V,电压太高会导致凝胶发热,使DNA条带呈月牙状。浓度为8%的凝胶在120V电压下电泳1h 40min。
5 凝胶染色
凝胶染色采用银染法(1.0g/L AgNO3)。原理如下:Ag+与DNA中带负电的磷酸基团共价结合,在碱性环境下,由甲醛还原成黑褐色的金属银沉积于凝胶中而显示出DNA带型[9]。
染色前,要待硝酸银完全溶解并混匀后再放入凝胶,否则银颗粒会嵌入胶中,使背景杂乱。染色时间控制在8-10min。
6 凝胶显色
显色液配制:4g氢氧化钠、0.08g无水碳酸钠和0.8mL甲醛,去离子H2O定容至200mL。无水碳酸钠在显色液中提供碱性环境,促进凝胶显色,氢氧化钠可提高无水碳酸钠的浓度,缩短显色时间。
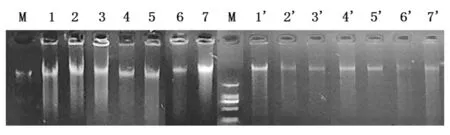
显色时,要严格控制和把握显色时间,一般最多显色5min就要拍照。5min以内,凝胶条带清晰,背景浅。5min以后,随着时间增加,凝胶背景会越来越深,以至于变黑,无法读带(图2)。

M:marker;1-7:染色时间≤5min;1’-7’:染色时间≥5min
桑树是中国重要的经济作物,SSR标记是研究桑树遗传多样性、亲缘关系和群体结构等的重要手段。本文通过分析桑树SSR实验技术要点,指出了需要注意的问题,并对可能出现的问题提出了解决办法,以期为SSR分子标记在桑树领域更广泛地应用提供参考。
