坛紫菜紫外吸收物质类菌孢素氨基酸的世代差异特征
2018-07-13陈虹兆张晗晗纪德华王文磊陈昌生谢潮添
陈虹兆,张晗晗,许 凯,徐 燕,纪德华,王文磊,陈昌生,谢潮添
(集美大学水产学院,福建 厦门 361021)
0 引言
坛紫菜(Pyropiahaitanensis)是一种大型经济海藻,主产于我国福建省、浙江省和广东省。坛紫菜的生活史是异型世代交替的,两个世代都具有独立生活能力,其叶状体世代是单倍体,附生在中高潮区的岩石;其丝状体世代是二倍体,生活在贝壳内部[1-3]。很多水生生物都受到紫外辐射 (ultroviolet radiation,UVR)的影响,海洋中的浮游动物和一些微藻可以调节所处的水深来躲避UVR,但坛紫菜等大型海藻不能迁移以避免UVR的伤害。因此,坛紫菜的叶状体天然暴露在紫外辐射之中,并且随着退潮,藻体直接暴露在高剂量的UVR之下。UVR可以破坏生物的DNA,具有诱导产生活性氧和损伤细胞膜等多种负面影响[4-5]。紫菜可以通过合成紫外吸收物质来抵御紫外辐射的伤害[6-9],但这些研究只关注对叶状体世代的影响。坛紫菜不同世代所处的紫外辐射环境差异巨大,有必要研究其紫外辐射耐受和调控机制方面的世代差异。
在很多海洋和淡水生物中,类菌孢素氨基酸(mycosporine-like amino acids,MAAs)是最常见的紫外吸收物质(UV absorbing compounds)[4]。MAAs是一类水溶性的含氮色素复合物,分子量较低,基本结构是环己烯酮。MAAs能够与多种氨基酸发生缩合反应,种类与结合的氨基酸有直接的关系。20世纪70年代,MAAs首次在真菌中发现,许多种微藻和大型海藻均含有种类丰富的MAAs[7]。MAAs能吸收紫外波段的范围是309~362 nm(主要处于紫外A(UVA,315~400 nm )波段),也吸收少量紫外B(UVB,280~315 nm)波段[4,7]。文献[6-8]报道紫菜等大型海洋红藻含有较高含量的MAAs,用于抵御紫外线的伤害作用。
紫外辐射增强可导致活性氧含量增加,而MAAs还具有清除活性氧的功能。Matsui等[10]在念珠藻的研究中发现MAAs能清除活性氧自由基。高温胁迫诱使柱状珊瑚(Stylophorapistillata)活性氧自由基含量增加,但过氧化物酶系统的水平没有发生显著变化,而一种具有抗氧化功能的MAAs的含量却增加了近20倍[11]。生物通过莽草酸途径合成MAAs,其关键步骤是7-磷酸景天庚酮糖在3-脱氢奎宁酸合酶(DHQS)的催化下生成MAAs的前体3-脱氢奎宁酸[7,12]。因此DHQS被认为是MAAs合成过程中的关键酶,而其编码基因aroB基因是合成MAAs的关键基因。DHQS的编码基因aroB在多种微藻中已被成功克隆,如鱼腥藻、蓝藻等[13-14]。但坛紫菜相关基因的克隆还未见报道。本研究的目的是要在坛紫菜转录组学的基础上,对坛紫菜的aroB基因进行全长克隆,并通过实时荧光定量PCR技术(qPCR)测定该基因在不同世代的表达特征,为进一步解析坛紫菜的紫外辐射耐受和调控机制奠定基础。
1 材料与方法
1.1 藻株来源和培养
实验选用的坛紫菜品系为Z-61,由集美大学选育。丝状体来源于坛紫菜种质资源库。取少量丝状体经29 ℃促熟后,在21 ℃下充气促放壳孢子,然后萌发成叶状体。叶状体和丝状体均为充气培养,培养温度21 ℃,光照强度50 ~ 60 μmol/(m2·s),光照周期12 L∶12 D,每3天更换1次培养基。培养基为营养盐加富的天然海水,营养盐浓度参考Provasoli’s enrichment solution(PES)。均设置3个生物学重复。
1.2 MAAs相对含量测定
MAAs的提取方法参考文献[15-16],本研究稍有优化。先将藻体经液氮速冻后,转移至-80 ℃冰箱中低温冻干36 h,粉碎至40目。然后,加入25%(体积分数)甲醇,在60 ℃水浴锅中温育15 min。 冷却至室温后,以8000 r/min冷冻离心15 min。恢复至室温后,在紫外分光光度计上测定250~800 nm之间的吸收,其吸收峰位于333 nm处。样品的总蛋白含量用试剂盒测定。每个梯度处理样品均设置3个生物学重复,2个技术重复。
MAAs浓度的计算公式:CMAAs=A/(ε·Cpr),其中A为333 nm下的吸光度值,ε为消光系数4 mL/(km·mg),Cpr为样品的总蛋白含量。
1.3 引物及其序列
本研究中基因的全长克隆、验证、阳性克隆筛选及基因表达水平定量分析所采用的引物序列设计如表1所示,引物由大连宝生物工程有限公司合成。
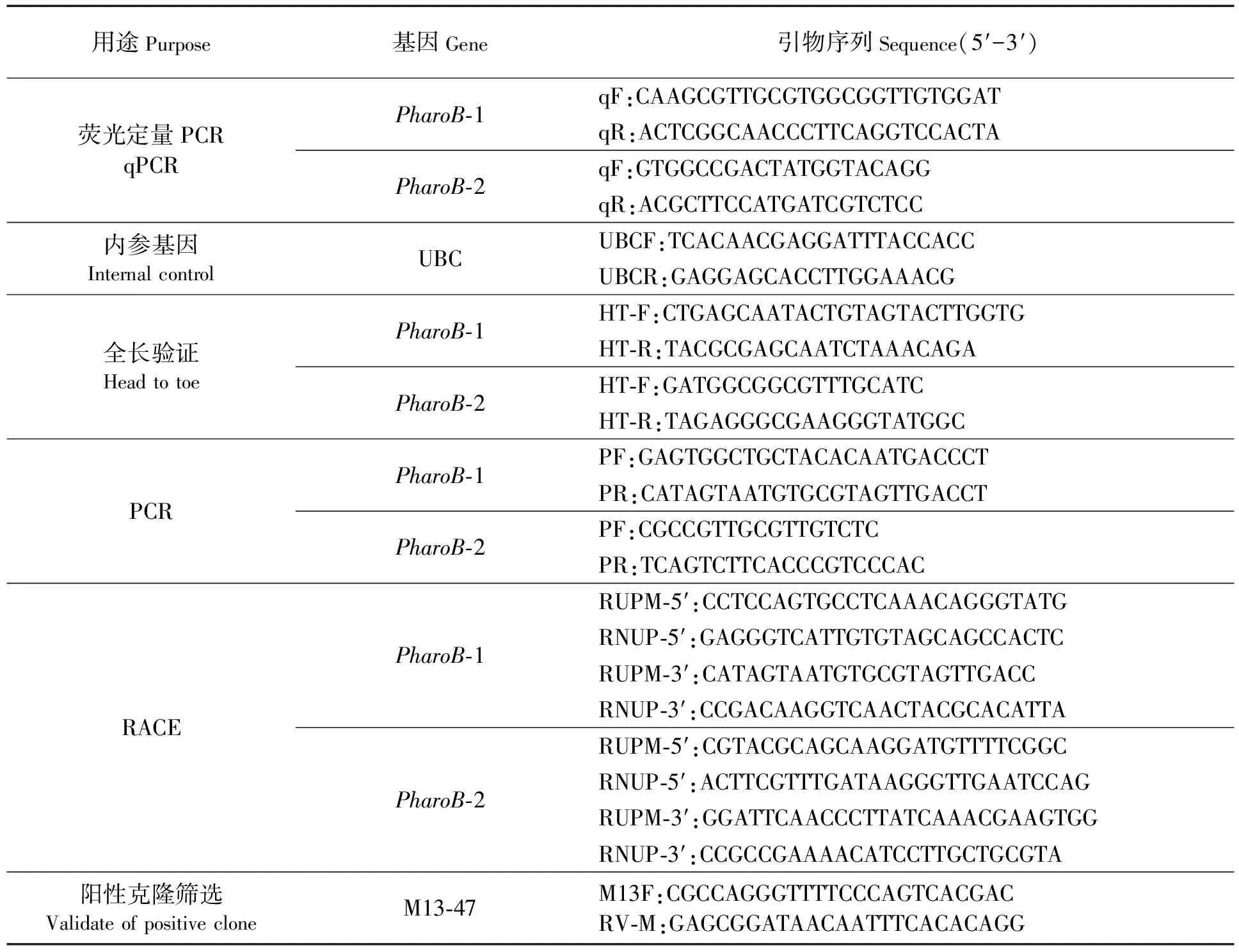
表1 实验中所用引物的名称和序列
1.4 总RNA的提取及质量检测
收集坛紫菜藻体0.1 g,吸干表面水分,在液氮中研磨后,用E.Z.N.A 植物 RNA 提取试剂盒(OMEGA,德国)提取总RNA。经凝胶电泳检查提取的总RNA的完整性,并在紫外分光光度计上分别测定260 mm和280 nm处的吸光值,根据测定结果计算RNA的浓度,判断核酸和蛋白质的污染情况。
1.5 基因的全长克隆及验证
根据坛紫菜转录组数据库Unigene的注释结果,选取注释结果为3-脱氢奎宁酸羧化酶/O-甲基转移酶基因的Unigene0013975作为PharoB-1基因全长克隆的核心序列,选取注释结果为3-脱氢奎宁酸羧化酶基因的Unigene0010955作为PharoB-2基因全长克隆的核心序列。测序后,根据获得的5′和3′序列与核心序列的重叠区,用DNAMAN 5.2.2(Lynnon BioSoft)拼接,获得两条基因的全长序列。然后,根据拼接的全长序列,设计head to toe引物,以RACE扩增时获得的cDNA为模板,进行普通PCR扩增,将扩增产物进行切胶回收、转化和测序,并将测序结果与拼接结果进行比对,以验证全长克隆的正确性。
1.6 基因的生物信息学分析
利用NCBI的BlastN程序对克隆得到的全长基因序列进行序列同源性检测。用ORF Finder软件分析基因的开放阅读框(ORF)和所编码的氨基酸序列。用PROSITE、InterProScan和PrediSi查找基因序列的保守位点和信号肽序列。用Clustal X进行氨基酸多重序列比对,并用MEGA 6.0软件构建系统进化树。
1.7 实时荧光定量PCR
根据基因序列设计qPCR正反向引物,以UBC基因作为内参,分析两条基因在不同世代的表达差异。提取的总RNA按PrimeScript RT reagent kit(TaKaRa,大连)的说明书进行操作。荧光定量PCR扩增在ABI7300型定量PCR仪上进行。以10×梯度稀释的cDNA为模板进行定量PCR扩增,制作标准曲线。每次反应都设置阴性对照和无模板对照,每个反应设3个平行复孔。
1.8 数据分析
采用t-test分析数据的差异比较均值:P>0.05为差异不显著;P<0.05为差异显著。

2 结果
2.1 不同生活史世代间MAAs含量测定分析
坛紫菜叶状体世代的MAAs含量显著高于丝状体世代,约为丝状体世代的6倍(见图1)。
2.2 坛紫菜紫外吸收物质相关基因的全长克隆
从坛紫菜转录组数据库中筛选出各相关基因的核心序列,采用普通PCR和5′/3′RACE相结合的方法,克隆基因的全长。序列经过测序和拼接后,最终获得2条基因的全长,一是坛紫菜3-脱氢奎宁酸羧化酶/O-甲基转移酶基因(PharoB-1),另一是3-脱氢奎宁酸羧化酶基因(PharoB-2),这些序列均已提交至Genbank数据库中,结果如表2所示。

表2 坛紫菜MAAs合成基因的克隆
2.3 MAAs合成相关基因的生物信息学分析
基因PharoB-1的克隆以Unigene0013975为基础,经过普通PCR扩增获得了1900 bp的序列,然后以之为核心序列设计了4个特异引物来克隆PharoB-1的部分cDNA。用SMART RACE技术获得了5′端780 bp的cDNA片段(见图2a)和3′端315 bp的cDNA片段(见图2c)。将以上3个片段拼接,获得了全长为3003 bp 的cDNA片段。为了验证PharoB-1的全长,分别以cDNA 和gDNA为模板,用一对head to toe引物来扩增PharoB-1。扩增结果包括了1条3003 bp 的片段(见图2d,图2e),其与克隆序列长度一致。全长序列已经提交给GenBank,收录号为KT380133。基因PharoB-2的克隆以坛紫菜Unigene001095序列作为核心序列,设计普通PCR引物扩增中间片段,得到1条长度为1049 bp的序列。根据所得序列,设计特异性引物进行RACE扩增和测序,获得1条长度为303 bp的5′-末端序列(见图2f)和1条长度为838 bp的3′-末端序列(见图2i)。对两条末端序列和中间片段进行拼接,获得了1条长度为1496 bp的全长序列,经过全长序列验证(见图2j)和Blast比对,确认其为坛紫菜的aroB基因,命名为PharoB-2。将其与以gDNA为模板扩增出的全长序列(图2k)比较,显示长度均为1496 bp,碱基序列没有差异。

利用在线软件Swiss-Model对PhDHQS-2氨基酸序列的三级结构进行预测,结果如图3所示。

PharoB-1所编码蛋白为DHQS和O-转甲基酶(O-MT)的聚合酶即PhDHQS-OMT,所以选择同样有该聚合蛋白的海洋尖尾藻进行多重比对分析(结果见图4)。
ORF finder分析显示PharoB-1 cDNA 包括位于5′端的275 bp的非翻译区和3′端的79 bp的非翻译区,以及2649 bp 的开放阅读框(ORF)。这个 ORF编码1条882个氨基酸的蛋白多肽,其分子量为95.72 ku。基因编码的蛋白序列含有47个磷酸化位点,其中丝氨酸28个,苏氨酸11个,酪氨酸8个。

Predictprotein程序预测PharoB-1所编码蛋白的二级结构中构成螺旋、片层和环状的氨基酸残基分别占总氨基酸残基的比例为39.23%、16.44%和44.33%(见图2a)。采用ORF Finder软件对PharoB-2基因序列进行分析发现,该基因序列2~1441个碱基为完整的ORF,可编码包含479个氨基酸,分子量为49.30 ku。基因编码的蛋白包含18个磷酸化位点,其中丝氨酸8个,苏氨酸10个。Predictprotein程序预测PharoB-2所编码蛋白的二级结构中构成螺旋、片层和环状的氨基酸残基分别占总氨基酸残基的比例为37.37%、20.25%和42.38%。
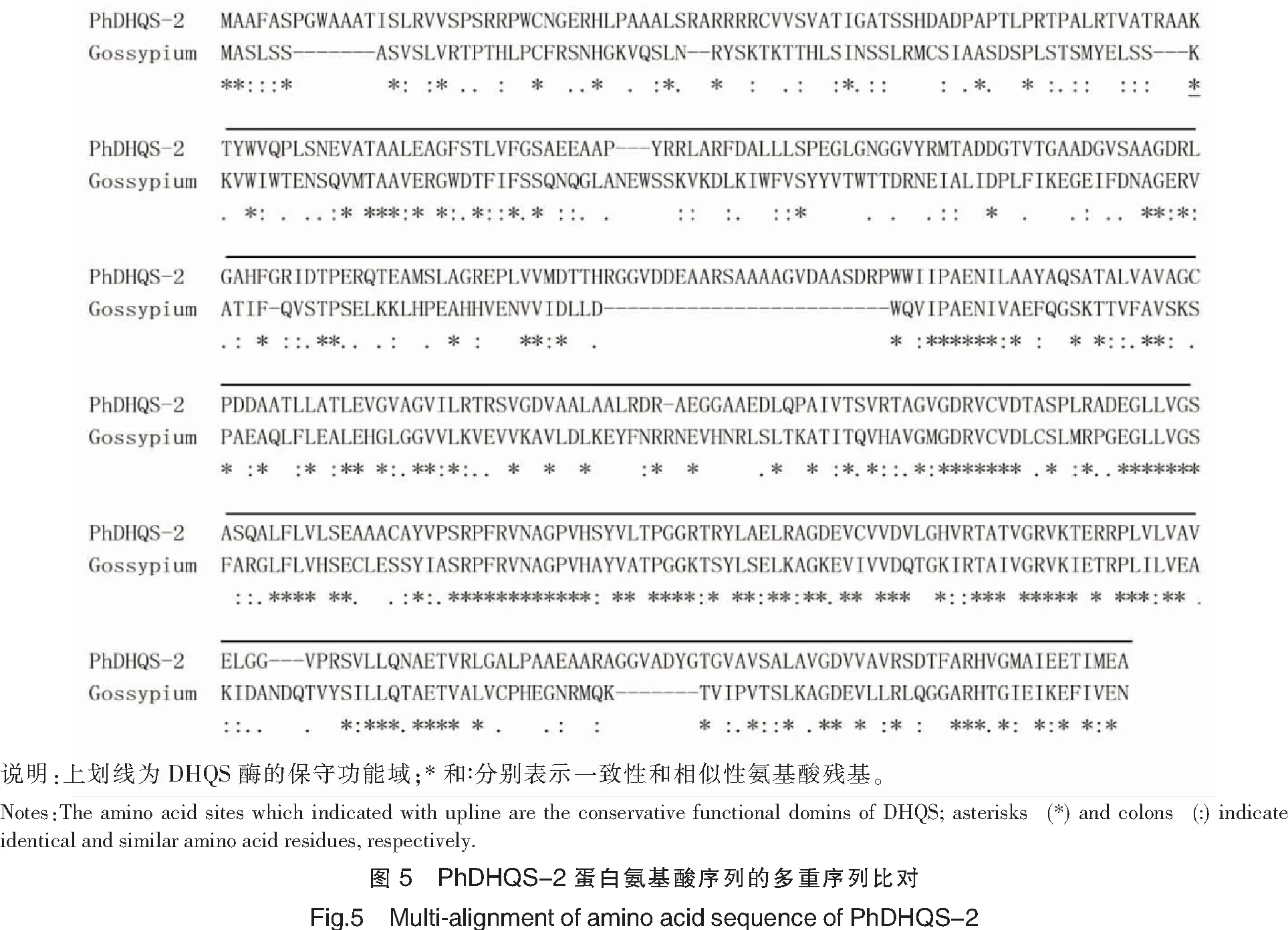
如图4所示,坛紫菜中PhDHQS-1与海洋尖尾藻中的蛋白序列相似度较高。两序列中均含有两个不同的保守功能域(单/双上划线部分),DHQS保守功能域在前,O-MT在后,且DHQS酶中均有若干个活性位点,用阴影标出。DHQS蛋白氨基酸序列的多重序列比对结果表明,所克隆的PharoB-2基因属于DHQS基因家族,且与棉属植物中DHQS蛋白具有相同的保守结构域,序列相似性较高(见图5)。
2.4 紫外吸收物质合成相关基因表达的定量分析
与MAAs合成相关的基因PharoB,在不同世代间表达量存在显著差异。其中PharoB-1基因在叶状体中表达量约为丝状体中的300倍(见图6a,P<0.001),而PharoB-2基因在叶状体世代约为丝状体世代的4倍(见图6b,P<0.01)。

2.5 PhDHQS蛋白的系统进化分析
构建的系统进化树分为明显的两支:微藻与高等植物。PhDHQS-1(PhDHQS-OMT)与大多数微藻聚为一支,而PhDHQS-2与高等植物聚类为另一分支(见图7)。说明坛紫菜中两条DHQS分属于不同分支,PhDHQS-1与微藻类亲缘关系更近,而PhDHQS-2则与高等植物亲缘关系较近。

3 讨论
紫外辐射(UVR)是太阳辐射的一部分,因此藻类在利用光能进行光合作用的同时,不可避免地受到UVR的影响。UVR对各种光合藻类有多方面的伤害作用,而经济海藻坛紫菜应答UVR的机制以及世代差异还不清楚。一些具有游泳能力的微藻可以通过垂直迁移来躲避UVR的伤害[4-5]。而包括坛紫菜在内的大型海藻不能通过迁移以避免辐射伤害,只能增强其抵御UVR伤害的机制。很多生物通过产生紫外吸收物质来抵御UVR的伤害。研究表明,紫菜可以通过合成紫外吸收物质来抵御UVR的伤害[6-8]。紫外吸收物质种类很多,其中类菌孢素氨基酸(MAAs)是最常见的紫外吸收物质。退潮时,坛紫菜叶状体直接暴露在UVR下,而贝壳可以使UVA和UVB分别衰减约50%和75%[17]。因此,坛紫菜丝状体世代和叶状体世代所处的UVR环境差异巨大。本研究重点关注坛紫菜MAAs含量的世代差异,以及相关合成基因的世代表达差异。
本研究发现MAAs在叶状体中的含量显著高于丝状体。PharoB是MAAs合成的关键基因,叶状体中两条PharoB基因的表达量也显著高于丝状体。这种差异极可能与坛紫菜不同世代的栖息环境相关。杨顶田等[15]的研究也发现,藻类通过MAAs含量的增加来抵御UVB,这是长期进化后表现出的适应现象。另外,UVR会诱导铜绿微囊藻大量合成MAAs,从而增加其耐受UVR的能力[18]。Corcora等[19]研究发现大型海藻受UVB影响产生的紫外吸收物质能有效地保护潮间带生态系统内其他生物的生存。然而,过量的UVB会导致藻体受到氧化损伤[5]。牛美英[20]和应锐等[21]分别发现麒麟菜和条斑紫菜的MAAs提取物具有抗氧化活性。坛紫菜丝状体生长于贝壳中,不仅UVR被贝壳减弱,而且可见光也降低了约40%[17]。此外,有研究认为MAAs合成需要可见光[22],这可能也是叶状体中MAAs含量及PharoB基因表达量均显著高于丝状体的原因。
在模式生物蓝藻中,DHQS酶是MAAs合成的关键酶[14]。在经济海藻条斑紫菜的功能基因组研究中,王孟强[23]研究发现MAAs合成过程中的关键酶为aroB基因编码的DHQS/O-MT。而坛紫菜与条斑紫菜亲缘关系较近。本研究以转录组测序获得的DHQS/O-MT unigene序列作为核心序列,采用普通PCR和RACE扩增技术成功克隆了2条编码坛紫菜DHQS酶的基因aroB,分别命名为PharoB-1、PharoB-2。通过序列多重比对发现PharoB-1基因的ORF功能结构域中,存在两个酶的编码序列,分别为DHQS酶和O-转甲基酶(O-MT)。而PharoB-2只编码DHQS酶,没有编码O-MT的结构域。这导致了系统进化分析显示2条PhDHQS蛋白分为明显的2支,相距较远。2条PhDHQS蛋白分别与微藻和高等植物的亲缘关系更近(见图7),这也与红藻的进化地位一致。
综上所述,坛紫菜叶状体世代的紫外吸收物质MAAs含量明显高于丝状体世代,并且MAAs合成的2条关键基因的表达与生理数据一致,这种差异来源于对不同世代所处的UVR环境的适应。
