高分子量麦谷蛋白亚基HPCE高效分离及图谱鉴定
2018-07-13王卫东赵丹阳
王卫东 高 翔 赵丹阳
西北农林科技大学农学院, 陕西杨凌 712100
胚乳贮藏蛋白是决定小麦加工品质的重要因素,它主要包括麦谷蛋白和醇溶蛋白[1]两大类。依据电泳迁移率, 可将麦谷蛋白进一步分为高分子量麦谷蛋白亚基(high molecular weight glutenin subunit,HMW-GS)和低分子量麦谷蛋白亚基(low molecular weight glutenin subunit, LMW-GS)。研究表明, 小麦品质变异的30%~79%归因于编码HMW-GS等位基因的变化[2]。普通小麦一般有 3~5个 HMW-GS, 由1A、1B、1D染色体长臂上的Glu-1位点编码, 每个位点含有两个紧密连锁的基因, 分别编码分子量较大的 x-型亚基和分子量较小的 y-型亚基[3]。HMW-GS的组成与面包烘烤品质密切相关, 其快速、准确的分离与鉴定已成为小麦品质研究的重要环节。
用于 HMW-GS分离鉴定的常规方法主要包括SDS-PAGE、分子标记、RP-HPLC 等[4-7]。SDS-PAGE是最常用的鉴定方法, 其操作简单、成本较低, 但是对于迁移率比较接近的亚基难以准确鉴别, 且分离所需时间较长。分子标记技术鉴定准确性高, 但受限于标记种类且往往需要与SDS-PAGE相结合检验基因是否表达。RP-HPLC技术选择性好, 检测灵敏度高, 但同样存在用时较长等缺点, 不适宜大量样品分析。近年来高效毛细管电泳技术(HPCE)由于其用样少、速度快、分辨率高等特点, 显示了在HMW-GS的分离与鉴定中良好的应用前景。
对HPCE的分离效率, 已从磷酸盐缓冲液系统、硼酸盐缓冲液系统、乳酸铝缓冲液系统及 Prosot SDS等方面进行了研究[8-12], 验证了其在蛋白定性分析中的可行性, 但是用HPCE分离小麦HMW-GS的研究尚处起步阶段, 有关标准鉴定图谱的研究甚少, 且已报道的分离体系在分离速度和分辨率上还有待提高。本研究以此为切入点, 引入IDA缓冲液系统, 通过分析不同组分浓度、pH对分离效果的影响并结合电泳参数的优化, 建立 HPCE高效分离体系, 并以此为基础研究不同亚基的迁移图谱, 为小麦 HMW-GS的定性分析及种质筛选提供了技术支持。
1 材料与方法
1.1 试验品种
选用12个小麦品种, 包括中国春、西农979、济南13、晋麦47、济麦4号、豫麦41、烟农19、莱州137、鲁麦23、矮抗58、豫麦50和郑麦366。中国春、西农 979、济南 13、矮抗 58、豫麦 50由国家小麦改良中心杨凌分中心品质实验室提供, 其他品种由山西省农业科学院小麦研究所提供。本课题组前期研究证实这些品种在 HMW-GS组成上具有多样性。
1.2 HMW-GS的提取和鉴定
参考Jang等[13]描述的方法, 并稍作修改。取单粒小麦种子, 研磨成粉, 加入 55%异丙醇 1 mL,65°C振荡冲洗3次, 每次30 min, 充分去除水溶性蛋白及单体醇溶蛋白。向残余沉淀中加入100 μL提取液(含50%异丙醇, 80 mmol L–1Tris-HCl, pH 8.8,1% DTT), 充分混匀, 65°C水浴30 min, 加入1.4%4-乙烯基吡啶(v/v), 混匀后, 保持同一水浴环境烷基化反应30 min。常温15 000×g离心15 min, 取上清液加入丙酮, 使其在混合液中的终浓度为 40%,静置2 h, 15 000×g离心, 弃上清液, 风干后沉淀于–20°C 保存备用。
采用 Lee等[14]改良的 SDS-PAGE方法, 利用MV-10DSYS电泳仪对小麦各品种进行HMW-GS的初步鉴定。样品中加入20 μL提取缓冲液(含2% SDS,0.02%溴酚蓝, 0.08 mol L–1Tris-HCl, pH 8.0, 40%甘油), 振荡混匀, 沸水浴中煮沸5 min, 取8 μL上样。采用12%分离胶与5%浓缩胶, 12 mA恒流电泳, 指示条带出胶后继续电泳 2 h。使用 1%考马斯亮蓝R-250染色过夜, 脱色至背景清晰, 照相记录结果。
用分子标记法验证HMW-GS的初步鉴定结果。取光照培养 1周的幼苗嫩叶, 用CTAB法[15]提取基因组DNA。各亚基基因的分子标记信息见表1。
1.3 HPCE高效分离体系的建立
1.3.1 缓冲液系统 将单粒种子所得 HMW-GS样品, 用200 μL溶解液A (丙三醇15 mL, 尿素18 g,乙酸75 μL, 加ddH2O定容至50 mL)溶解, 然后25°C 超声(50W)处理 30 min, 充分去除气泡。使用P/ACE MDQ plus毛细管电泳仪(BECKMAN, USA)进行 HPCE分析, 参考 Robertson等[26]描述的方法,并做适当改进。新管平衡程序为0.1 mol L–1NaOH冲洗1 min, ddH2O冲洗2 min, 1 mol L–1H3PO4冲洗1 min, 缓冲液冲洗 5 min。进样前, 用 1 mol L–1H3PO4冲洗 1 min, 0.1 mol L–1NaOH 冲洗 2 min,dd H2O冲洗1 min。两次样品间用1 mol L–1H3PO4冲洗30 s, ddH2O冲洗1 min, 缓冲液冲洗1 min。分析缓冲液不同组分浓度及pH对HMW-GS分离效果的影响。依据蛋白分析中IDA缓冲液系统条件范围[27], 设置2.2、2.5和2.8的pH梯度。IDA浓度为50、75 和 100 mmol L–1。HPMC 浓度为 0.05%、0.50%和不添加。ACN浓度为10%、15%和20%。

表1 HMW-GS分子标记Table 1 Molecular markers of HMW-GS
1.3.2 电泳参数 在相同缓冲液条件下, 比较电泳参数对分离效果的影响。常规电泳参数为毛细管内径50 μm, PDA检测波长214 nm, 分离电压15 kV,运行温度25°C[28]。优化后的电泳参数为毛细管内径25 μm, PDA检测波长200 nm, 分离电压20 kV, 运行温度30°C。
1.4 HPCE高效分离体系的验证
1.4.1 连续重复电泳 结合Werner等[9]和余建中[29]的研究结果初步分析分离图谱的特点。连续30次重复试验, 对 HPCE高效分离体系下图谱峰形、峰高稳定性进行检验。
1.4.2 RP-HPLC分析 与 RP-HPLC比对分析,验证分离速度, 记录出峰时间并计算 RSD值, 检验分离重现性。仪器为Agilent 1100 (USA)液相色谱仪及反向高效液相色谱柱(ZORBAX 300SB-C18 Stable Band Analytical 4.6 × 250 mm, 5-Micron)。参照 Dong等[30]描述的方法, 用100 μL溶解液B (21% ACN 0.2 mL, 0.1% TFA)溶解HMW-GS样品。进样量25 μL,设置柱温 60 °C, 流速 1 mol L–1, 洗脱梯度 50 min 内流动相(0.06% TFA-ACN溶液)的体积比由21%增加到 41%; 相邻样品间柱洗涤时间 15 min; 紫外光检测波长210 nm。
1.5 HMW-GS图谱鉴定
以上述 HPCE高效分离体系为基础, 比较不同类型 HMW-GS的迁移顺序及标准出峰时间, 为减小误差, 对亚基组成相似的品种采用混合进样方式[31]。
2 结果与分析
2.1 供试品种的HMW-GS组成鉴定
SDS-PAGE结合“Payne标准图谱”初步鉴定结果表明, 供试品种在Glu-1A位点的类型有 null、1Ax1和 1Ax2*; 在Glu-1B位点的亚基组合类型有1Bx20、1Bx7+1By8、1Bx7+1By9、1Bx6+1By8、1Bx13+1By16、1Bx17+1By18和 1Bx20+1By20, 除鲁麦 23外均成对亚基; 在Glu-1D位点的亚基组合类型有 1Dx2+1Dy12、1Dx3+1Dy12、1Dx4+1Dy12和 1Dx5+1Dy10 (图 1-A)。
分子标记鉴定与 SDS-PAGE分析结果一致, 由此确定了供试12个品种的 HMW-GS的组成, 共包含18个亚基(图1-B~F, 表2)。Glu-1A位点, 仅豫麦50含1Ax2*亚基, 中国春、晋麦47和鲁麦23为null,其余品种均含1Ax1亚基;Glu-1B位点, 中国春等7个品种含 1Bx7亚基, 豫麦 41和鲁麦 23含 1Bx20,烟农19含1Bx17, 莱州137含1Bx6, 中国春等5个品种含1By8, 济南13、晋麦47和豫麦50含1By9,济麦4号含1By16, 烟农19含1By18;Glu-1D位点,中国春等5个品种含1Dx2亚基, 豫麦41、莱州137和郑麦366同时含1Dx5和1Dy10, 其余品种y型亚基均为1Dy12。
2.2 HPCE高效分离体系及其影响因子分析
2.2.1 缓冲液 pH的影响 中国春有 4个HMW-GS特征峰, 按出峰时间由前向后依次为1Dy12、1By8、1Bx7和1Dx2[32-33]。本研究以中国春为标准样, 分析缓冲液不同组分浓度及 pH值对分离效果的影响。
缓冲液系统不同pH值对HMW-GS峰高、峰宽及基线均有显著影响。随着pH值的降低, 亚基峰宽逐渐增大, y型亚基峰高有增大的趋势, 而x型亚基则相反。pH为2.8和2.2时均出现不同程度的基线波动, 尤其是 pH 2.8时, 电泳分离后期有基线上升的趋势, 1By8亚基有副峰的影响。调整pH为2.5时基线状况最佳, 且亚基分离度较高, 整体迁移速率介于前两者之间, 4个特征峰的出峰时间分别为10.24、11.94、13.40和 15.00 min (图 2-A)。可见, 缓冲液pH 2.5为最佳条件。
2.2.2 IDA浓度的影响提高IDA浓度, 对亚基迁移速率有促进的作用, 对亚基峰宽、峰高、分离度及基线影响不大。通过连续两针电泳比较发现,不同IDA浓度对图谱重现性有显著影响。IDA浓度为 100 mmol L–1和 50 mmol L–1时, 连续两针电泳亚基出峰时间均出现了较大的偏差。调整IDA浓度为75 mmol L–1时, 两针电泳下亚基主峰几乎重合, 亚基峰形、峰高均保持较高的一致性, 该浓度下亚基迁移速率介于 50 mmol L–1和 100 mmol L–1之间(图2-B)。因此, IDA适宜浓度为75 mmol L–1。
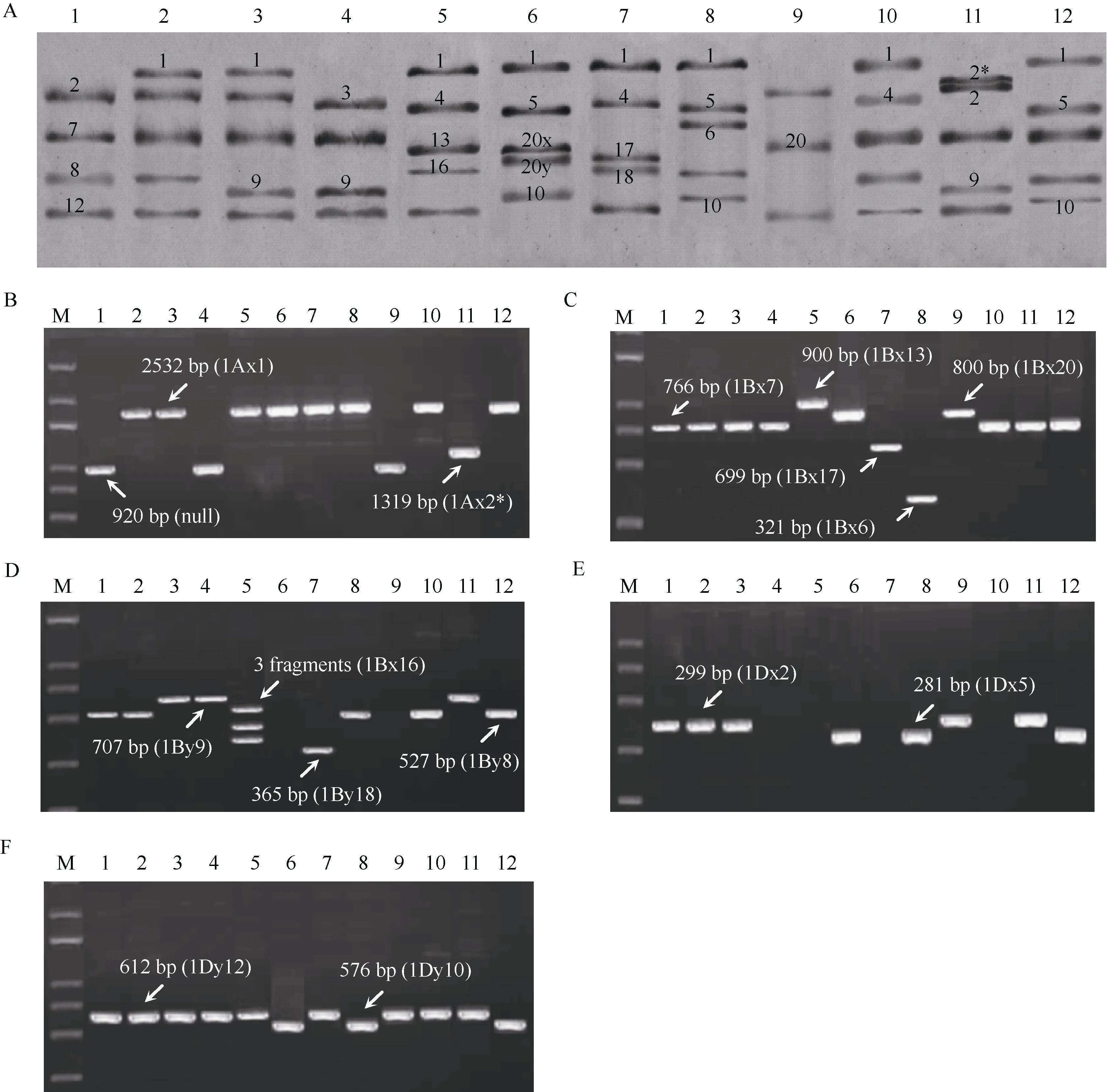
图1 小麦Glu-1位点亚基组成和编码基因的鉴定Fig. 1 Identification of the subunit composition and coding genes of Glu-1 loci in wheatA: SDS-PAGE分析; B~F: HMW-GS分子标记鉴定。M: Trans 2k plus; 1: 中国春; 2: 西农979; 3: 济南13; 4: 晋麦47; 5: 济麦4号;6: 豫麦41; 7: 烟农19; 8: 州 137; 9: 鲁麦23; 10: 矮抗 58; 11: 豫麦50; 12: 郑麦366。A: analysis of SDS-PAGE; B–F: identification of HMW-GS by molecular markers. M: Trans 2k plus DNA marker; 1: Chinese Spring;2: Xinong 979; 3: Jinan 13; 4: Jinmai 47; 5: Jimai 4; 6: Yumai 41; 7: Yannong 19; 8: Laizhou 137; 9: Lumai 23; 10: Aikang 58; 11: Yumai 50;12: Zhengmai 366.
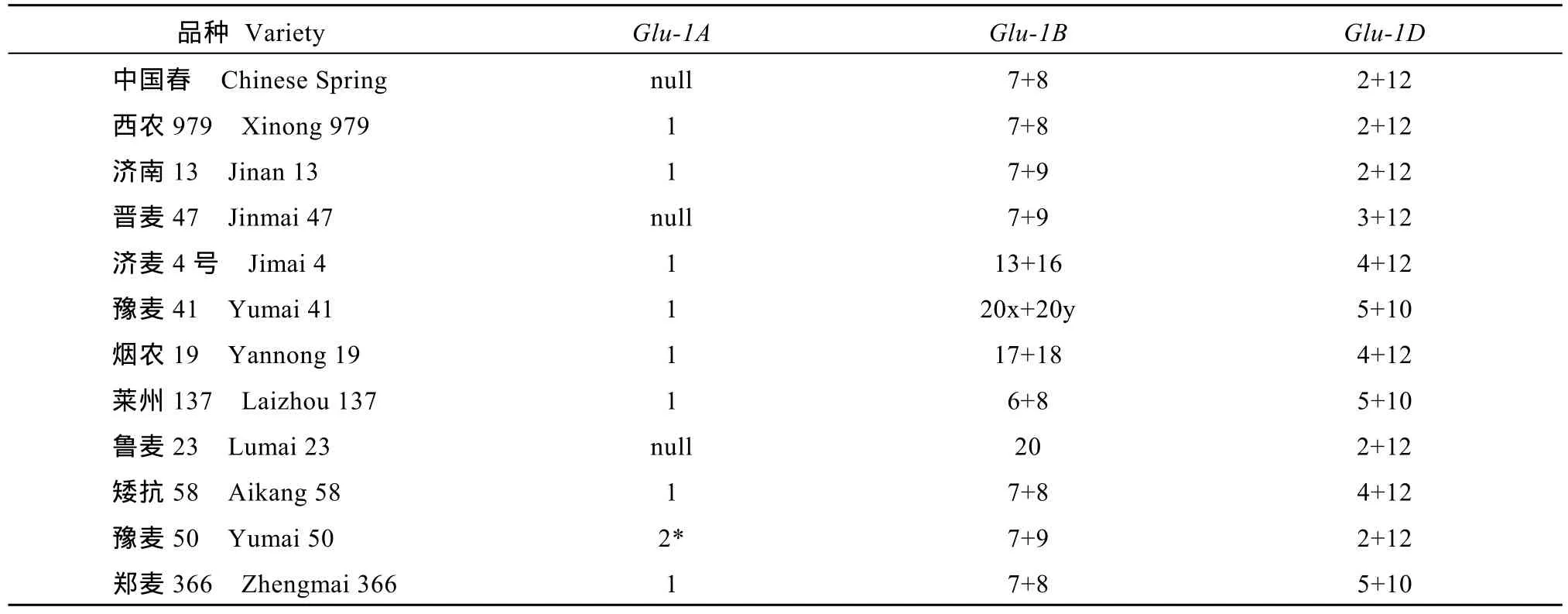
表2 材料品种HMW-GS组成Table 2 Composition of HMW-GS of material varieties
2.2.3 HPMC浓度的影响 HPMC是HPCE分离体系的常用缓冲液添加剂, 不添加 HPMC时, 电泳整体迁移速率最大, 但亚基之间未完全分离, 且峰形不规则, 峰宽过大, 显著影响了图谱分辨率; 添加HPMC后, 亚基分离度明显提高, 浓度为0.5%时,亚基峰宽较小, 但基线噪音很大, 当调整浓度为0.05%时, 峰宽增大, 基线噪音显著减小, 且主峰峰形规则, 因此图谱分辨率更高(图2-C)。可见, HPMC的加入对分离效率有促进作用, 且适宜浓度为0.05%。
2.2.4 ACN浓度的影响 3种ACN浓度下均获得清晰对称的峰形。随着ACN浓度的减小, 亚基分离度增大, 当 ACN浓度为 10%时, 分离度最高, 但是亚基峰高有明显降低, 同时由于该浓度下峰宽较大, 导致亚基纵向扩散与峰展宽的比例过小, 影响了图谱分辨率(图2-D)。ACN浓度为15%和20%时这一比例差异不大, 但前者分离度更高, 这将有利于其他类型亚基的加入和识别。因此, 推荐ACN适用浓度为15%。
2.2.5 电泳参数的影响 参数优化后HPCE图谱整体迁移速率提高, 分离所需时间变短, 同时由于亚基峰高增大、峰宽减小, 亚基纵向扩散与峰展宽的比例扩大, 图谱分辨率得到进一步提升(图 3), 在后期分离鉴定迁移率比较接近的亚基时将更加有利。
综合考虑各种因子对分离效果的影响, 确定了最佳缓冲液体系为75 mmol L–1IDA + 0.05% HPMC+ 15% ACN, pH 2.5, 电泳参数为毛细管内径25 μm,PDA检测波长200 nm, 分离电压20 kV, 运行温度30°C。据此建立了小麦HMW-GS的HPCE高效分离体系。
2.3 HPCE高效分离体系验证
与前人报道一致[9,29], HPCE图谱中1~2 min为溶剂峰, 3~7 min为少量LMW-GS区域, HMW-GS区域始于 9 min (图 4)。1Dy12、1By8、1Bx7和 1Dx2亚基在16 min内全部分离完成。连续30次电泳, 图谱峰形及峰高均保持稳定, 且基线水平、噪音低, 图谱分辨率良好。
通过比较HMW-GS分离度及迁移速度, 发现本研究建立的HPCE高效分离体系优于RP-HPLC (图5), 更利于鉴别迁移率相近亚基。比较亚基出峰时间(表3), HPCE高效分离体系相对标准偏差在0.2%以下, 远低于RP-HPLC的1.0%以下, 因此分离重现性更高。良好的稳定性、分离速度和重现性保证了HMW-GS图谱鉴定的准确性。
2.4 HMW-GS图谱鉴定
中国春 1Dy12、1By8、1Bx7、1Dx2亚基出峰时间依次为 9.39、11.70、13.18 和 14.73 min (图 6-A)。在中国春HMW-GS的基础上, 添加西农979 (1, 7+8,2+12)混合进样, 在13.73 min处获得1Ax1亚基主峰,其迁移速率介于 1Bx7和 1Dx2亚基之间(图 6-B)。继续添加济南13 (1, 7+9, 2+12)混合进样, 于10.30 min处获得 1By9亚基特征峰, 其迁移时间晚于1Dy12 亚基(图 6-C)。
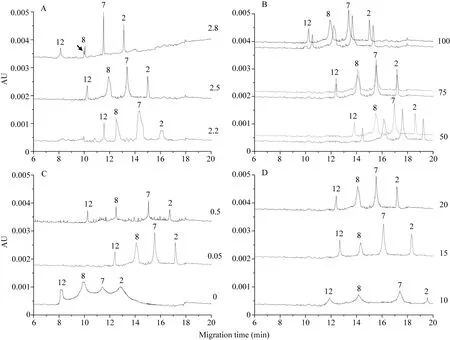
图2 缓冲液组分浓度、pH对HMW-GS电泳分离的影响Fig. 2 Effect of constituent concentration and pH values of buffer on electrophoresis separation of HMW-GS
在中国春(null, 7+8, 2+12)、西农 979 (1, 7+8,2+12)和济南 13 (1, 7+9, 2+12)的基础上(图 6-D), 添加豫麦50 (2*, 7+9, 2+12)获得1Ax2*亚基特征峰(图6-E), 添加晋麦47 (null, 7+9, 3+12)获得1Dx3亚基特征峰(图 6-F)。1Ax2*亚基出峰时间为 13.50 min,该亚基的迁移时间介于 1Bx7和 1Ax1之间, 且与1Ax1亚基峰比较接近。1Dx3亚基迁移速率略快于1Dx2亚基, 出峰时间为14.46 min。
将中国春(null, 7+8, 2+12)与郑麦 366 (1, 7+8,5+10)混合进样, 在9.69、13.73和14.04 min处获得3个特征峰(图6-G, H)。已知13.73 min为1Ax1亚基,14.04 min主峰面积大于9.69 min, 并且同一位点上x型亚基的含量大于y型亚基[3], HPCE图谱中峰面积大小代表了亚基含量的高低, 因此可知, 9.69 min为1Dy10亚基, 14.04 min为1Dx5亚基。同理, 继续添加豫麦41 (1, 20x+20y, 5+10)进样, 在12.22 min和12.62 min获得两个新的特征峰(图6-I), 前者峰面积较小, 为1By20亚基, 后者为1Bx20亚基。
向中国春、郑麦366混合样中添加莱州137, 获得1Bx6亚基峰, 出峰时间为13.08 min, 迁移速率与缓冲液成分: 75 mmol L–1IDA + 0.05% HPMC + 15% ACN, pH 2.5。优化前电泳参数: 毛细管内径50 μm, PDA检测波长214 nm,分离电压15 kV, 运行温度25°C; 优化后电泳参数: 毛细管内径25 μm, PDA检测波长200 nm, 分离电压 20 kV, 运行温度30°C。Buffer constituents: 75 mmol L–1IDA + 0.05% HPMC + 15% ACN,pH 2.5. Electrophoresis parameters were 50 μm of the inner diameter of capillary, 214 nm of detection wavelength, 15 kV of separation voltage, and 25°C of operating temperature before optimization and 25 μm of the inner diameter of capillary, 200 nm of the detection wavelength, 20 kV of separation voltage, and 30°C of operating temperature after optimization.1Bx7亚基很接近(图6-J, K)。继续添加鲁麦23同样获得了1Bx20亚基峰(图6-L), 与图6-I鉴定结果一致。

图3 电泳参数优化前(A)和优化后(B)的HPCE图谱Fig. 3 HPCE profile before (A) and after (B) optimization of electrophoresis parameters
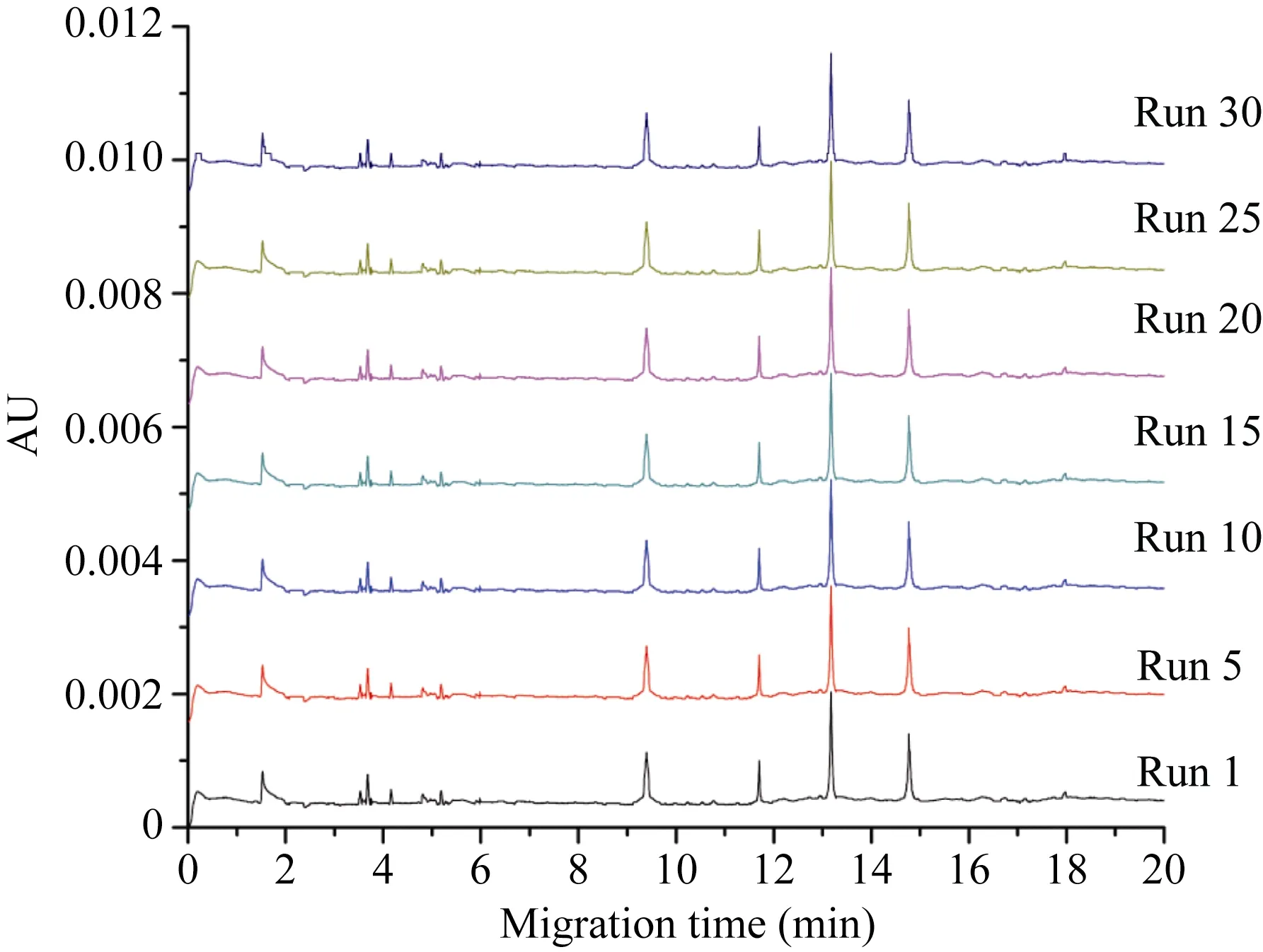
图4 中国春HMW-GS连续30次HPCE分离Fig. 4 Thirty separations of HMW-GS of Chinese Spring by HPCE图中曲线分别对应第1、5、10、15、20、25和30次电泳分离。The curves correspond to the 1st, 5th, 10th, 15th, 12th, 25th, and 30th electrophoresis separation, respectively.
向中国春与西农979混合样中添加矮抗58, 确定了 1Dx4亚基峰, 其迁移速率介于 1Ax1与 1Dx2之间, 出峰时间为14.24 min (图6-M, N)。向中国春、西农979、矮抗58混合样分别添加济麦4号和烟农19, 并比较新加入峰面积, 获得 1By16、1Bx13、1By18和1Bx17亚基特征峰(图6-O, P), 出峰时间分别为12.09、12.83、11.89和12.36 min。
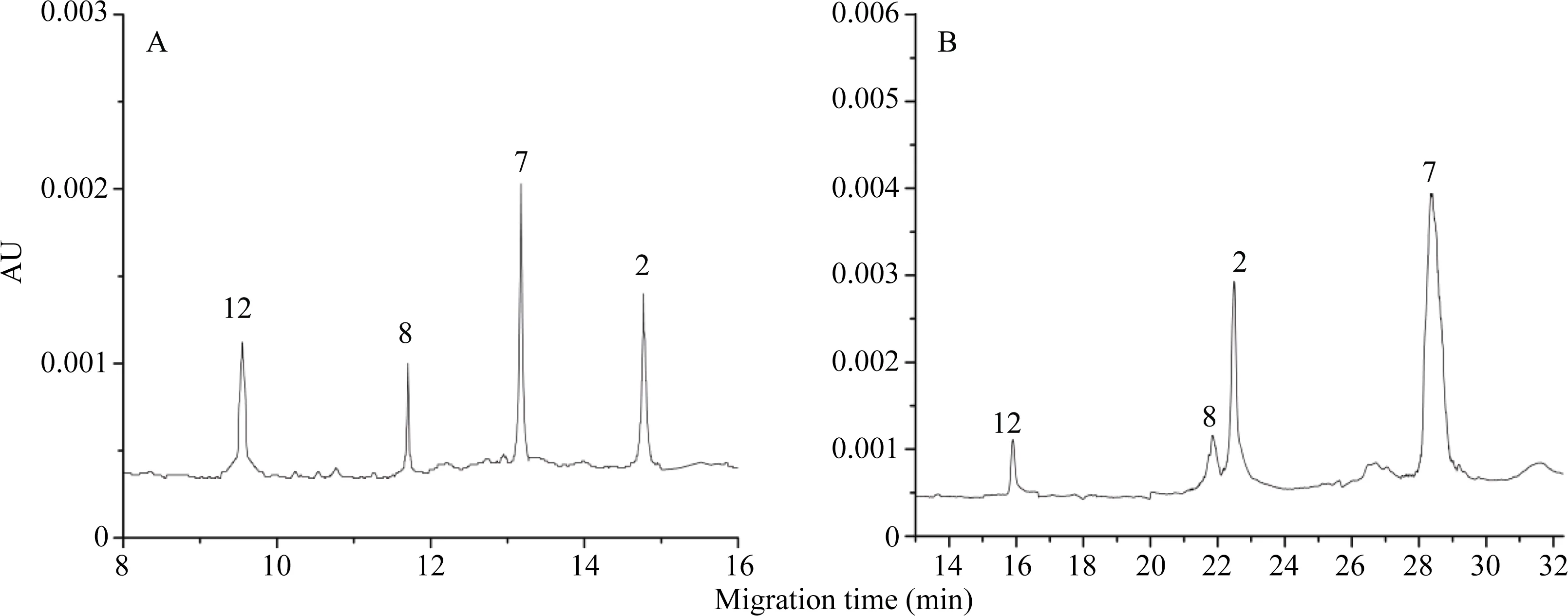
图5 HPCE (A)与RP-HPLC (B)的分离图谱Fig. 5 Separation profile of HPCE (A) and RP-HPLC (B)
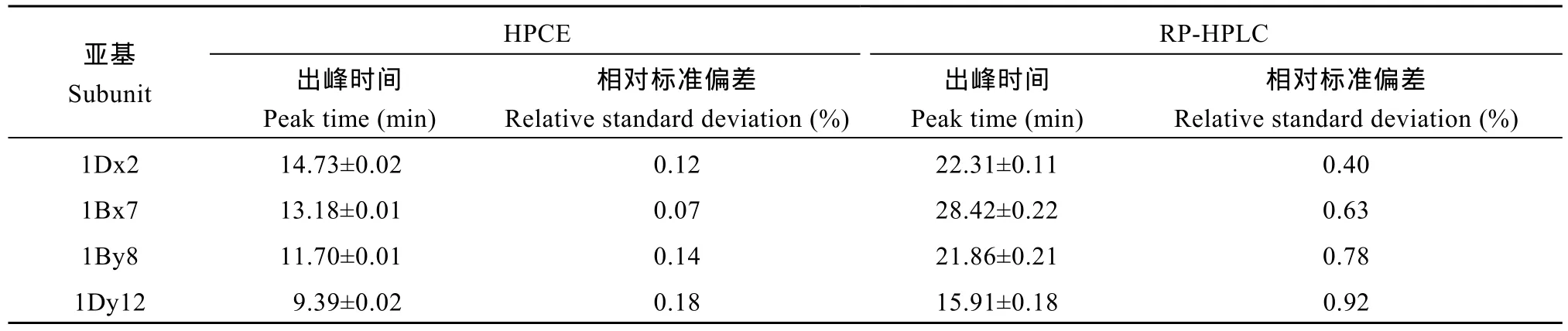
表3 HMW-GS出峰时间相对标准偏差Table 3 Relative standard deviation and peak time of HMW-GS

图6 不同HMW-GS的HPCE图谱(混合进样)Fig. 6 HPCE spectrum of different HMW-GS (mixed injection)
获得的18个亚基的标准图谱, 亚基迁移顺序为1Dy12→1Dy10→1By9→1By8 → 1By18 → 1By16→1By20 → 1Bx17 → 1Bx20 →1Bx13→1Bx6→1Bx7→1Ax2*→1Ax1→1Dx5→1Dx4→1Dx3→1Dx2, 标 准出峰时间如表4所示, 相对标准偏差在0.2%以下。以1Bx17为分界线, 9.39 min到12.36 min为y型亚基区域, 12.36 min到14.76 min为x型亚基区域。
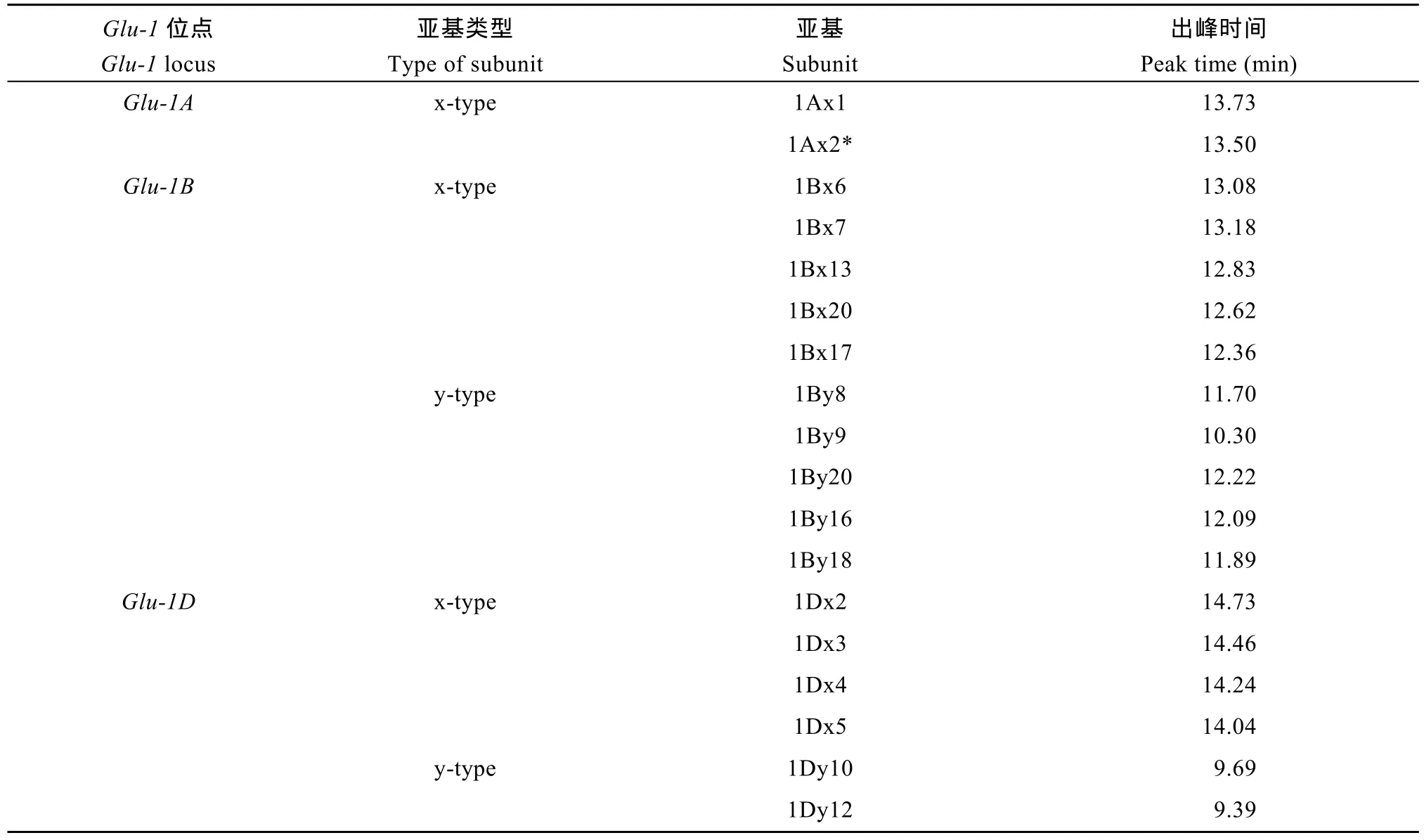
表4 18个HMW-GS的出峰时间Table 4 Peak time of eighteen HMW-GSs
3 讨论
准确有效地鉴定 HMW-GS将有助于加快品质改良步伐。HPCE技术在分离速度、分辨率等方面很大程度克服了传统方法的不足。
HPCE中分离体系的构建是研究亚基标准图谱的前提。体系中缓冲液系统是影响分离效果的主要因素, Bean和Lookhart[12]最早将IDA缓冲系统引入HPCE, 主要对醇溶蛋白的分离进行分析。本研究将IDA引入 HMW-GS的 HPCE分析, 通过优化条件,获得了良好的分离效果, 与常规的磷酸盐、硼酸盐、乳酸铝及 Prosot SDS缓冲液系统[8-12]相比, 在分离重现性上更具有优势, 结合电泳参数的优化, 亚基出峰时间的相对标准偏差控制在0.2%以下, 误差范围在±0.02 min内, 从而保障了标准图谱分析的精确性。
在优化分离体系时, 缓冲液系统各组分浓度及pH值主要通过改变电渗流而影响分离[35]。小麦HMW-GS属于大分子蛋白[36], 极易吸附于毛细管内壁, 极端pH可以产生抑制作用[37], 稳定溶液电渗流,实验中pH 2.8时电泳后期有基线上升的现象, 推测可能是该条件下抑制作用急剧下降, 使毛细管内产生了较多的焦耳热。IDA同样具有稳定电渗流的作用, 因此与分离重现性密切相关。Machiste等[38]认为加入HPMC明显提高缓冲液的分离效率, 因此可将HPMC作为添加剂使用。本研究印证了这一观点。在本研究中, ACN浓度升高将会使分离度下降, 其原因可能是ACN对电渗流的影响加快了样品堆积[39]。
在亚基标准图谱研究中, 本研究采用控制变量混合进样分离[31]的方式, 有助于减小试验误差。Werner等[9]、Sutton 和 Bietz[11]利用 ProSort SDS 商用试剂进行小麦 HMW-GS的 HPCE分析, 获得了1Ax1、1Dx2、1Bx7、1By8、1By9、1Dy10、1Dy12、1Bx17、1By18等亚基的迁移图谱, 出峰时间 RSD在3%左右。亚基迁移顺序表现为1Dy12→1Dy10→1By9→1By8→1By18→1Bx17→1Bx7→1Ax1→1Dx2,但对1Dy12与1Dy10、1By9与1By8等迁移率比较接近的亚基分离度不高。本研究增加了图谱中能够表征的亚基类型, 上述亚基出峰顺序与前人结果[9,11]一致, 但是迁移速率上略有差异, 在出峰时间相对标准偏差降低的同时, 亚基分离度获得了提升。
与SDS-PAGE类似, HPCE图谱中具有明显的x型、y型亚基分界, 整体上表现为 y型亚基先洗脱,然后是 x型亚基。Salmanowicz等[33]研究表明,HMW-GS中y型亚基的pI为6.70~6.98, 近中性, 而x型亚基 pI为 4.72~5.23, 呈弱酸性, 在毛细管高压电场下, 碱性或近中性亚基的迁移时间比弱酸性亚基短。本研究发现, 1Ax1和1Ax2*的迁移速率均大于1Dx5, 与在SDS-PAGE中截然不同[40]。这可能与该类型亚基在两种分离环境中所处的分子形态有关,Werner等[9]也认为,Glu-1A位点亚基在CE动态筛分环境和SDS-PAGE固定孔筛分装置中分子形态的不同是导致分离速率差异的主要因素。
结合亚基迁移顺序、标准出峰时间及电泳图谱等, 可对小麦相关 HMW-GS进行 HPCE快速鉴定,为大规模种质资源筛选提供技术条件, 同时由于亚基在 HPCE图谱中是以峰的形式出现, 且对应具体的迁移时间, 因此亦可对新HMW-GS进行初步鉴别。
4 结论
通过对缓冲液系统组分浓度、pH及电泳参数的优化, 成功构建了小麦HMW-GS的HPCE高效分离体系, 该体系具有良好的分离效率及分离重现性。以此为基础, 获得了1Dy12、1Dy10、1By9、1By8、1By18、1By16、1By20、1Bx17、1Bx20、1Bx13、1Bx6、1Bx7、1Ax2*、1Ax1、1Dx5、1Dx4、1Dx3和1Dx2共18个亚基的标准图谱, 依据亚基迁移顺序、标准出峰时间及图谱特点可以进行HMW-GS的HPCE快速鉴定。
