当归多糖对阿尔茨海默病模型大鼠学习记忆及β—淀粉样蛋白代谢的影响
2018-07-12王虎平吴红彦李海龙马春林曾庆涛崔淑梅朱凯敏
王虎平 吴红彦 李海龙 马春林 曾庆涛 崔淑梅 朱凯敏
摘要:目的 觀察当归多糖对阿尔茨海默病(AD)模型大鼠学习记忆、海马β-淀粉样蛋白前体(APP)、β-淀粉样蛋白(Aβ)1-42及血清乙酰胆碱(Ach)、胆碱乙酰转移酶(ChAT)、乙酰胆碱酯酶(AChE)、超氧化物歧化酶(SOD)、丙二醛(MDA)的影响,探讨其防治AD的作用机制。方法 70只SPF级Wistar大鼠经水迷宫学习记忆能力筛选合格后,随机选取10只大鼠(雌雄各半)为假手术组,其余大鼠以脑立体定位注射Aβ25-35复制AD大鼠模型,以水迷宫学习记忆能力筛选造模成功的50只大鼠随机分为模型组、阳性药组和当归多糖低、中、高剂量组,每组10只。模型组和假手术组大鼠给予生理盐水灌胃,各给药组大鼠给予相应药液灌胃,每日给药体积均为2 mL/100 g,连续28 d。给药25~28 d Morris水迷宫测试大鼠学习记忆能力,然后取材检测血清Ach、ChAT、AChE、SOD、MDA及海马APP、Aβ1-42。结果 与假手术组比较,模型组大鼠定位航行实验逃避潜伏期明显延长,目标象限滞留时间缩短,空间探索实验首次到达原逃生平台位置潜伏时间延长,穿越原平台位置及目标象限滞留的时间缩短,血清Ach含量与ChAT、SOD活性明显降低,AChE活性及MDA水平明显升高,海马APP、Aβ1-42含量升高,差异均有统计学意义(P<0.05,P<0.01);与模型组比较,各给药组大鼠逃避潜伏期均不同程度缩短,目标象限滞留时间延长,首次到达原逃生平台位置潜伏时间缩短,跨原平台次数增加,血清Ach含量和ChAT、SOD活性升高,AChE活性及MDA水平明降低,海马APP、Aβ1-42含量降低,差异均有统计学意义(P<0.05,P<0.01)。结论 当归多糖可能通过改善胆碱能神经递质、提高抗自由基氧化能力及促进Aβ的代谢,改善AD模型大鼠学习记忆能力,对AD有一定的防治作用。
关键词:当归多糖;Morris水迷宫;神经递质;抗氧化;β-淀粉样蛋白前体;β-淀粉样蛋白1-42;大鼠
DOI:10.3969/j.issn.1005-5304.2018.04.011
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2018)04-0051-05
Abstract: Objective To investigate effects of angelica polysaccharide on learning and memory abilities, Ach, ChAT, AChE, SOD, MDA in serum, APP and Aβ1-42 in hippocampus in model rats with Alzheimer disease (AD); To explore the mechanism of angelica polysaccharide for the treatment of AD. Methods Seventy SPF Wistar rats were selected for learning and memory ability by water maze. 10 rats were randomly selected (half female and half male) as sham-operation group, and the others were injected with Aβ25-35 by stereotatic techniques, copying AD model rats. 50 rats for learning and memory ability by water maze were successfully divided into model group, positive group, angelica polysaccharide low-, medium-, and high-dose groups, with 10 rats in each group. Rats in model group and sham-operation group were given normal saline for gavage, while rats in medication groups were given relevantmedicine for gavage, 2 mL/(100 g·d), for 28 d. The learning and memory ability of rats in each group was tested by Morris water maze during 25-28 days, and the contents of Ach, ChAT, AChE, SOD, MDA in serum and APP and Aβ1-42 in hippocampus were determined. Results Compared with the sham-operation group, the escape latent period of model group was significantly prolonged in place navigation experiment; the target quadrant time was shortened; the latent time for the first time to reach the original escape platform was longer in spatial probe test; the residence time of crossing the original platform position and the target quadrant was shorter; the levels of Ach, the activity of ChAT and SOD in serum decreased; the levels of MDA, the activity of AChE in serum increased; the levels of APP and Aβ1-42 in hippocampus increased, with statistical significance (P<0.05, P<0.01). Compared with model group, the escape latent period of each medication group was shortened in different degrees after the intervention treatment; the residence time of target quadrant was prolonged; the latent time for the first time to reach the original escape platform was shortened; the number of cross platform increased; the levels of Ach, the activity of ChAT and SOD in serum increased; the levels of MDA and the activity of AChE in serum decreased; the levels of APP and Aβ1-42 in hippocampus significantly decreased, with statistical significance (P<0.05, P<0.01). Conclusion Angelica polysaccharide may effectively improve the learning and memory of ability of AD model rats to improve anti-free radical oxidation and promote Aβ metabolism and promote learning and memory ability of AD model rats, which have some preventive and therapeutic effects on AD.
Keywords: angelica polysaccharide; Morris water maze test; neurotransmitter; antioxidation; APP; Aβ1-42; rats
随着世界各国人口结构的老龄化,阿尔茨海默病(Alzheimer disease,AD)已成为严重影响老年人生活质量甚至威胁生命健康的杀手。因此,深入探究AD的发病机制、研发行之有效的AD防治药物已成为世界医学的研究热点。我们前期进行了当归防治AD的相关实验[1-2],确证了当归防治AD的有效性。本研究将从药效物质基础入手,探讨当归主要活性成分当归多糖对AD的防治作用及其机制。
1 实验材料
1.1 动物
SPF级Wistar大鼠70只,雌雄各半,3月龄,体质量(200±20)g,中国农业科学院兰州畜医研究所实验动物场,动物许可证号SCXK(甘)2015-0001。
饲养于甘肃中医药大学科研实验中心SPF级动物实验室。
1.2 药物及制备
当归多糖(纯度98%)购于陕西慈缘生物技术有限公司,合同号ZYY-CY1601103;盐酸多奈哌齐片,卫材(中国)药业有限公司,批号1604043;青霉素(160万U),华北制药股份有限公司,批号F6057301。精密称取当归多糖适量,充分溶于蒸馏水,配制成浓度分别为0.008 8、0.017 6、0.035 2 g/mL当归多糖低、中、高剂量溶液;将盐酸多奈哌齐片研为粉末,溶于蒸馏水,配制成浓度为0.045 mg/mL溶液。
1.3 主要试剂与仪器
β-淀粉样蛋白(Aβ)25-35购于上海强耀生物科技有限公司,批号20160509;Rat APP ELISA KIT,上海酶联生物科技有限公司,批号1069820;Rat Aβ1-42 ELISA KIT,上海酶联生物科技有限公司,批号1069821;Rat乙酰胆碱(Ach)ELISA KIT,上海酶联生物科技有限公司,批号1069818;Rat胆碱乙酰转移酶(ChAT)ELISA KIT,上海酶联生物科技有限公司,批号1069819;乙酰胆碱酯酶(AChE)试剂盒,南京建成生物化学试剂有限公司,批号20161218;丙二醛(MDA)试剂盒,南京建成生物化学试剂有限公司,批号20161221;超氧化物歧化酶(SOD)试剂盒,南京建成生物化学试剂有限公司,批号20161221;考马斯亮兰蛋白测试盒,南京建成生物化学试剂有限公司,批号20161220。Morris水迷宫视频跟踪系统,成都泰盟科技有限公司,型号WMT-100;酶标分析仪,北京普朗新技术有限公司,型号DNM-9602;紫外分光光度计,日本岛津,型号UV-120-02;数字恒温水浴锅,江苏正基仪器有限公司,型号HH-S2;台式高速冷冻离心机,上海天美生化仪器设备有限公司,型号CT14RD;HANGPING电子秤,上海精科公司天平仪器厂,型号JY4001;大鼠脑立体定位仪,成都泰盟科技有限公司,型号WT-200;牙科钻,韩国世新公司,型号STRONG-90;微量进样器,上海安亭微量进样器厂。
2 实验方法
2.1 造模剂β-淀粉样蛋白25-35的孵育
取1 mg Aβ25-35溶于100 μL灭菌生理盐水(浓度10 μg/μL),充分混匀,置于37 ℃孵育箱中孵育7 d,待其纤维化为聚集状态后置于4 ℃冰箱保存备用。
2.2 分组及造模
所有供试大鼠适应性饲养3 d后进行水迷宫实验学习记忆能力筛选,剔除不合格大鼠3只。将筛选合格大鼠随机选取10只(雌雄各半)作为假手术组,其余大鼠全部进行手术造模,造模大鼠7 d后进行水迷宫实验学习记忆能力测试,筛选测试合格、造模成功50只大鼠随机分为模型组、阳性药组和当归多糖低、中、高剂量组,每组10只(雌雄各半)。造模大鼠称重后,腹腔注射10%水合氯醛(350 mg/kg)麻醉,参考《大鼠脑立体定位图谱》[3]行海马CA1区注射Aβ25-35溶液2 μL,碘伏擦拭伤口并涂青霉素粉末10万U。30 ℃恒温室内单笼留置至苏醒后放回大笼,并每日肌肉注射青霉素10万U/只,连续7 d。假手术组大鼠等位点注射同剂量生理盐水,不注射Aβ25-35溶液,其余操作同上。
2.3 给药
手术造模后自然饲养至第7日开始给药。模型组和假手术组大鼠给予生理盐水灌胃,当归多糖低、中、高剂量组和阳性药组大鼠分别给予相应药液灌胃,每日给药体积均为2 mL/100 g,连续28 d。
2.4 Morris水迷宫实验
2.4.1 定位航行实验
Morris水迷宫水池按方位分为4个象限,将逃生平台放置在固定象限。测试时将大鼠面向池壁从4个象限各自的固定入水点放入水中,记录其入水后寻找到平台的时间,即为逃避潜伏期。如大鼠在2 min内未找到平台,则记为120 s。共历时4 d,毎日更换入水象限进行测试。
2.4.2 空间探索实验
Morris水迷宫实验第5日撤走水下逃生平台,任选1个象限入水点将大鼠放入水池,让大鼠在无平台情况下凭记忆寻找平台位置。记录大鼠入水后首次到达原平台位置的潜伏期及120 s内穿越原平台位置的次数及在目标象限滞留时间百分比。
2.5 β-淀粉样蛋白前体和β-淀粉样蛋白1-42测定
空间探索实验结束后,各组大鼠自由饮水、禁食12 h,腹主动脉取血,4 ℃、10 000 r/min离心3 min,取血清,ELISA测定Ach含量及ChAT活性,比色法测定SOD、AChE活性及MDA水平,然后处死动物,迅速取出脑组织,分离海马,加生理盐水制成10%匀浆,4 ℃、10 000 r/min離心5 min,吸取上清液,ELISA测定APP、Aβ1-42含量。
3 统计学方法
采用SPSS20.0统计软件进行分析。实验数据以—x±s表示,组间比较采用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 动物死亡情况
由于手术造模创伤较大,且动物灌胃给药,实验周期较长,各组均出现了不同程度的动物死亡。其中模型组、假手术组和当归多糖低、中剂量组各死亡2只,阳性药组死亡3只,当归多糖高剂量组死亡1只。
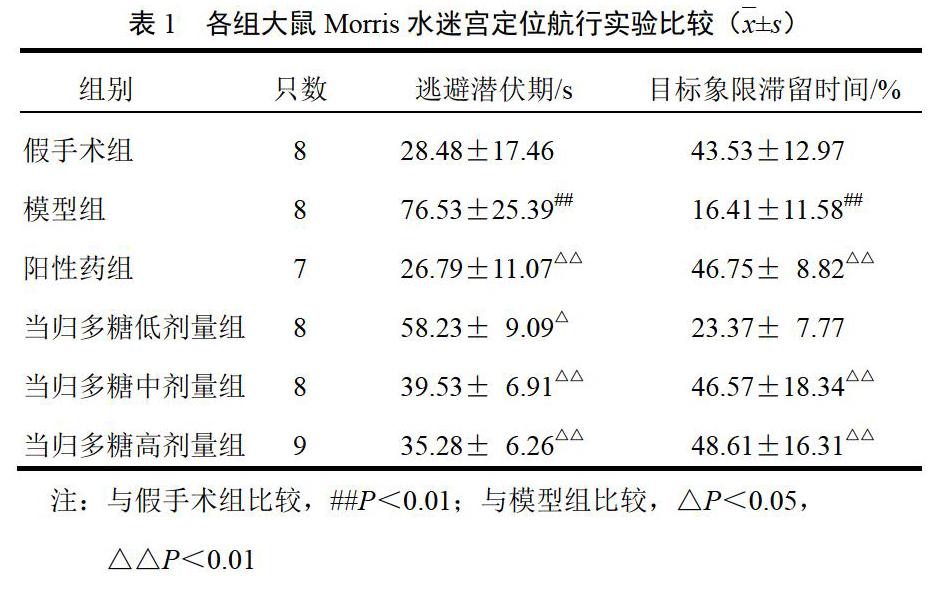
4.2 Morris水迷宫定位航行实验结果
与假手术组比较,模型组大鼠逃避潜伏期明显延长、目标象限滞留时间缩短(P<0.01);与模型组比较,当归多糖各剂量组大鼠逃避潜伏期明显缩短(P<0.05,P<0.01),目标象限滞留时间均不同程度延长,其中当归多糖高剂量组延长最明显。见表1。
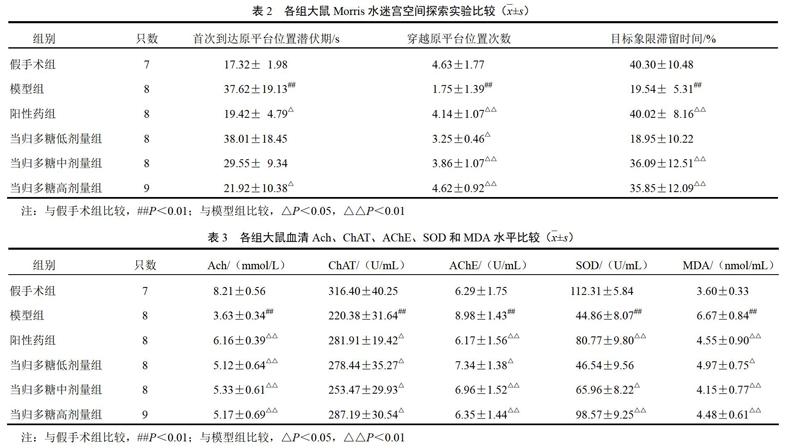
4.3 Morris水迷宫空间探索实验结果
与假手术组比较,模型组大鼠首次到达原平台位置潜伏时间明显延长、穿越原平台位置次数明显减少、在目标象限滞留时间明显缩短(P<0.01);与模型组比较,当归多糖高剂量组大鼠首次到达原平台位置潜伏期明显缩短(P<0.05),当归多糖各剂量组大鼠穿越原平台位置次数明显增加(P<0.05,P<0.01),当归多糖高、中剂量组在目标象限滞留时间明显延长(P<0.01)。见表2。
4.4 当归多糖对模型大鼠血清乙酰胆碱、胆碱乙酰转移酶、乙酰胆碱酯酶、超氧化物歧化酶和丙二醛水平的影响
与假手术组比较,模型组大鼠血清Ach含量和ChAT、SOD活性降低,AChE活性增强,MDA水平升高(P<0.01);与模型组比较,当归多糖各剂量组大鼠血清Ach含量升高、ChAT活性增强、AChE活性减弱、MDA水平降低,当归多糖中、高剂量组大鼠血清SOD活性增强(P<0.05,P<0.01)。见表3。
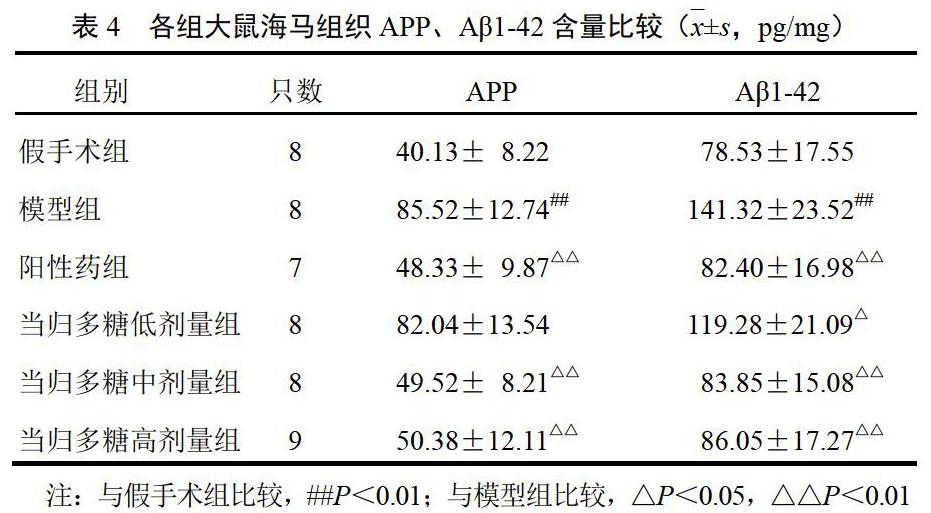
4.5 当归多糖对模型大鼠海马β-淀粉样蛋白前体和β-淀粉样蛋白1-42含量的影响
与假手术组比较,模型组大鼠海马组织APP、Aβ1-42含量明显升高(P<0.01);与模型组比较,当归多糖各剂量组大鼠海马组织Aβ1-42含量明显降低,当归多糖中、高剂量组大鼠海马组织APP含量明显降低(P<0.05,P<0.01)。见表4。
5 讨论
现代医学认为,AD作为一组病因未明的原发性退行性脑部疾病,其发病是多种因素(包括生物和社会心理因素)共同作用的结果,可能与家族遗传、基因突变、免疫功能紊乱、神经递质及生化改变、铝中毒、神经生长营养因子缺失、激素水平下降、能量代谢降低等诸多因素有关[4-8],并提出了β淀粉样蛋白级联学说、胆碱能缺陷学说、氧化应激学说、tau蛋白异常磷酸化学说等多种发病机制学说[9-10],将胆碱酯酶抑制剂、抗氧化剂、抗炎药物、神经营养因子、兴奋性氨基酸等药物应用于AD的对症治疗且取得了一定的疗效,但目前少见突破性进展。因此,采用现代生物技术手段,在中医理论指导下,挖掘古方、名方、验方开展中医药新型制剂的创新研究必然是防治AD的重要方法和手段,具有广阔的前景。
我们前期研究提出了从肝论治AD的科研假说[11],并在疏肝养血名方逍遥散、黑逍遥散实验结果[12-13]的基础上尝试性地开展了当归单味药防治AD的实验研究。研究表明,单味当归可改善东莨菪碱所致痴呆模型小鼠学习记忆能力,降低潜伏时间,显著升高小鼠脑组织SOD、ChAT、单胺氧化酶活性,降低MDA、AChE;当归含药血清可显著提高Aβ25-35诱导PC12细胞凋亡MTT的OD值,降低乳酸脱氢酶的释放,升高细胞活力、降低凋亡率,能有效预防Aβ25-35对神经细胞的损伤,保护神经细胞的膜结构的完整性,提高细胞生存活力,减轻Aβ25-35引起的PC12细胞凋亡[1-2]。
研究表明,老年斑(senileplaques,SP)作为AD的特征性病理之一,其核心成分是Aβ,而Aβ主要来源于APP。APP是细胞内一种跨膜蛋白质,在体内或体外可被多种蛋白激酶磷酸化,广泛的存在各种组织中,尤其在脑组织中表达最高[14]。大多情况下,APP由α-分泌酶裂解成具有神经营养作用的可溶性APP,与进一步在γ-分泌酶的作用能裂解成无神经细胞毒性P3-40、P3-42的C83。只有极少数的APP才在β-分泌酶的作用下裂解成β-APPs与C99,C99在γ-分泌酶的作用下最终裂解成Aβ40和Aβ42,其中Aβ42更容易聚集,具有较强的细胞毒性。因此,脑内Aβ42产生与清除机制的平衡遭到破坏,导致Aβ42在脑内过多堆积,呈现出弥散型斑块即SP。当然,Aβ42的聚积还可促使氧化应激、Ca2+内流,导致线粒体功能紊乱,神经细胞产能障碍,激活了神经细胞凋亡机制的表达。Aβ42还可破坏机体胆碱能系统,激发脑内炎症反应,损伤神经轴突和突触,破坏神经元内离子的平衡,进而改变激酶/磷酸酶的活性,引起tau蛋白的過度磷酸化,形成神经纤维缠结(NFTs)[15]。可见,APP是Aβ的物质基础,而Aβ又是SP的核心成分,也是其形成的基础,亦与NFTs的形成高度相关,因此,APP、Aβ尤其Aβ1-42的大量堆砌将会激发氧化应激、破坏胆碱能系统等多种机制、通过多种途径促成AD的发生。
本研究结果显示,当归多糖可显著缩短模型大鼠逃避潜伏期,延长目标象限滞留时间,缩短首次到达原逃生平台位置潜伏时间,增加穿越原平台次数,并可显著提升血清Ach含量与ChAT、SOD活性,降低血清AChE活性、MDA水平及海马APP、Aβ1-42含量,改善模型大鼠的学习记忆能力,对AD具有一定的防治作用,其可能与促进Aβ的代谢、改善胆碱能神经递质及提升抗自由基氧化能力等多种途径有关。
参考文献:
[1] 吴红彦,李海龙,王虎平,等.大剂量当归对东莨菪碱致痴呆小鼠模型学习记忆及AchE、ChAT活性的影响[J].时珍国医国药,2013,24(3):552-554.
[2] 杨植媛,吴红彦,李海龙,等.当归含药血清对阿尔兹海默病细胞模型损伤的保护作用[J].辽宁中医杂志,2014,41(1):164-167.
[3] PAXINOS G, WATSON C.The rat brain in stereotaxic coordinates[M]. 5th ed.San Diego:Elsevier Academic Press,2005:82-84,114-116.
[4] 李檬.老年期痴呆发病机制研究进展及预防对策[J].海军医学杂志, 2005,26(1):81-82.
[5] BALLARD C, GAUTHIER S, CORBETT A, et al. Alzheimer's disease[J]. Lancet,2011,377(9770):1019-1031.
[6] WEUVE J, PUETT R C, HWARTZ J, et al. Exposure to partculate air pollutionand cognitive decline in older women[J]. Air Intern Med,2012,172(3):219-227.
[7] POWER M C, WEISSKOPF M G, ALEXEEFF S E, et al. Traffic related air pollutionand cognitive function in a cohort of older men[J]. Environ Health Perspec,2011,119(5):682-687.
[8] 李浩,高普.实用老年疾病诊断与治疗[M].北京:科学技术文献出版社,2000:656-667.
[9] BAMBERGER M E, HARRIS M E, MC DONALD D R. A cell surface receptor complex for fibrillar beta-amyloid mediates microglial activation[J]. J Neurosci,2003,23(7):2665-2674.
[10] PIMPLIKAR S W. Reassessing the amyloid cascade hypothesis of Alzheimer's disease[J]. Int J Biochem Cell Biol,2009,41(6):1261- 1268.
[11] 吴红彦,王虎平.以肝脾论治老年性痴呆及逍遥散对老年痴呆模型小鼠学习记忆能力、中枢胆碱能神经元活性的影响[J].中国实验方剂学杂志,2010,16(5):168-170.
[12] 王虎平,吴红彦.逍遥散对阿尔茨海默病模型小鼠血清及脑组织匀浆中SOD、GSH-Px活性及MDA水平的影响[J].甘肃中医学院学报,2013, 30(6):1-3.
[13] 吴红彦,李海龙,张云,等.黑逍遥散对东莨菪碱致痴呆小鼠模型的影响[J].中国中医药信息杂志,2013,20(10):35-37.
[14] BALARAMAN Y, LIMAYE A R, LEVEY A I. Glycogen synthase kinase 3 beta and Alzheimer's disease:pathophysiological and therapeutic significance[J]. Cell Mol Life Sci,2006,63(11):1226- 1235.
[15] 陳红,赵鹏,孙亚平.阿尔茨海默病发病机制研究进展[J].生物技术世界,2015,31(10):99-100.
(收稿日期:2017-06-04)
(修回日期:2017-07-04;编辑:华强)
