苯那普利和氯沙坦对肾间质纤维化幼鼠组织型转谷氨酰胺酶和转化生长因子-β1的抑制作用*
2018-07-12赵晓华刘宝环李冠慧
赵晓华,刘宝环,李冠慧,马 宏
(1.河北省沧州市人民医院儿科 061000;2.山西医科大学第一临床医院儿科,山西太原 030001)
肾脏纤维化是各种不同病因的慢性肾脏疾病进展到终末期肾病的共同病理过程,包括肾小球硬化与肾间质纤维化[1]。近年来大量研究表明,肾功能的损伤程度与肾小管间质病变的严重程度密切相关[2]。肾小管间质损伤程度是反映肾功能下降严重程度和判断预后最重要的指标。因此,研究肾间质纤维化的分子机制,探索有效的防治措施,对延缓终末期肾病的进程,延长患者生命意义重大。肾小管间质纤维化是多种疾病引起肾损伤的重要病理特征,也是导致肾功能不可逆改变的重要病理基础之一。肾小管间质纤维化主要的病理表现:肾间质出现单核细胞及淋巴细胞的浸润,肾小管足细胞受损变形,肾间质成纤维细胞活化增生,细胞外基质大量沉积,形成瘢痕硬化[3-5]。
目前对于肾间质纤维化的原因尚未完全阐明,但是已有研究证实,有多种细胞因子和血管活性物质的产生和释放与纤维化形成有关,其中转化生长因子-β1(TGF-β1)是重要的诱导因子,很多其他的细胞因子是通过TGF-β1来发挥作用。这些诱导因子共同作用于肾脏组织和细胞,使得肾小管上皮细胞和肾间质细胞凋亡增加,细胞外基质合成增加,最终导致细胞外基质的大量沉积而出现肾间质纤维化[6-7]。近年来发现TGF-β1对组织型转谷氨酰胺酶(tTG)具有调节作用,研究表明,tTG可以使细胞外基质蛋白之间形成难降解的氨基酸肽键促进基质蛋白的沉积,因此tTG也被认为是导致肾脏纤维化的重要诱导因子[8]。
血管紧张素转化酶抑制剂(ACEI)及血管紧张素Ⅱ受体拮抗剂(ARB)通过降低系统高血压及肾小球内高压的肾脏保护作用已为人们熟知,但它们的抗纤维化作用近年来才引起重视[9-10]。不仅已在动物实验证实其抗纤维化作用,也是目前临床上广泛用于抗肾脏及心脏纤维化的药物。本研究探讨ACEI药物苯那普利及ARB药物氯沙坦对幼鼠肾间质纤维化过程中TGF-β1和tTG的影响,以期为研究肾间质纤维化的发生、发展及治疗提供一些实验依据。
1 材料与方法
1.1动物分组及模型建立雄性wistar幼鼠60只,3~4周龄,体质量80~100 g,正常饮食,适应性喂养3 d,按照随机数字表法分为对照组、模型组和干预组,每组20只。对模型组和干预组幼鼠建立单侧输尿管结扎模型(UUO模型),具体方法:5%水合氯醛6 mL/kg腹腔注射麻醉,幼鼠下腹部常规备皮、消毒,腹正中切口,分离输尿管,双线结扎左侧输尿管,并从中间剪短,缝合切口。对照组幼鼠仅分离输尿管,不结扎和剪短,之后缝合。
1.2干预方法干预组从建模后第2天起灌胃给予苯那普利和氯沙坦各6 mg/(kg·d),1次/天;对照组和模型组灌胃给予等量生理盐水。且于实验开始后第3、7、14、28天每组取5只鼠,切取左肾,固定、脱水、石蜡包埋制成标本,4 ℃保存备用。
1.3检测指标(1)HE染色:3 μm石蜡切片脱蜡至水,苏木素-伊红(HE)染色,观察肾组织结构情况、肾间质炎性浸润情况。(2)Masson染色:采用200倍光学显微镜采集染色图像,运用多功能彩色病理图像分析系统进行测量分析,计算肾间质纤维化组织相对面积(绿染区面积/总面积×100%),求和取平均值作为肾间质纤维化得分,用以评价肾间质纤维化程度。(3)免疫组化染色:采用非生物素标记的PV6001二步法,检测3组肾组织tTG、TGF-β1的表达,所用一抗、二抗来自中杉金桥生物技术有限公司和Newmaker公司,严格按照说明书进行各项操作。采用图像分析软件分析结果,观察200倍光学显微镜下图像15~25个,计算阳性染色区域的平均光密度值。

2 结 果
2.13组幼鼠肾组织结构变化情况术后3组幼鼠恢复良好,无明显感染和死亡情况发生。HE染色结果显示对照组肾脏组织无明显病理改变,肾小管排列整齐,肾间质无炎性细胞浸润。模型组幼鼠第3天时可见小部分肾小管出现,局部组织炎性细胞浸润;随着时间的延长(第3天→第7天→第14天→第28天)肾小管广泛扩张,小管上皮细胞出现空泡样变性,部分出现蛋白或管型,肾组织有大量炎性细胞浸润。干预组肾小管部分扩张,扩张程度低于模型组,但仍高于对照组。Masson染色结果显示对照组肾间质无明显绿染,模型组绿染面积显著增加,干预组小部分绿染,方差分析结果显示,3组之间绿染面积比较,差异有统计学意义(P<0.01),且随着时间延长,模型组和干预组绿染面积逐渐增加(P<0.01)。见表1。
2.23组幼鼠不同时间点tTG蛋白表达情况 tTG阳性表达为棕黄色颗粒沉积。免疫组化结果显示,对照组tTG肾间质和肾小球区域未见棕黄色颗粒沉积,且不同时间点比较差异无统计学意义(P>0.05),模型组自第3天时肾间质可见棕黄色颗粒沉积,随着时间延长(第3天→第7天→第14天→第28天),染色逐渐加深(P<0.01),呈片状沉着。干预组在肾间质区可见淡黄色颗粒沉积,随时间延长有增加趋势(P<0.01)。3组光密度值比较,差异有统计学意义(P<0.01)。见表2。
2.33组幼鼠不同时间点TGF-β1蛋白表达情况TGF-β1阳性表达为棕褐色颗粒沉积。免疫组化结果显示,对照组TGF-β1主要在肾小管上皮细胞见褐色颗粒沉积,模型组颜色加深,且在肾间质区域可见到棕褐色颗粒,随着时间延长(第3天→第7天→第14天),染色逐渐加深(P<0.01)。干预组在肾间质区可见少量颗粒沉积,随时间延长有增加趋势(P<0.01)。3组TGF-β1光密度值比较,差异有统计学意义(P<0.01)。见表3。
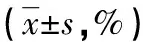
表1 3组幼鼠不同时间点Masson绿染面积百分比比较
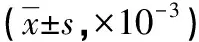
表2 3组幼鼠不同时间点tTG光密度值比较
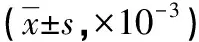
表3 3组幼鼠不同时间点TGF-β1光密度值比较
2.4相关性分析Pearson相关性分析结果显示,模型组幼鼠tTG水平与Masson染色面积呈正相关关系(r=0.854,P<0.01);tTG水平与TGF-β1水平呈正相关关系(r=0.813,P<0.01)。
3 讨 论
肾脏纤维化是各种终末期肾病常见的病理变化,多是由于各种致病因子的长期作用,导致肾间质细胞增加,蛋白合成增多,细胞外基质大量沉积导致肾小球和肾小管纤维化。肾脏纤维化一般分为3个阶段:第1阶段为炎性反应期,各种细胞因子及分泌物不断作用于肾脏,导致炎性细胞出现浸润,出现肾脏固有细胞的损伤;第2阶段为基质合成阶段,主要表现为细胞外基质开始沉积,以及细胞因子和炎性因子等纤维化因子进一步释放;第3阶段为纤维化形成阶段,该阶段肾脏已成为纤维化样物质[11]。
随着肾脏纤维化的研究逐渐深入,目前已知的肾脏纤维化诱导因子包括TGF-β1、缺氧诱导因子-1α、结缔组织生长因子、血管内皮生长因子及肿瘤坏死因子等,以上因素作用于肾脏组织和细胞,可以增加肾脏细胞外基质的合成或(和)抑制其降解,共同参与肾脏纤维化病理过程[12-13]。TGF-β主要来源于血小板、淋巴细胞和单核细胞。已有研究表明TGF-β包括5个不同的亚型(TGF-β1~5),其中TGF-β1在致纤维化过程中发挥重要作用,其他多种诱导因子通过直接或者间接作用于TGF-β1起作用[14-15]。有研究表明,基质金属蛋白酶(MMP)是降解细胞外基质的主要酶,TGF-β1能影响成纤维细胞中MMP-2的基因表达和转录,导致MMP-2蛋白生成减少和活性降低,降解细胞外基质的能力下降[16-17]。tTG是TGF-β1活化的重要酶类之一,近年来有研究表明,tTG也可能导致肾脏纤维化,生理情况下TGF-β1以潜活性的复合物形式分泌出细胞,其激活的前提是TGF-β1与其前肽解离。tTG催化TGF-β1连接蛋白(LTBP)与细胞外基质(ECM)交联,从而使TGF-β1与其潜活相关肽解离,释放出活性结构[18]。tTG导致的TGF-β1的活化反过来可以引起tTG的基因表达,两者组成一个有效的放大系统。有研究通过培养人肾间质成纤维细胞在蛋白质和mRNA水平证实该细胞有tTG表达,TGF-β1可以上调肾间质成纤维细胞tTG的表达,两者之间存在时间、剂量依赖性,说明TGF-β1对肾间质成纤维细胞tTG表达的调节依赖于其mRNA的合成。而TGF-β1与tTG的这种正反馈机制在细胞外基质聚集和纤维化形成中有重要意义。有研究对tTG基因敲除的大鼠行单侧输尿管梗阻术后发现,TGF-β1的蛋白表达量较未敲除大鼠减少,其肾间质纤维化程度较未敲除的大鼠明显减轻。tTG可能通过以下的机制促进肾间质纤维化:(1)催化形成ε-(γ-谷氨酰基)赖氨酸肽键,使蛋白分子内和分子间形成稳定的交联产物,而使细胞外基质更加稳定;(2)激活促纤维化的重要因子,即组织生长因子TGF-β1,并形成正反馈;(3)上调结缔组织生长因子(CTGF)的表达,而CTGF和TGF-β1均可以通过刺激肾小管上皮细胞、肾间质成纤维细胞分泌tTG至肾间质中,导致细胞外基质蛋白交联;(4)介导新型的细胞凋亡方式,主要发生在肾小管上皮细胞,促进肾小管的萎缩,肾间质纤维化的发生。此外,tTG还可以作用于胰岛素样生长因子、血小板源性生长因子(PDGF)促进肾间质纤维化的发生、发展。
本研究HE染色结果显示,对照组肾脏组织无明显病理改变,肾小管排列整齐,肾间质无炎性细胞浸润。模型组幼鼠3 d时可见小部分肾小管出现,局部组织炎性细胞浸润;随着时间的延长(第3天→第7天→第14天→第28天)肾小管广泛扩张,小管上皮细胞出现空泡样变性,部分出现蛋白或管型,肾组织有大量炎性细胞浸润。干预组肾小管部分扩张,扩张程度低于模型组,但仍高于对照组。Masson染色结果显示对照组肾间质无明显绿染,模型组绿染面积显著增加,干预组小部分绿染,方差分析结果显示,3组之间绿染面积比较,且随着时间延长,模型组和干预组绿染面积逐渐增加。说明苯那普利和氯沙坦对治疗肾脏损伤的效果减少,可以明显降低细胞外基质的沉积,改善纤维化程度。免疫组织化学结果显示,对照组TGF-β1主要在肾小管上皮细胞见褐色颗粒沉积,模型组颜色加深,且在肾间质区域可见到棕褐色颗粒,随着时间延长,染色逐渐加深。干预组在肾间质区可见少量颗粒沉积,随时间延长有增加趋势(P<0.01)。3组TGF-β1光密度值比较,差异有统计学意义(P<0.01)。tTG阳性表达为棕黄色颗粒沉积。免疫组织化学结果显示,对照组tTG肾间质和肾小球区域未见棕黄色颗粒的沉积,且不同时间点比较差异无统计学意义(P>0.05),模型组自第3天时肾间质可见棕黄色颗粒沉积,随着时间延长(第3天→第7天→第14天→第28天),染色逐渐加深(P<0.01),呈片状沉着。干预组在肾间质区可见淡黄色颗粒沉积,随时间延长有增加趋势(P<0.01)。3组tTG光密度值比较,差异有统计学意义(P<0.01)。该结果说明苯那普利和氯沙坦可以通过抑制TGF-β1和tTG起到抗纤维化作用。
综上所述,肾间质纤维化过程中tTG与TGF-β1呈正相关关系,苯那普利和氯沙坦抗纤维化作用可能与抑制tTG、TGF-β1有关。
