偕胺肟基与金属有机骨架UiO-66对水中铀吸附协同作用的研究
2018-07-12殷晓慧刘建明熊振湖
殷晓慧,刘建明,熊振湖
(天津城建大学 a.天津市水质科学与技术重点实验室;b.环境与市政工程学院,天津 300384)
铀是核反应堆中核能的主要来源,是核废料产生的主导成分,但铀矿是相当有限的,并且预期不久的将来会出现短缺.另一方面,作为典型的核燃料,铀具有放射性和高毒性[1],一旦进入人体,将会对内部器官造成不可逆的损害[2].因此,从能源安全和环境保护的观点出发,高效回收水溶液中的铀是极其重要的.目前,已有多种方法从水溶液中去除铀,例如物理、化学和生物技术.这些技术中,吸附已被证实是最有效和价廉的方法,原因是其成本低、操作简单且高效[3].多孔材料之一的金属有机骨架(MOFs),由于其超大的比表面积、稳定可调的孔隙结构以及表面易被修饰等特点,已经被一些研究者作为固相吸附剂从环境样品中捕获有毒的重金属,如铜、铅、锌、铀等.例如Luo等人研究了多孔和稳定的金属有机骨架UiO-66及其胺衍生物吸附水溶液中的铀[4].
众所周知,作为吸附剂的MOFs材料在水溶液或酸性介质中需要具有稳定性.Cavka等人首先合成了命名为UiO-66的锆(IV)二羧酸多孔材料[5],并且证实它具有大的比表面积和前所未有的化学稳定性.这种稳定性来源于锆(IV)的高度亲氧性以及MOFs材料中SBU(Zr6簇)的形成使其对各种溶剂和高温产生了耐受性,孔隙(6A)大到足以容纳铀酰离子,但其对于铀在中性环境下吸附效果显著,而在偏酸性的条件下,吸附较差.海水和工业废水的pH通常为4~6,偏酸性.UiO-66对其中的铀有较好的吸附效果,UiO-66一系列衍生物如UiO-66-NH2等,可能是由于芳香胺的活性较低,减小了表面积并形成了分子间的氢键,未能促进铀的吸附.在几百种官能团筛选后,偕胺肟基含有亲核的氨基和羟基官能团,可以有效地结合铀的各种底物,被认为是吸附含铀离子最有效的配体.例如Zhao等人合成出偕胺肟官能化的Fe3O4@SiO2核壳磁性微球,研究其对U(VI)的有效吸附[6].
之前的研究结果突出了偕胺肟基和MOFs材料吸附分离水溶液中铀的巨大潜力.在本文中,首次利用偕胺肟基修饰金属-有机框架UiO-66,制备新型的UiO-66-AO,用以研究偕胺肟基和金属有机骨架UiO-66对于水中铀吸附的协同作用.采用傅里叶变换红外光谱、热重分析仪,对合成样品进行表征.通过批次实验,研究了各种条件对于吸附的影响.期待可以获得在各种水环境pH条件下,对铀均具有效吸附和分离的吸附材料.
1 材料与方法
1.1 材料
ZrCl4购于山东西亚化学工业有限公司;2-氨基对苯二甲酸(NH2-H2BDC)购于梯希爱(上海)化成工业发展有限公司;UO2(NO3)2·6H2O购于湖北楚盛威化工有限公司;乙醇、N,N-二甲基甲酰胺和盐酸羟胺购于天津市风船化学试剂科技有限公司;戊二醛购于天津博迪化工股份有限公司;无水K2CO3购于天津市江天化工技术有限公司.所有化学品均为分析纯或更高纯度,直接使用无需进一步纯化.
1.2 制备UiO-66-AO
根据文献提供的方法[5]合成UiO-66-NH2.简要过程如下:将 NH2-H2BDC(1.688 3 g)、ZrCl4(2.172 g)、DMF(120 mL)和4 mL浓盐酸加入到150 mL聚四氟乙烯内衬的高压反应釜中,将反应釜放入到事先设定好压强0.2 MPa和温度120℃的干燥箱中加热24 h.冷却后,离心回收微晶沉淀物.在160℃的DMF中回流24 h,以去除仍然粘附在UiO-66-NH2上残余的DMF和NH2-H2BDC前体物,然后再用DMF(3×800 mL)和乙醇(3×800 mL)洗涤.最后将UiO-66-NH2固体产物在大气压力下于80℃干燥过夜.
根据之前的文献[6]首次提出合成UiO-66-AO的新方法.将上述制备的UiO-66-NH2(2.5 g)分散在由5 mL戊二醛和500 mL乙醇组成的溶液中.在连续搅拌下反应3 h,以产生醛基.离心收集产物,用蒸馏水和乙醇洗涤.将这个被戊二醛处理过的颗粒物悬浮在由2.5 g二氨基马来腈(DAMN)和500 mL乙醇组成的溶液中.在室温下反应3 h之后,洗涤并分离出固体(UiO-66-DAMN),然后加入5.0gK2CO3,5.0gNH2OH·HCl和50/450 H2O-C2H5OH(500 mL)组成的溶液中,在一个封闭烧瓶中80℃加热6 h.离心分离出UiO-66-AO最终产物,用蒸馏水和乙醇洗涤,在60℃下减压干燥.
1.3 吸附材料的表征
使用一台分辨率优于0.4 cm-1的Nicolet iS10傅里叶红外(FTIR)光谱仪收集样品的IR光谱,扫描范围在 500~4 000 cm-1.一台 Perkin-Elmer Diamond TG/DTA热分析仪在流速为25 mL/min的Ar或空气中进行样品的热重分析(TGA),加热速度为10℃/min.
1.4 吸附实验
使用一台温控摇床在所需温度下进行间歇实验,研究吸附剂对水溶液中铀(Ⅵ)的吸附能力,所有实验均在含有一定量的吸附剂和50 mL铀酰离子溶液的250 mL锥形瓶中进行.用去离子水制备所需浓度的铀酰离子溶液.
使用数字Trans Wiggens PH600测定pH值,并通过体积可忽略不计的NaOH或HNO3溶液调整pH.将0.02 g吸附剂加入到50 mL质量浓度为50 mg/L的铀溶液的一系列锥形瓶中,将锥形瓶在室温和140 r/min下振摇,在预定的时间取出锥形瓶,过滤后测试滤液中溶质的浓度,以研究吸附动力学.在吸附剂质量浓度为0.2~2.0 g/L范围内研究固-液比对铀吸附的影响,并在20~160 mg/L的铀初始质量浓度范围内进行吸附热力学的研究.对20 mg吸附剂与含有铀和其他共存金属离子的50 mL溶液摇床24 h,研究共存离子对UiO-66-AO吸附铀(Ⅵ)的影响.
达到吸附平衡时间后,用一个注射过滤器将溶液过滤.使用一台UV–VIS分光光度计(T6,北京普析通用仪器有限公司),采用U(VI)-偶氮胂III络合物分光光度法[7]在610 nm波长下测定过滤清液中U(VI)的剩余浓度.吸附百分比和平衡铀(Ⅵ)吸附容量的计算公式为

式(1)-(2)中:C0和 Ce分别是铀(Ⅵ)溶液初始和平衡时的质量浓度,mg/L;V是铀溶液的体积,L;m是吸附剂的质量,g.
所有实验进行3次,在数据分析中使用平均值.
2 结果与讨论
2.1 吸附剂的表征
图1显示出UiO-66,UiO-66-AO和Fe3O4@SiO2-AO 3种吸附剂的红外光谱图.UiO-66的红外谱中有来自芳香环和羧酸基团的若干吸收峰[8]:1 420 cm-1处的峰归因于C—C振动模式,1 580 cm-1处的峰是羧基C—O键伸缩振动.Fe3O4@SiO2-AO的IR光谱中,1 072 cm-1的宽带与Si—O—Si和Si—O—H的伸缩振动有关,1 652 cm-1和951 cm-1处的峰分别对应于偕胺肟基CN双键和N—O的伸缩振动[9].从UiO-66-AO的IR光谱中可以看出,在1 420 cm-1和1 580 cm-1处有UiO-66的相关峰,而在1 652 cm-1和951 cm-1处出现偕胺肟基的相关峰,这表明偕胺肟基对于UiO-66的成功修饰.


图1 FT-IR光谱
图2给出了UiO-66和UiO-66-AO的热重曲线.UiO-66和UiO-66-AO的热重曲线都展示出从室温到150℃一系列微小的重量损失.低于100℃的重量损失可以归于游离羧基的失去.其次,因为配体在250~500℃分解,UiO-66和UiO-66-AO的重量损失多发生这个阶段.当温度处于500~600℃时,吸附剂的重量几乎保持不变,表明有机质已在500℃分解完毕.UiO-66-AO的残余重量比UiO-66的低,原因是UiO-66-AO含较大的有机质残基(偕胺肟基).

图2 热重曲线
2.2 初始pH的影响
溶液的pH值是吸附反应的重要参数,因为它显著影响金属离子的形态以及表面电荷和吸附剂的结合位点[10].在溶液初始pH值2至8的范围内,t=24 h,msorbent=0.02 g,Vsolution=50 mL,C0=50 mg/L,T=25 ℃的条件下,研究UiO-66,Fe3O4@SiO2-AO和UiO-66-AO对U(VI)的吸附,以评估溶液初始pH值对 U(VI)吸附的影响.图3给出了溶液初始pH对U(VI)吸附的影响.如图 3所示,UiO-66对于 U(VI)的吸附容量在pH为2至4很低,但其后陡增,最后趋于平缓,当pH达到8时,吸附容量超过100 mg/g.Fe3O4@SiO2-AO对于U(VI)的吸附容量先是逐渐增加,在pH=5附近趋于平缓且达到最大,超过100mg/g,之后逐渐降低.这种pH依赖吸附可以通过吸附剂的表面电荷合理解释.在较低pH下,吸附剂上的活性位点是质子化的并且带正电荷,UO22+是溶液中主要的阳离子,由于静电排斥作用,带正电的U(VI)离子不利于与带正电荷的活性位点的结合,从而导致吸附容量较低.随着pH的增加,活性位点去质子化,结合基团和U(VI)离子之间的静电斥力减少甚至消失,配位作用或氢键作用增加了吸附容量.另一方面,pH诱导U(VI)形态也可以导致pH依赖性吸附.众所周知,随着pH增大,U(VI)物种逐渐从游离UO22+变成多核的氢氧化配合物,例如(UO22+)3(OH)5+[11],这些羟基配合物可能更受到吸附剂的青睐.之所以它们达到最高吸附容量时所对应的pH不同,是由于吸附剂本身的质子化程度不同造成的.
利用以上两种吸附剂对铀吸附的特点,本研究所制备的UiO-66-AO对U(VI)的吸附,在pH值2至5范围内逐渐增加,pH为5时达到最大,超过100 mg/g,且pH在5以后一直稳定在最大吸附容量.可以看出,UiO-66-AO对U(VI)的最大吸附容量具有更宽泛的初始pH范围,弥补了UiO-66和Fe3O4@SiO2-AO对U(VI)最大吸附容量保持在较小pH范围内的不足,对于含U(VI)水体的处理具有重要意义.

图3 pH对U(VI)吸附的影响
进一步进行铀酰离子的水解实验[12].分别测定25℃下,50 mL初始质量浓度50 mg/L的铀酰离子溶液在pH 值为 5.02,5.56,5.92,6.44,6.54 下的吸光度,并根据公式:水解率(%)=(Ae-A0)/A0计算其水解率,公式中A0是溶液原始的吸光度,Ae是pH调节后溶液的吸光度.表1是不同pH值下铀酰离子的水解率,从表1中可以看出,初始质量浓度50 mg/L的铀酰离子溶液,在pH超过6以后开始发生水解沉淀.因此,选择pH=5.5±0.1作为最适条件用于进一步研究其他因素对UiO-66-AO吸附U(VI)的影响.
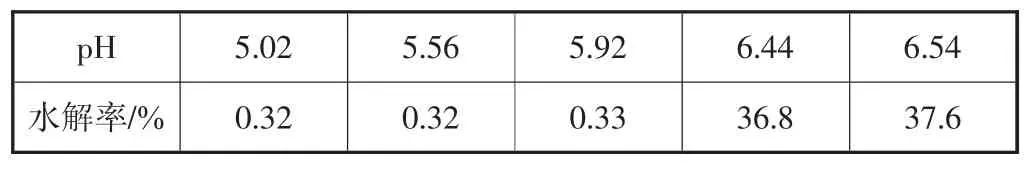
表1 不同pH值下铀酰离子的水解率
2.3 接触时间和吸附动力学
在 pH=5.5 ± 0.1,msorbent=0.02 g,Vsolution=50 mL,C0=50 mg/L,T=25℃的条件下,研究时间对UiO-66-AO吸附U(VI)的影响,结果示于图4.很显然,吸附速率在开始的500 min相对较快,之后逐渐到达吸附平衡.短的平衡时间归因于铀与偕胺肟官能团的强螯合作用以及金属有机骨架最初大的孔体积.800 min后,对于U(VI)的去除率可达到90%以上,且铀的吸附平衡容量为106 mg/g.根据动力学数据,选择24 h作为吸附时间,以保证在后续实验中U(VI)在UiO-66-AO上的吸附达到平衡.
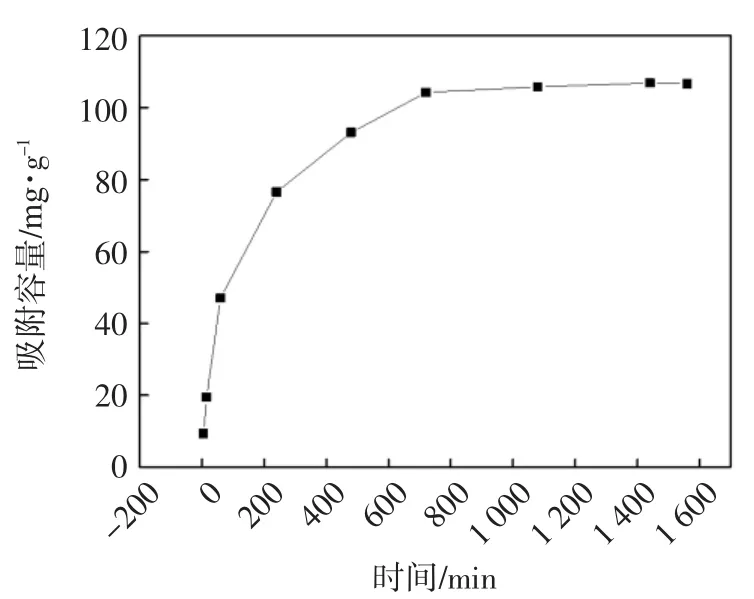
图4 接触时间对U(VI)吸附的影响
吸附过程采用准一级和准二级两个动力学模型来描述.
准一级动力学模型解释了基于吸附剂容量的吸附过程,该模型可由如下公式给出[13]

准二级模型考虑了包括外膜扩散、吸附、内孔扩散的整个吸附过程,该模型可表达为

式(3)-(4)中:qe和 qt分别是 U(VI)在平衡时间和在时间t的吸附量,mmol/g;k1是准一级动力学速度常数,h-1;k2是准二级模型的动力学速度常数,g/(mmol·h).
根据ln(qe-qt)对t的线性图形,可以获得准一级模型的k1和理论qe值(qe,cal).图5是t/qt对t的线性图形,从图中可以获得准二级模型的k2和qe,cal值.表2为UiO-66-AO吸附U(VI)的动力学参数.从表2的UiO-66-AO吸附U(VI)的动力学参数中很明显可以看出,准二级模型的相关系数(R2=0.998 9)大于准一级模型的相关系数(R2=0.968 2).此外,准二级模型的 qe,cal值(qe,cal=112.612 6 mg/g)与实验值(qe,exp=106 mg/g)更接近.这些结果表明准二级模型比准一级模型更好地拟合了动力学数据.这个现象进一步暗示U(VI)在UiO-66-AO上的吸附是化学吸附或者表面络合,而不是质量传递[14].

图5 UiO-66-AO吸附铀(VI)的准二级吸附动力学
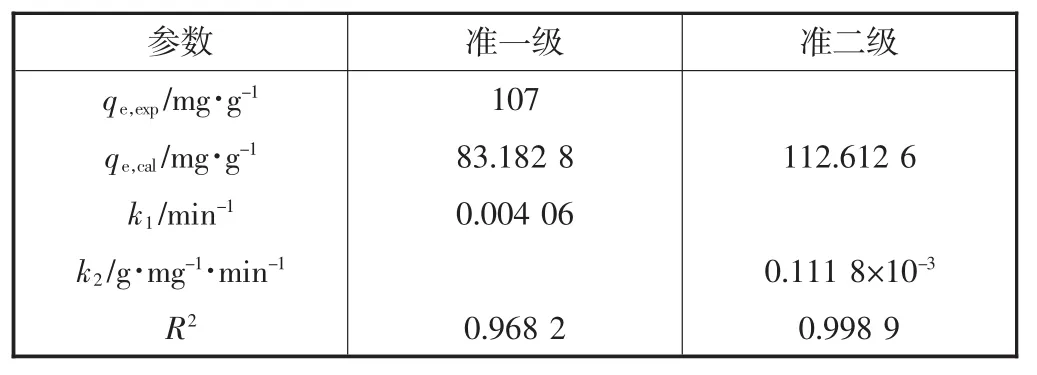
表2 UiO-66-AO吸附U(VI)的动力学参数
2.4 固液比的影响
本研究中UiO-66-AO的用量对于经济成本是十分重要的.吸附剂的使用量越低,该应用的成本越低,该研究的意义越大.在吸附剂质量浓度为0.2~2.0 g/L范围内,pH=5.5 ± 0.1,C0=50 mg/L,T=25 ℃,t=24 h的条件下,研究固液比对铀(VI)吸附的影响,结果示于图6.
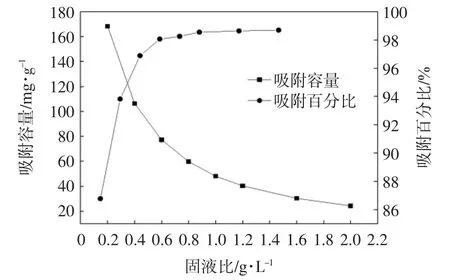
图6 固液比对U(VI)吸附的影响
从图6中可以看出,铀(VI)的吸附百分比随着固液比从0.2 g/L增加至0.8 g/L而显著增加,这是可以预期到的,因为增加溶液中吸附剂的含量可以提供更多的吸附位点,0.8 g/L以后趋于平缓,吸附百分比的提高是相对较少的.而铀(VI)的吸附容量在0.2~2.0 g/L范围内,呈逐渐下降的趋势.随着固液比的升高,铀(VI)的吸附容量呈逐渐下降的趋势,很明显是由于溶液中吸附剂的含量增加,而导致单位质量吸附剂的吸附量降低.
因此,为了使得铀(VI)更易与吸附位点结合,从经济和吸附效果两方面考虑,选择0.4 g/L作为所有实验的最佳固液比.
2.5 吸附等温线及热力学研究
为确定铀在UiO-66-AO上的最大吸附容量,进行吸附等温线的研究.图7给出了不同温度(10℃,25 ℃,40 ℃),pH=5.5 ± 0.1,msorbent=0.02 g,Vsolution=50 mL,t=24 h条件下,UiO-66-AO 对于铀(20~160 mg/L)的吸附等温线.从图7中可以看出,恒定初始浓度下,qe随着温度的升高而逐渐增大并在40℃达到最大值.这表明温度是影响UiO-66-AO对于铀吸附容量的一个重要因素.还可发现,铀剩余质量浓度(C0)为73 mg/L条件下,3个温度的平衡吸附量分别达到了 123.8,194.8,227.8mg/g.实验结果表明 UiO-66-AO是一种捕获铀的优良吸附材料.同时,也可以发现,当铀初始质量浓度较低时(例如初始质量浓度为20 mg/L,剩余质量浓度接近于0 mg/L),3个温度下的平衡吸附量变化不大(在10,25,40℃下的qe值依次为36.9,36.9,49.0 mg/g).这说明在外界环境正常变化范围内UiO-66-AO吸附去除实际水体中低浓度铀的能力基本不受温度影响或受影响较小.
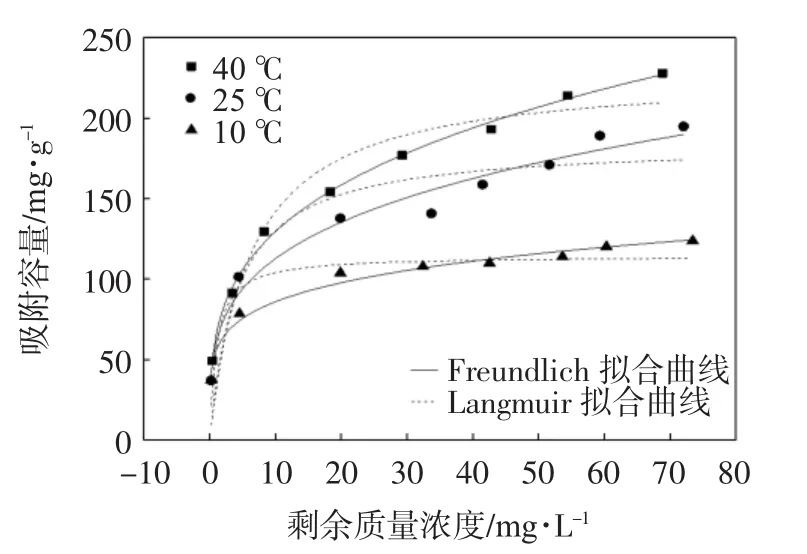
图7 浓度对U(VI)吸附的影响
在该研究中选择两个经典的等温线模型即Langmuir和Freundlich模型,以确定等温线参数.
Langmuir等温线模型表明吸附发生在均匀吸附剂表面可提供相同能力的部位,每个位点携带分子的数量相等且吸附分子之间没有相互作用.它可以由如下的线性形式表示[15]

式中:Ce是溶液中 U(VI)的平衡浓度,mg/L;qe是平衡时的吸附量,mg/g;Q0是最大吸附容量,mg/g;KL是Langmuir常数,L/mg.
Freundlich等温模型用于不均匀表面能系统,吸附剂异质表面上吸附热和亲和度是不均匀分布的,并且由下式表示

式中:qe是平衡吸附量,mg/g;KF是 Freundlich 常数,mg/g;1/n是异质性因子,1/n的值表示等温线的类型是不可逆的(1/n=0),有利的(0<1/n<1)和不利的(1/n>1).
图7也给出了Langmuir和Freundlich模型对吸附等温线数据的拟合曲线(相关参数列在表3中).Freundlich模型拟合的等温线数据在图7中用实线表示,其相关系数较大,这表明Freundlich模型比较准确地拟合了吸附等温线数据.
与Langmuir等温吸附模型(虚线)有关的qmax,常数KL也总结在表3中.在10℃时,qmax的评估值为114.4 mg/g,而在25℃和40℃下qmax分别增加到184.1 mg/g和228.1 mg/g.可见,通过升高温度可促进吸附容量达到更高的水平.此外,表3中的Langmuir等温线模型的KL值随温度的升高而降低,也证实了高温有利于铀在UiO-66-AO上的吸附,说明U(VI)在UiO-66-AO上的吸附是吸热反应.

表3 UiO-66-AO吸附铀的Langmuir和Freundlich的等温线模型常数
从表 3中可以发现 Freundlich模型的 R2比Langmuir等温吸附模型的R2高,表明Freundlich模型描述吸附数据的准确程度高于Langmuir模型.Freundlich模型认为吸附过程可以是单分子层的和多分子层的吸附,而单层代表化学吸附,多层则是物理吸附.可能的化学吸附是由于偕胺肟基与铀酰离子的强螯合和UiO-66对铀吸附的共同作用.等温吸附数据还表明UiO-66-AO属于不均匀表面能系统,吸附剂异质表面上吸附热和亲和度是不均匀分布的,这是由于偕胺肟基在UiO-66上的不均匀分布所导致的.根据表3中的Freundlich模型常数KF和n值,可知所有实验温度下的n值都大于1,可以推测在铀与UiO-66-AO纳米微粒之间存在亲和性,而它们之间的吸附主要是化学吸附.
3 结论
本文在研究相关文献的基础之上首次合成了偕胺肟基修饰的金属-有机框架UiO-66(UiO-66-AO).采用傅里叶变换红外光谱、热重分析仪,对合成样品进行表征,证明了UiO-66-AO的成功合成.通过批次实验,研究了接触时间、pH、固液比、温度和初始铀离子浓度对于吸附的影响.吸附实验结果表明:800 min后,对于U(VI)的去除率可达到90%以上,吸附过程符合准二级动力学模型,进一步暗示U(VI)在UiO-66-AO上的吸附是化学吸附或者表面络合,而不是质量传递.UiO-66-AO相比UiO-66和Fe3O4@SiO2-AO对U(VI)的最大吸附容量具有更宽泛的初始pH范围.0.4 g/L为该研究的最佳固液比.吸附等温线与Freundlich模型有很好的一致性,表明该吸附属于不均匀表面能吸附,吸附剂异质表面上吸附热和亲和度是不均匀分布的,且反应自发,高温有利于该吸附过程.以上结论表明UiO-66-AO可被潜在性地作为高效材料用于从废水和海水中去除和回收U(VI).
