基于TLR9介导巨噬细胞极化效应探讨血管软化丸抗动脉粥样硬化的作用机制
2018-07-12秦合伟李彦杰任锟张志鑫赵晶邢若星原筝
秦合伟,李彦杰,任锟,张志鑫,赵晶,邢若星,原筝
(河南省中医院(河南中医药大学第二附属医院),河南 郑州 450002)
动脉粥样硬化(Atherosclerosis,AS)是心脑血管疾病最主要的病理改变基础。目前研究认为,AS的发生发展与内皮细胞损伤、脂质紊乱、免疫应答和与其相关的慢性炎症反应密切关系[1-2]。Toll样受体(toll like receptors,TLRs)在天然免疫反应和获得性免疫反应中均具有重要作用,研究表明TLRs与配体结合后迅速二聚化,通过募集大量衔接蛋白而活化受体,启动固有免疫系统,同时也可激活适应性免疫,Toll样受体9(Toll-like receptor 9,TLR9)是TLRs家族中重要的一员,在固有免疫和获得性免疫应答中都具有重要的作用,TLR9可通过影响巨噬细胞的极化状态从而影响AS的形成[3-4]。本研究旨在观察血管软化丸通过对TLR9调控,影响其TLR9下游信号NF-κB和IRF7水平,以及对巨噬细胞(M2/M1)的极化平衡状态的影响,揭示血管软化丸抗动脉粥样硬化的作用机制。
1 材料与方法
1.1 细胞与动物
本实验所用小鼠巨噬细胞株RAW264.7均来源于中国科学院上海生命科学研究所。本实验所用C57BL/6J小鼠(中国科学院上海生命科学研究所)12只作为正常组。ApoE-/-小鼠(南京大学模式动物研究所)共48只,SPF级,8周龄,体质量(18±2)g,雄性,随机分为ODN组、IRS组、中剂量组、高剂量组,每组12只。所有动物饲养于河南中医药大学SPF级动物实验中心。
1.2 药物与试剂
血管软化丸组方[5]:山楂30 g,建曲30 g,莱菔子15 g,陈皮12 g,清半夏9 g,茯苓15 g,连翘12 g,郁金12 g,枸杞子15 g,三七12 g,珍珠30 g,代赭石30 g。所用中药均来源于河南省中医院药剂科,通过医院煎药房煎煮和浓缩成不同浓度的汤剂(血管软化丸高剂量:浓度为3.456 g/mL;血管软化丸中剂量:浓度为1.728 g/mL)。
ODN1826和IRS869(上海生工生物工程股份有限公司);抗体NF-κB p65、NF-κB、TLR9、CD206、MyD88、CD68、IRF7(美国Abcam公司);抗体iNOS、α-actin(Santa公司);RT-PCR试剂盒(TaKaRa公司);总RNA逆转录试剂盒(Fermentas公司);细胞膜蛋白与细胞浆蛋白提取试剂盒(碧云天公司);ELISA试剂盒(eBioscience);其他化学试剂均由河南中医药大学实验中心提供。
1.3 血管软化丸含药血清的制备
SD大鼠20只分为空白组(不用药)和血管软化丸组。空白组给予蒸馏水灌胃,血管软化丸组给予1 g/mL的血管软化丸灌胃,连续灌胃1周后经腹主动脉采血,应用高速离心机12 000 g/min离心,离心后取上清液,56℃温度灭活,-80℃保存备用。
1.4 细胞培养分组及药物血清处理
小鼠巨噬细胞RAW264.7用含10%灭活胎牛血清以及双抗的DMEM高糖培养基,在37℃、5% CO2条件下常规培养瓶内培养,细胞呈贴壁生长,待48 h后更换培养基,细胞用细胞刮传代,待细胞进入对数期时进行实验。当细胞密度长至70%时,换成0.2%低血清培养基培养24 h,然后加相应刺激。实验主要分为对照组(空白血清)、血管软化丸中剂量组、血管软化丸高剂量组、IRS组(TLR9拮抗剂:IRS869)、ODN组(激动剂:ODN1826)。
1.5 Western Blot检测各组RAW264.7细胞TLR9蛋白的表达
收集细胞,PBS洗涤3次,用蛋白裂解液裂解总蛋白,提取蛋白,经定量后,加入缓冲液,加热使蛋白质变性,电泳分离蛋白,转膜至PVDF膜上。5%脱脂牛奶室温封闭,加入相应浓度的一抗,4℃孵育过夜,TBST洗涤3次。加入二抗,室温孵育,TBST洗涤3次。用碱磷酶化学发光进行显色。使用ImageJ软件分析条带灰度值[6]。
1.6 巨噬细胞表型的检测
采用免疫荧光双标化学染色检测RAW264.7细胞iNOS和CD206蛋白表达量,具体方法按照说明书步骤进行。
1.7 巨噬细胞相关炎症因子的检测
1.7.1RT-PCR法检测RAW264.7细胞中TNF-α mRNA的含量
巨噬细胞总RNA分离提取,使用Takara反转录试剂盒,将mRNA反转录为cDNA。TNF-α的引物序列为:上游引物5’-ACTCGCCACTCTCGACTCAAG -3’,下游引物5 ’-GACGGTGCCC GAGGCCAGAC-3’;具体方法按说明书步骤进行。采用比较CT值法对样品扩增的CT值进行计算,再按照以下方法计算出各个基因的相对表达量:△CT=目的基因CT-内参CT;△△CT=观察样本△CT-对照样本△CT;样本的相对表达量=2-△△CT。
1.7.2ELISA法检测RAW264.7细胞培养上清液中TNF-α的浓度
当细胞进入对数期时,刮下细胞,吸管吹匀,种到六孔板中,细胞贴壁12 h后,换成0.2%血清培养基,继续培养24 h,然后刺激干预;留取六孔板中各组的培养基,放到4℃离心机,3 500 rpm离心6 min,将上清用移液枪转移至另一个EP管中以备用。检测具体操作步骤按试剂盒说明书进行,得出各组的OD值。以标准品浓度和相应的OD值为参数,直线回归处理,得出相应的方程,算出各组的浓度。
1.8 体内实验
1.8.1动物造模与灌胃
所有小鼠自由饮水,给于普通饲料饲养1周后分别采用不同饲料饲养,ApoE-/-小鼠采用高脂饲料(含脂肪21%、胆固醇0.15%)饲养。C57BL/6J小鼠12只作为正常组,于饲养4周后将48只ApoE-/-小鼠按照随机分组方法分为4组:IRS组(IRS869,腹腔注射)、ODN组(ODN1826,腹腔注射)、血管软化丸中剂量组(浓度为1.728 g/mL)、血管软化丸高剂量组(浓度为3.456 g/mL),每组12只,于12周龄起,对照组给予等体积生理盐水灌胃;中药组分别给予血管软化丸高剂量(3.456 g/mL)和血管软化丸中剂量(1.728 g/mL)灌胃。腹腔注射每周2次,灌胃每日1次,连续给药8周后取材进行检测。
1.8.2样品采集与处理
所有要取材动物禁食12 h,采用眼眶取血法采血,按摩心脏部位,用离心管收集血液,低速离心,分离血清,冷冻保存。采血结束后脱颈椎处死,刨腹,分离主动脉(主动脉弓至腹主动脉),用10%多聚甲醛固定主动脉6 h,主动脉经过乙醇梯度脱水、透明、浸蜡包埋后切片。
1.8.3病理学切片观察
主动脉经过乙醇梯度脱水、透明、浸蜡包埋后切片,厚度设定为4 μm,采用常规苏木素-伊红(HE)染色法进行切片染色,应用光学显微镜进行观察[7]。
1.8.4Western Blot法检测斑块TLR9及其下游分子的蛋白表达
检测主动脉斑块中的TLR9(1:500)、MyD88(1:1 000)、NF-κB(1:1 000)、p-NF-κB(1:500)、IRF7(1:1000)、iNOS(1:200)和CD206(1:50)的蛋白相对表达量。具体步骤同细胞的Western Blot法。
1.8.5iNOS和CD206表达的检测
采用免疫荧光双标化学染色检测各组动脉斑块iNOS和CD206的表达,具体方法按照说明书步骤进行。
1.9 统计学处理
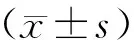
2 结果
饲养和灌胃过程中C57BL/6/J小鼠死亡4只(因相互撕咬导致死亡2只,灌胃操作不当导致死亡2只),ApoE-/-小鼠死亡3只(因相互撕咬导致死亡2只,灌胃操作不当导致死亡3只),剔除离群值,最后进入统计的各组小鼠数量为10只。
2.1 血管软化丸对TLR9及其下游信号分子蛋白表达水平的影响
2.1.1血管软化丸对RAW264.7细胞和主动脉斑块TLR9蛋白表达水平的影响
药物干预后,ODN组细胞的TLR9蛋白表达水平较对照组明显升高,差异具有统计学意义(P<0.05),各中药组和IRS组细胞的TLR9蛋白表达水平较对照组明显降低(P<0.05)。结果见表1、图1。
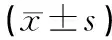
表1 血管软化丸对RAW264.7细胞和主动脉斑块TLR9蛋白表达水平的影响
注:与对照组比较,*P<0.05;与ODN组比较,△P<0.05
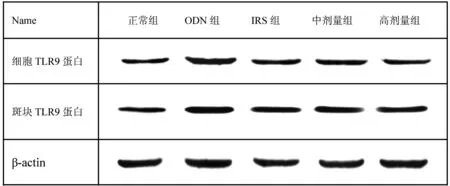
图1 各组小鼠TLR9蛋白表达
2.1.2血管软化丸对主动脉斑块TLR9下游信号分子蛋白表达的影响
与对照组相比,ODN组的MyD88、p-NF-κB、IRF7蛋白表达水平相对增加,差异有统计学意义(P<0.05);各中药组和IRS组细胞的MyD88、p-NF-κB、IRF7蛋白表达水平明显降低,差异有统计学意义(P<0.05)。结果见表2、图2。
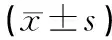
表2 血管软化丸对主动脉斑块TLR9信号通路下游信号分子蛋白表达的影响
注:与对照组比较,*P<0.05;与ODN组比较,ΔP<0.05
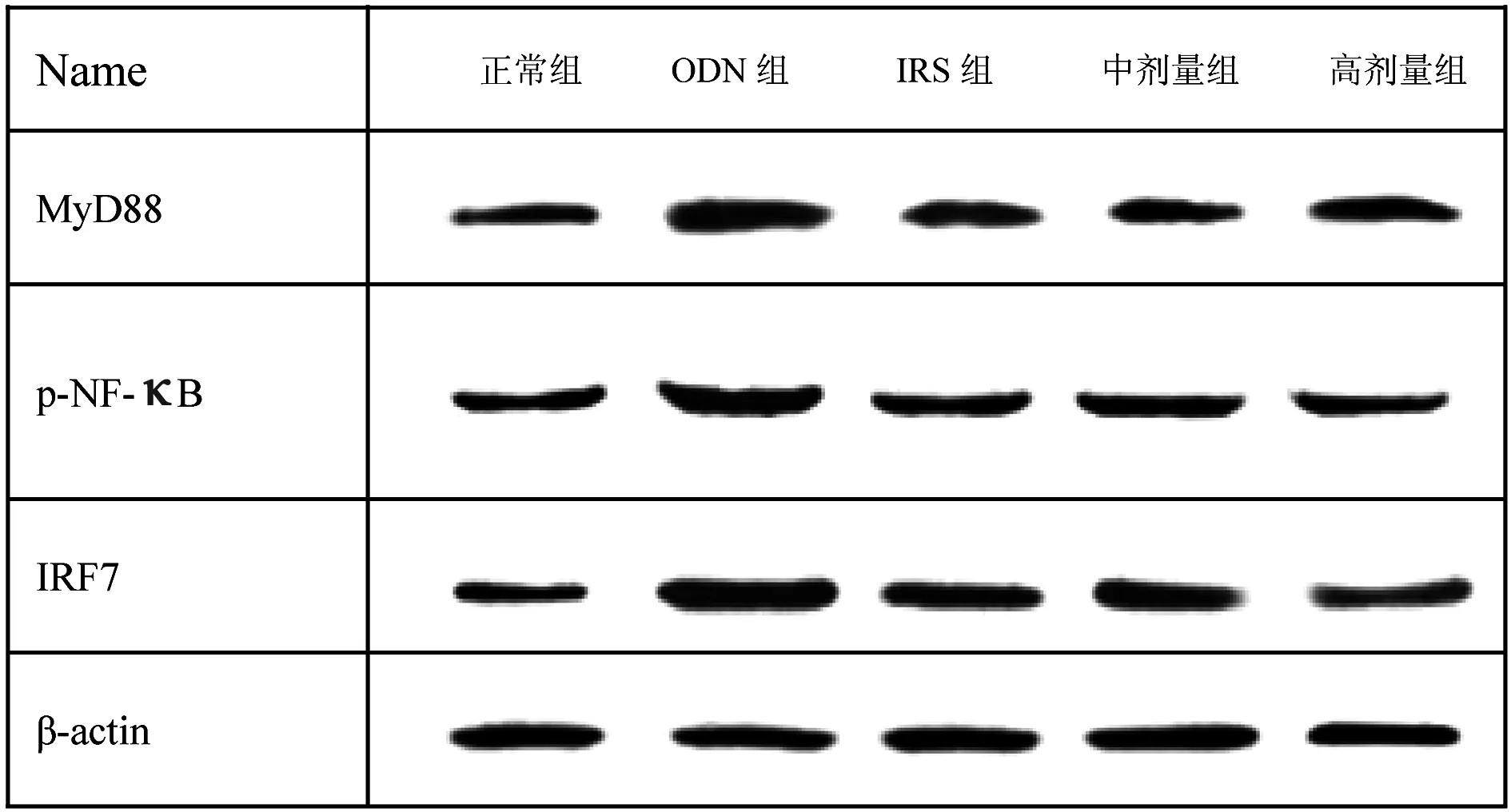
图2 各组小鼠TLR9蛋白表达
2.2 血管软化丸对巨噬细胞极化状态的影响
2.2.1含药血清和TLR9对巨噬细胞(M2/M1)的极化状态的影响
通过血管软化丸含药血清、TLR9的激动剂和TLR9拮抗剂对RAW264.7细胞进行刺激,观察含药血清和TLR9对巨噬细胞(M2/M1)的极化状态的影响。采用免疫荧光双标染色法检测iNOS和CD206蛋白的表达。
结果表明,ODN1826能够诱导巨噬细胞高表达M1型巨噬细胞标志iNOS,而血管软化丸含药血清和IRS869可以诱导巨噬细胞高表达M2型巨噬细胞的标志CD206。差异均具有统计学意义(P<0.05)。结果见图3,表3。
表3 血管软化丸含药血清对巨噬细胞iNOS和CD206免疫荧光阳性比率的影响
注:与对照组比较,*P<0.05;与ODN组比较,ΔP<0.05
2.2.2应用免疫荧光检测各组动脉斑块iNOS和CD206的表达
结果发现,与ODN组相比,各中药组和IRS组斑块中iNOS的荧光密度低表达,而CD206的荧光密度为高表达,差异具有统计学意义(P<0.05)。结果见表4。
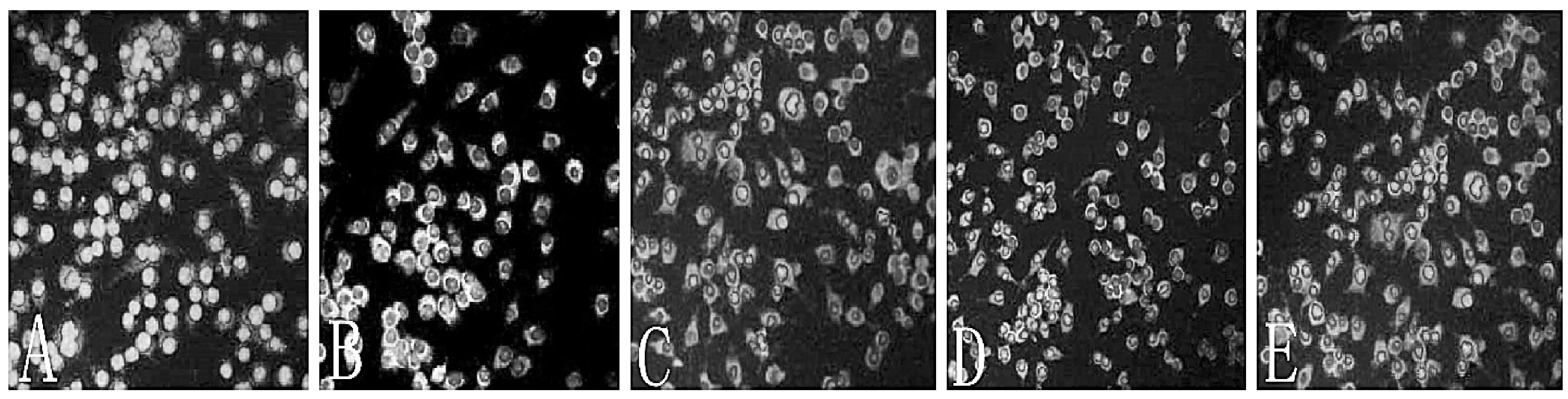
图3 含药血清和TLR9对巨噬细胞(M2/M1)极化状态的影响(光学显微镜,200×)注:A:对照组;B:ODN组;C:IRS组;D:中剂量组;E:高剂量组
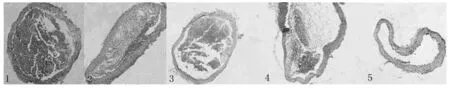
图4 各组小鼠主动脉病理学改变(光学显微镜,200×)注:1:对照组;2:ODN组;3:IRS组;4:中剂量组;5:高剂量组

组别niNOSCD206对照组100.51±0.060.51±0.06ODN组100.75±0.08*0.11±0.02*IRS组100.32±0.04*Δ0.26±0.04*Δ中剂量组100.45±0.04*Δ0.29±0.03*Δ高剂量组100.42±0.07*Δ0.28±0.03*Δ
注:与对照组比较,*P<0.05;与ODN组比较,ΔP<0.05
2.3 血管软化丸对巨噬细胞(M1/M2)相关炎症因子的影响
通过血管软化丸含药血清和TLR9的激动剂与拮抗剂来干预RAW264.7细胞24 h后,RT-PCR法检测。结果显示,与对照组相比,ODN组的TNF-α mRNA表达明显较高,差异有统计学意义(P<0.05);与ODN组比较,各中药组和IRS组TNF-α mRNA表达明显较低,差异有统计学意义(P<0.05)。
用ELISA法检测各组培养基中TNF-α的浓度(pg/ml)。结果显示,与对照组相比,ODN组的TNF-α mRNA表达明显较高,差异有统计学意义(P<0.05);与ODN组比较,各中药组和IRS组TNF-α mRNA表达明显较低,差异有统计学意义(P<0.05)。结果见表5。
2.4 各组小鼠主动脉病理形态观察
在光学显微镜下发现:1)正常组:小鼠主动脉壁厚薄均匀,主动脉内膜光滑平整,内膜各层结构正常,未发现明显的动脉粥样硬化病灶。2)ODN组:小鼠主动脉管腔不平,主动脉内膜明显增厚;可发现明显的动脉粥样斑块。3)IRS组和中药组:主动脉壁各层结构正常,局部可见小灶性的钙化颗粒物沉积,可见较小斑块,病变程度明显较轻。结果见图3。
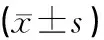
表5 血管软化丸对巨噬细胞相关炎症因子TNF-α的影响
注:与对照组比较,*P<0.05;与ODN组比较,△P<0.05
3 讨论
动脉粥样硬化作为心脑血管疾病最常见和最基本的病理改变,是一个长期综合性的病理过程,动脉粥样硬化病理机制尚未十分明确,一般认为与患者脂代谢异常、高血压、糖尿病和吸烟等因素有关。关于动脉粥样硬化的发病机制,有脂质浸润学说、血栓形成学说、平滑肌细胞克隆学说、炎症反应学说、免疫细胞(巨噬细胞、T细胞和肥大细胞等)浸润、LDL受体缺失学说、损伤应答学说、剪切应力学说等。巨噬细胞是动脉粥样硬化斑块中最典型的炎症细胞,参与了动脉粥样硬化的发生发展。巨噬细胞可活化为2种不同的亚型:M1型和M2型。M1型是经典激活型,具有促炎作用;M2型是替代激活型,具有抗炎作用[8],巨噬细胞的功能由极化状态(M1/M2)决定。研究发现,动脉粥样硬化与心外膜脂肪组织中的巨噬细胞极化状态有密切关系[9],巨噬细胞通过上调其TLRs表达影响巨噬细胞活化表型[10-11]。TLR9是哺乳动物细胞内的一种重要的模式识别受体,主要分布于巨噬细胞、血液中的B细胞和树突状细胞等免疫细胞。IRS作为一类免疫调节DNA序列,能够有效抑制TLR9的激活[12]。ISS可通过激活TLR9进而引起Thl/ Th2类细胞因子的平衡偏离[13],所以TLR9表达水平的改变可能与巨噬细胞的极化状态存在一定的相关性。近年来,中医药在防治动脉粥样硬化的研究中取得了一定的进展,然而对中医药防治动脉粥样硬化的具体作用机制还不十分明确。
中医学认为,大多数慢性病患病日久,往往逐渐出现血瘀之症,即“久病必瘀”,其“瘀”可以为血瘀亦可为痰瘀互结,追其源流,古人早有论述。《素问痹论》指出:“病久入深,营卫行涩,经络失疏故不同。”朱丹溪曰:“久病必瘀”,叶天士曰:“大凡经主气,以络主血,久病血瘀”。当今社会,民食多以甘美,待客多饮酒酿,嗜烟草者众,“饮食自倍,脾胃乃伤”,加之劳心思虑,郁怒在所难免,因此病多虚中挟实,治病不宜纯补,宜“寓补于消,以消代补”,消者去其雍也。结合中医基础理论和临床研究,我们认为痰瘀阻滞是动脉粥样硬化的主要证型,李鲤教授创立“血管软化丸”即有此意。血管软化丸[5]由山楂、建曲、莱菔子、陈皮、清半夏、茯苓、连翘、郁金、枸杞子、三七、珍珠、代赭石组成。方中山楂消食导滞为君药;神曲消食健胃祛除酒食陈腐之积;莱菔子长于下气除胀,消食除积;半夏和茯苓健脾除湿化痰;郁金、三七解郁行气,化瘀散结;枸杞滋补肝肾以固本;珍珠母和代赭石平肝潜阳,降逆祛痰,共为臣药;陈皮理气和中为佐药;甘草调和诸药为使。诸药合用,共奏消积化痰,活血化瘀,平肝潜阳之功。
本实验旨在观察血管软化丸通过对TLR9调控,影响其TLR9下游信号NF-κB和IRF7水平,以及对巨噬细胞(M2/M1)极化平衡状态的影响,从分子、细胞和组织等多层次多靶点揭示中药复方血管软化丸防治AS的分子机制。研究结果显示,在血管软化丸作用下,与对照组RAW264.7细胞相比,中药组TLR9蛋白表达量明显下降,动脉斑块的TLR9、MyD88、p-NF-κB和IRF7蛋白表达量均明显降低。ODN组M1型巨噬细胞比例相对增加,各中药组和IRS组M2型比例相对增加。各中药组和IRS组动脉斑块的CD206/iNOS比值相对增加,斑块M1型巨噬细胞相关炎症因子(IL-1β,iNOS,Ciita)表达相对降低,M2型相关炎症因子(Ym1,Fizz1)表达相对升高。在RAW264.7细胞实验中,中药和IRS可逆转ODN1826引起的TNF-α的升高,使其降低。同时,各中药组斑块形成和面积相对较少,血管软化丸抗动脉粥样硬化的作用得到验证。以上研究表明,血管软化丸和TLR9的拮抗剂IRS869可抑制TLR9的表达,阻止其下游信号NF-κB和IRF7的激活,进而改变巨噬细胞极化状态(M2/M1)的平衡使其向M2型方向倾斜,抑制动脉粥样硬化的发生发展,我们推测这是血管软化丸抗动脉粥样硬化的作用机制之一。
