氯喹通过Akt/PI3K和PKC信号通路促进GLUT4转运
2018-07-11宋冠军
宋冠军,赵 平,周 琦
(中南民族大学生命科学学院,湖北 武汉 430074)
二型糖尿病是一种非胰岛素依赖性的糖尿病。现在90%以上的糖尿病都是二型糖尿病[1]。对于二型糖尿病的治疗,注射胰岛素并不能很好的控制病情,甚至可能使病情加重,因此,寻找能从根本上治疗二型糖尿病的药物就更为重要。
许多味道苦的物质都体现了其较好的抗糖作用[2]。例如苦瓜[3],小檗碱[4],这些苦物质通常都可以用来清热降火。作为苦物质的代表——氯喹,最初是用来治疗疟疾的药物。随着研究的深入,它的许多其他的作用也不断被科学家们发现。早在1991年时,就有科学家指出,氯喹可以增加胰岛素的作用来促进葡萄糖的摄取,但其具体的作用机制目前仍不清楚。
GLUT4是在骨骼肌葡萄糖代谢中一个非常重要的葡萄糖转运体[5],在本研究中,我们主要以GLUT4作为药物研究的一个靶点,研究氯喹对L6细胞内GLUT4转位的影响并尝试进一步研究它的作用机理。
1 材料与方法
1.1 实验对象
稳定表达转染了红色荧光蛋白IRAP-mOrange的L6细胞:IRAP-mOrange-L6。
1.2 抗体及阻断剂
Wortmannin(Sigma),Gö6983(EMD Millipore),Fluo-4 AM(Camarillo,CA,USA)。
1.3 细胞生理溶液
PSS生理盐溶液(含2mM的Ca2+)(mM):135 NaCl,5 KCl,1 MgCl2,2 CaCl2,10 HEPES,10 glucose,用NaOH调PH=7.4。
1.4 实验方法
1.4.1 利用激光共聚焦显微镜监测L6细胞GLUT4转位
之前有研究证明,受胰岛素调节的氨基肽酶IRAP和GLUT4蛋白存在高度共定位关系,同时,许多实验已证明IRAP能够作为一种报告分子反映GLUT4的转运状况。借助这一机理,通过L6细胞质膜上IRAP-mOrange荧光强度的动态变化,我们能够间接地检测GLUT4蛋白转位的变化,首先,我们将IRAP-mOrange-L6细胞接种在无菌盖玻片上,放回于培养箱中过夜培养使其贴壁。然后用不含血清的α-MEM培养液饥饿细胞2 h,再用配好的PSS溶液清洗。之后,将细胞放在激光扫描共聚焦显微镜下,加入1 mM氯喹,在555 nm激发波长下观测IRAP-mOrang荧光的变化。加药后,每5分钟拍一张照片共拍5个循环,一直拍照记录到加药后的30 min。记录数据并利用Origin软件进行分析。
1.4.2 利用激光共聚焦显微镜监测L6细胞内的Ca2+水平
饥饿细胞之前的步骤同检测IRAP相同。用PSS溶液洗掉没有血清的α-MEM培养液后。利用2 mM的Fluo-4 AM在室温下避光孵育L6细胞20 min,将细胞内钙离子标记上绿色荧光,接下来用温浴后的PSS溶液将Fluo-4 AM洗去,在激光共聚焦显微镜下,在488 nm激发波长下观察L6细胞中绿色荧光强度的变化。记录数据并分析,绘制折线图反映细胞中Fluo-4的荧光强度变化。
2 结 果
2.1 氯喹促进GLUT4的转运上膜
我们通过检测L6细胞中IRAP红色荧光蛋白(IRAP-mOrange)来反映GLUT4在细胞膜上的定位。随着氯喹的加入,可以观察到L6细胞膜上的红色荧光越来越明显(图2.1A)。数据分析发现加入1mM的氯喹后L6细胞膜上的荧光强度与加药前相比显著升高(图2.1B)。
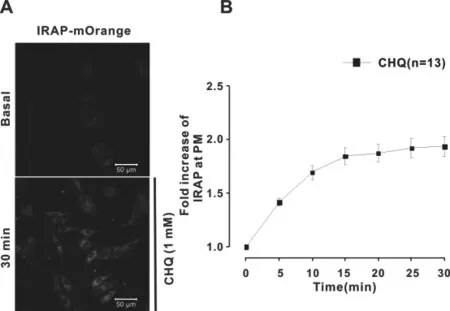
图2 .1 氯喹促进GLUT4的转运
(A)通过confocal观察在L6细胞中稳定表达的IRAP红色荧光蛋白,随着氯喹的加入,IRAP在细胞膜上的荧光强度明显的增强。图中比例尺=50 μm。(B)对L6细胞膜上的IRAP-mOrange荧光强度进行统计,发现在加入1mM的氯喹后的30 min内,L6细胞膜上的IRAP-mOrange荧光强度保持显著的增强。
2.2 氯喹可以通过Akt/PI3K信号通路来增强GLUT4的转运
我们利用Akt/PI3K阻断剂wortmannin(100 nM)作用细胞30 min,我们发现wortmannin对氯喹引起的Ca2+的增加起到了一定的抑制作用(图2.2下),但具体的作用机制还有待我们进一步实验和探讨。另外,wortmannin抑制了L6细胞中氯喹刺激的IRAP荧光强度的增加(图2.2上)。这证明氯喹确实可以通过Akt通路来刺激GLUT4的转运,进而促进葡萄糖的吸收。

图2 .2 PI3K的抑制剂可以阻断氯喹刺激的GLUT4的转运
wortmannin抑制了GLUT4到细胞膜的转运(上)。同时,wortmannin也明显的降低了氯喹刺激的Ca2+的升高(下)。***:P<0.001。该实验证明Akt/PI3K确实参与了氯喹刺激的GLUT4的转运。
2.3 氯喹可以通过PKC信号通路来增强GLUT4的转运
接下来,我们用PKC的抑制剂Gö6983(10 µM)作用L6细胞30 min后,加入1mM氯喹之后用激光共聚焦显微镜监测L6细胞中IRAP-mOrange的荧光强度。结果表明Gö6983显著抑制了氯喹引起的GLUT4的转位(图2.3上);同时,Gö6983对氯喹引起的Ca2+的增加没有影响(图2.3下)。这个实验证明PKC参与了氯喹诱导的GLUT4的转运。

图2 .3 PKC抑制剂作用会抑制氯喹刺激的GLUT4的转运
与正常细胞相比,Gö6983明显的抑制了GLUT4到细胞膜的转运(上);然而却没有减少氯喹刺激的L6细胞内Ca2+的增加(下)。***:P<0.001。
3 讨 论
有报道称氯喹可以增强胰岛素抵抗病人中葡萄糖的摄取[6]。然而,对于氯喹抗糖机制以及其相对应的机制仍不清楚。本课题就针对氯喹在治疗二型糖尿病方面的潜在作用机制进行了研究。
实验中,我们发现氯喹可以促进GLUT4的转运上膜,为了进一步研究其作用机制。我们分别用wortmannin和Gö6983处理L6细胞,发现wortmannin能抑制氯喹引起的GLUT4转运的增加和胞内Ca2+的增加,而Gö6983显著抑制了氯喹引起的GLUT4的转位,但对氯喹引起的Ca2+的增加没影响。证明氯喹是通过Akt/PI3K和PKC信号通路增强L6细胞内GLUT4转运。同时,氯喹能通过Akt/PI3K信号通路促进胞内Ca2+的增加,结合之前报道,氯喹诱导的胞内Ca2+的增加能促进L6细胞内GLUT4与细胞质膜的融合[7]。这些结果说明氯喹可能开发为一种新的潜在的降血糖药物。当然,我们的研究也存在着不足。我们目前缺乏氯喹在动物实验上的数据。未来我们将通过获得不同类型的二型糖尿病小鼠,直接观测药物对其血糖以及生命活动的影响,从而进一步确认氯喹的可靠性与安全性。
