卡介苗对老年性痴呆模型小鼠学习记忆和脑内Aβ的影响
2018-07-09张雨微黄锐张业贵王薇赵健
张雨微,黄锐,张业贵,王薇,赵健
(皖南医学院人体解剖学教研室,芜湖 241002)
阿尔茨海默病(Alzheimer disease,AD)是一种中枢神经系统退行性疾病,主要表现为渐进性记忆障碍、认知功能障碍、语言障碍等神经精神症状。AD典型的病理特征包括脑内神经细胞外β-淀粉样蛋白(Aβ)的沉积、神经细胞内tau蛋白过度磷酸化导致的神经纤维缠结等[1],其中Aβ沉积被认为是导致AD病理的首要因素,所有其他的病理特征都由于Aβ的生成和清除的不平衡所导致[2]。
卡介苗(Bacillus Calmette-Guérin, BCG)是一种减毒活菌疫苗,能有效预防结核性脑膜炎和血行播散性结核[3]。BCG也被广泛用于非结核病的研究和治疗。有文献报道BCG可用做部分肿瘤的辅助治疗,调节机体免疫系统[4]。同时,在中枢神经系统退行性病变和自身免疫性病变中,如帕金森病和多发性硬化(MS),BCG 免疫也发挥有益的免疫调节作用[5]。另有文献报道新生期接种卡介苗可以影响小鼠的行为,并伴随突触可塑性的加强及神经发生的增强[6],提示BCG作为一种非特异性免疫调节剂,能够激活机体全身免疫系统。
本研究拟对C57BL/6小鼠采用D-半乳糖和亚硝酸钠腹腔注射的方式来建立AD模型,并将其与卡介苗相结合,通过皮内注射卡介苗,分别探究其对AD小鼠体重、行为学及脑内Aβ的影响,为卡介苗在AD治疗中的应用提供基础。
材料与方法
1 实验动物
12周龄的C57BL/6小鼠24只,雌雄各半,体重(18±2)g,由上海杰思捷实验动物有限公司提供,动物许可证号:SCXK(沪)2013-0006。动物饲养在皖南医学院实验动物中心,常温、常湿饲养,动物自由摄取食物和饮水。
2 实验试剂及仪器
D-半乳糖(MACKLIN 麦克林);亚硝酸钠(广东光华化学厂有限公司);Aβ酶联免疫试剂盒(苏州卡尔文);小鼠抗Aβ42单克隆抗体(Invitrogen);羊抗小鼠Alexa Fluor 555(Invitrogen);Morris水迷宫及视频分析系统(北京众实迪创科技发展有限公司);DNM-9602酶标分析仪;冰冻切片机(Thermo HM 525NX);激光共聚焦扫描显微镜。
3 动物分组及给药
动物随机分为生理盐水对照组(NS)、AD模型组(AD)、卡介苗组(BCG),每组8只。采用文献报道的造模方法,AD组和BCG组小鼠采用腹腔注射D-半乳糖(120mg/kg)和亚硝酸钠(90mg/kg),NS组腹腔注射等体积生理盐水(NS),每日1 次,连续8w。从造模开始,BCG组分别在0w、4w和8w按105CFU剂量通过皮内注射给药,NS组和AD组给予等体积生理盐水。同时每4w记录小鼠体重变化情况。
4 Morris水迷宫实验(Morris-water Maze)
Morris水迷宫测试训练小鼠在一个(22±2)℃恒温、无毒白色、直径为80cm的水池内寻找到水下的隐藏平台。实验持续5d,包括定位航行(place navigation)和空间探索(spatial probe)两个部分[7]。①定位航行阶段:第1~4d测试时将隐藏平台放在第一象限,小鼠分别从4个象限面朝池壁放入水池。当小鼠找到平台并在平台上保持1s后,系统自动停止记录为逃避潜伏期。如果超过60s未找到平台,则按照60s计算,同时将小鼠手动放置在平台上学习30s。②空间探索阶段:第5d撤除隐藏平台,小鼠从之前放置平台的对侧象限面朝池壁放入水中,在没有平台的水迷宫设备中寻找记忆中的平台,游泳时间为60s。统计小鼠穿过平台原先位点的次数、目标象限的游泳时间和路程占总时间和总路程的百分比。
5 小鼠脑内Aβ蛋白的ELISA检测
行为学实验结束后第2d,小鼠深度麻醉后通过心脏直接用冷生理盐水灌注,取半脑提取蛋白组织检测Aβ水平[8]。采用ELISA试剂盒对Aβ蛋白进行检测,主要步骤为:加入被检样品200μL/孔,37℃水浴2h,PBST洗涤3次,拍干后加入羊抗小鼠IgG HRP,37℃水浴1h,再用PBST洗涤拍干,加入TMB显色液,避光10~15min,加入终止液,30min内用酶联免疫检测仪记录在490nm波长读数观察结果,并根据标准曲线计算出对应的浓度。
6 免疫荧光染色
通过冷生理盐水灌注后的小鼠取半脑浸泡在4%的多聚甲醛中充分固定,依次浸泡于10%、20%、30%梯度浓度的蔗糖溶液中平衡后放置于冰冻切片机,自冠状面切成40μm厚的漂片[9]。将选好的脑片用0.01mol/L PBS漂洗3次,用含0.25% Triton X-100的1% BSA于37℃水浴封闭30min,用小鼠抗Aβ42单克隆抗体(1∶400)孵育2h后4℃过夜,PBS漂洗3次后用羊抗小鼠Alexa Fluor 555(1∶400)孵育2h,再漂洗3次,将脑片裱于防脱载玻片上,用甘油/PBS(1∶1)封片剂封片,激光共聚焦扫描显微镜观察、拍照[10]。
7 统计学分析
实验数据进行双盲统计分析,采用SPSS19.0统计软件进行分析处理。数据通过单因素方差分析进行统计,所有结果都表示为±s,P< 0.05表示差异有统计学意义。
结 果
1 卡介苗处理改善阿尔茨海默病模型小鼠体重
每4周记录各组小鼠体重变化情况,结果显示,与NS组小鼠相比,AD组在给药4w后增重较少,而经过BCG处理的小鼠,体重增重显著高于AD组(表1)。
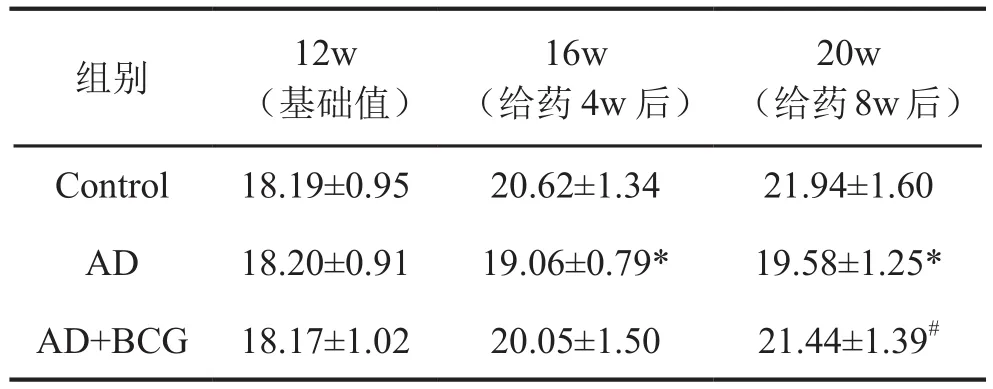
表1 三组小鼠体重(g)比较Tab.1 Comparison of mouse body weight (g) among three experimental groups
2 BCG处理改善阿尔茨海默病模型小鼠学习记忆功能
在定位航行实验中,各组小鼠随着训练天数增加,逃避潜伏期逐渐缩短。在第3、4d,AD组小鼠的逃避潜伏期较NS组显著延长,而BCG组小鼠逃避潜伏期较AD组显著缩短(图1A)。在第5d的空间探索实验中,AD组小鼠在目标象限游泳的时间和路程的百分比显著低于对照组,而BCG的处理改善了这种情况(图1B),显著优于AD组;同时,小鼠第5d穿虚拟平台次数也呈现出一致的结果(图1C)。这些结果提示通过BCG的处理,能改善的AD小鼠的认知功能,缓解疾病进程。

图1 三组小鼠学习记忆能力的水迷宫检测比较。A,定位航行阶段逃避潜伏期;B,空间探索阶段目标象限时间和路程的百分比;C,空间探索阶段小鼠穿虚拟平台的次数;*与NS对照组比较,0.01<P<0.05;#,与AD组比较,0.01<P<0.05Fig.1 Comparison of Morris water maze test results among three experimental groups.A, escape latency of location and navigation; B, percentage of time and total path length spent in target quadrant; C, number of crossing virtual platform.*, 0.01<P<0.05, compared with control group; #,0.01<P<0.05, compared with AD group
3 BCG处理降低阿尔茨海默病模型小鼠脑内Aβ水平和斑块沉积
通过ELISA和免疫荧光染色分别检测小鼠脑内Aβ蛋白和斑块含量显示,在NS对照组小鼠脑内未检测到Aβ蛋白,AD模型小鼠脑内可检测到高水平Aβ蛋白和斑块的沉积,而经BCG处理后的AD模型小鼠脑内Aβ含量显著下降(表2),海马和皮质区域Aβ斑块的沉积也减少(图2)。

表2 三组小鼠脑内Aβ蛋白含量比较Tab.2 Comparison of brain Aβ content among three experimental groups
讨 论
阿尔兹海默症是一组病因未明的退行性脑变性疾病,其脑内最主要的两大病理特征是细胞外多种形式的Aβ蛋白斑块沉积和细胞内神经原纤维缠结(NTFs),以及过度磷酸化的tau蛋白,其中Aβ为AD的早期关键性的发病原理[2]。
D-半乳糖是一种二醛糖,在醛糖还原酶的作用下生成半乳糖醇和H2O2。过量的氧自由基在动物体内可与细胞中的脂质、蛋白和核酸产生非酶糖基化、氧化应激-自由基损伤作用等一系列病理改变。研究表明[11],小鼠持续腹腔注射D-半乳糖和亚硝酸钠后,可出现明显认知障碍。因此,本研究采用D-半乳糖和亚硝酸钠处理C57BL/6小鼠,以制备老年性痴呆模型小鼠。
卡介苗(BCG)是一种减毒活菌疫苗。有文献报道,BCG除被广泛用于预防结核病外,还可以用于非结核病的研究和治疗当中,如部分恶性肿瘤和CNS退行性病变等[4]。另一方面,有研究表明新生期接种卡介苗可以提高小鼠的认知功能,并伴随突触可塑性的加强及神经发生的增加[6]。这促使我们进一步探究,给老年性痴呆模型的小鼠接种BCG对AD病理的改变及行为的影响。
在本研究中,C57BL/6小鼠经D-半乳糖和亚硝酸钠连续处理8w后,与对照组小鼠相比,表现出明显的体重增加缓慢、认知功能下降,同时脑内可检测到Aβ斑块的沉积。经过BCG多次处理后,这些病理变化得到了显著的改善。表现为BCG处理组的小鼠体重增幅接近对照组小鼠,而其在水迷宫实验中的定位航行阶段比AD组小鼠表现出较短的逃避潜伏期,空间探索阶段在目标象限的游泳时间和距离的百分比均显著高于AD组,穿平台次数也显著上升,反映出其学习记忆功能得到改善,同时,BCG处理后的AD小鼠脑内的Aβ蛋白和斑块含量显著下降。
研究发现,AD患者在70岁以后体重下降的速度要远高于其它同龄人,而这项发现与之前的一系列研究提供了丰富的证据[12],证明体重检测管理在AD患者的治疗过程中具有非常重要的意义。在分析了大量痴呆患者的BMI指数后,研究人员发现,携带痴呆相关基因APOEε4变异基因的人群70岁以后BMI的下降速度会明显提高,即在中老年阶段,体重过轻者的痴呆发生风险增高,而体重是一项十分容易检测的身体指标[13]。在本研究中,我们持续监控各组小鼠体重的变化情况,发现连续注射D-半乳糖和亚硝酸钠的AD模型组小鼠体重增幅较生理盐水处理组小鼠缓慢,而经过卡介苗处理后,其体重增幅显著升高。这反映了AD组小鼠痴呆风险较高,经卡介苗处理可降低这种风险程度。

图2 免疫荧光检测BCG处理的AD模型小鼠脑内海马和皮质的Aβ斑块。比例尺,100µmFig.2 Immunofluorescent detection of Aβ plaques in hippocampus and cortex of AD mice with or without BCG treatment.Scale bar, 100µm
Morris水迷宫(MWM)用于检测啮齿类动物开放视觉末梢的海马依赖性空间学习和记忆能力,研究与空间学习记忆相关的脑区功能评价,在AD研究中的应用非常普遍[14]。测试程序主要包括定位航行试验和空间探索试验两个部分。其中定位航行试验反映了小鼠的学习能力,空间探索试验反映了小鼠的记忆能力。结果显示,AD组在定位航行阶段的逃避潜伏期长于对照组,而BCG处理组显著缩短了这一差距,表明BCG可以改善AD小鼠的学习能力。同时,在空间探索阶段,BCG处理的AD小鼠在目标象限游泳的时间和路程的百分比也显著上升,改善了AD小鼠的记忆能力。这说明BCG可以提高老年痴呆型小鼠的认知功能。
Aβ是大脑皮质老年斑的主要成分,可溶性二聚体可以有效削弱突触结构和功能,是最小的突触毒性物质,也是引起AD的重要物质[15]。Aβ42聚集形成难溶的低聚物,在神经元间隙沉积,构成老年斑。Aβ纤维,可促使细胞外自由基生成,破坏细胞膜功能,损伤细胞器、细胞膜和细胞骨架,引起细胞凋亡,进而引起AD患者的认知障碍等[16]。“Aβ级联假说”认为,Aβ在AD发病过程中发挥核心作用,是各种原因诱发AD的共同通路,引起一系列神经毒性反应,导致神经细胞功能紊乱和死亡,从而引发痴呆[17]。因此,对AD小鼠脑内毒性蛋白Aβ的清除成为改善老年性痴呆进程的重要途径。在本研究中,我们检测了小鼠海马和皮质区的Aβ蛋白,同时用免疫荧光对脑内Aβ斑块进行染色,结果显示,经过BCG处理后的AD小鼠脑内Aβ蛋白和斑块的含量均显著下降,因而抑制了其神经毒性,其可能是通过抑制Aβ的生成或增强Aβ的清除的途径,减缓AD小鼠的病理改变进程。
综合以上结果,我们认为BCG非特异性地刺激了AD小鼠机体的免疫系统,进而与中枢神经系统发生作用,诱导了AD小鼠脑内Aβ的清除,缓解了其脑内的神经毒性和AD的发病进程,致使神经系统功能得到恢复,认知功能得到改善,并使AD小鼠的体征指标趋于正常对照组。这促使我们在下一步的研究工作中进一步探究其可能发挥的机制,包括神经细胞等结构的变化情况及在信号通路上蛋白的改变[18],为AD更加安全、有效的免疫治疗提供实验依据和理论基础。
[1]2016 Alzheimer’s disease facts and figures.Alzheimers Dement, 2016, 12 (4)∶ 459-509.
[2]Selkoe DJ.Alzheimer’s disease∶ genes, proteins, and therapy.Physiol Rev, 2001, 81 (2)∶ 741-766.
[3]Dye C.Making wider use of the world’s most widely used vaccine∶ Bacille Calmette-Guerin revaccination reconsidered.J R Soc Interface, 2013, 10 (87)∶ 20130365.
[4]Brandau S, Suttmann H.Thirty years of BCG immunotherapy for non-muscle invasive bladder cancer∶ a success story with room for improvement.Biomed Pharmacother, 2007,61 (6)∶ 299-305.
[5]Ristori G, Romano S, Cannoni S, et al.Effects of Bacille Calmette-Guerin after the first demyelinating event in the CNS.Neurology, 2014, 82 (1)∶ 41-48.
[6]Yang J, Qi F, Gu H, et al.Neonatal BCG vaccination of mice improves neurogenesis and behavior in early life.Brain Res Bull, 2016, 120∶ 25-33.
[7]Vorhees CV, Williams MT.Morris water maze∶ procedures for assessing spatial and related forms of learning and memory.Nat Protocol 2006, 1(2)∶ 848-858.
[8]Esiri MM, Biddolph SC, Morris CS.Prevalence of Alzheimer plaques in AIDS.J Neurol Neurosurg Psychiatry, 1998,65 (1)∶ 29-33.
[9]Zhang Y, Zou J, Yang J, et al.4Abeta1-15-Derived Monoclonal Antibody Reduces More Abeta Burdens and Neuroinflammation than Homologous Vaccine in APP/PS1 Mice.Curr Alzheimer Res, 2015, 12 (4)∶ 384-397.
[10]Qi F, Yang J, Xia Y, et al.A(H1N1) vaccination recruits T lymphocytes to the choroid plexus for the promotion of hippocampal neurogenesis and working memory in pregnant mice.Brain Behav Immun, 2016, 53∶ 72-83.
[11]Cui X, Zuo P, Zhang O, et al.Chronic systemic D-galactose exposure induces memory loss, neurodegeneration, and oxidative damage in mice∶ protective effects of R-alpha-lipoic acid.J Neurosci Res, 2006, 84(3)∶ 647-654.
[12]Segers K, Surquin M.Can mirtazapine counteract the weight loss associated with Alzheimer disease? A retrospective open-label study.Alzheimer Dis Assoc Disord.2014, 28 (3)∶291-293.
[13]Besser LM, Gill DP, Monsell SE, Brenowitz W, Meranus DH, Kukull W, Gustafson DR.Body mass index, weight change, and clinical progression in mild cognitive impairment and Alzheimer disease.Alzheimer Dis Assoc Disord.2014, 28 (1)∶ 36-43.
[14]Pan X, Gong N, Zhao J, et al.Powerful beneficial effects of benfotiamine on cognitive impairment and beta-amyloid deposition in amyloid precursor protein/presenilin-1 transgenic mice.Brain 2010, 133(Pt5)∶ 1342-1351.
[15]Hardy J, Selkoe DJ.The amyloid hypothesis of Alzheimer’s disease∶ progress and problems on the road to therapeutics.Science 2002, 297(5580)∶ 353-356.
[16]Selkoe DJ.Alzheimer’s disease∶ genes, proteins, and therapy.Physiol Rev 2001, 81(2)∶ 741-766.
[17]Garcia-Alloza M, Robbins EM, Zhang-Nunes SX, et al.Characterization of amyloid deposition in the APPswe/PS1dE9 mouse model of Alzheimer disease.Neurobiol Dis,2006, 24 (3)∶ 516-524.
[18]Medeiros R, Prediger RD, Passos GF, et al.Connecting TNF-alpha signaling pathways to iNOS expression in a mouse model of Alzheimer’s disease∶ relevance for the behavioral and synaptic deficits induced by amyloid beta protein.J Neurosci, 2007, 27 (20)∶ 5394-5404.
