钯催化一锅法合成2-碘联芳烃的研究
2018-07-07马姣丽程辉成
马姣丽,金 烈,程辉成
(广东石油化工学院 化学工程学院,广东 茂名 525000)
Suzuki-Miyaura 偶联反应是合成联芳烃化合物的重要方法之一,在天然产物合成、药物中间体化学及液晶材料等领域中发挥着重要作用[1-4]。钯催化苯硼酸与卤代芳烃的Suzuki偶联反应是合成联芳烃化合物的重要方法,一直是有机合成化学研究的热点之一[5]。 卤代芳烃是一种十分常见的偶联组分,通过过渡金属催化反应可以实现常见的C-C、C-N及C-O等化学键的转化[6-10]。
2-碘代联芳烃化合物是一种重要的有机合成中间体,可以发生反应转化为环状二芳基碘盐、咔唑及联亚苯芳烃等一系列有用的化合物,这些物质在化工、医药及材料等领域有广泛的用途[11-13]。我们成功开发了钯催化芳基硼酸与2-碘苯胺发生Suzuki偶联反应,生成的2-氨基联苯不用分离直接发生重氮化反应转化为2-碘联芳烃化合物。该方法无需磷配体的参与,催化剂的用量低至0.2%,合成产率进一步提高,操作更加简单易行。
1 实验部分
1.1 仪器和试剂
熔点采用RD-II型显微熔点仪测定;核磁共振谱用Agilent400-MR型核磁共振仪(美国Agilent公司)测定,氘代氯仿作溶剂,TMS作内标;质谱用Agilent1100型气质联用仪(美国Agilent 公司) (GC/MSD VL ESI)测定;紫外-可见吸收光谱用WFH-204B型手提式紫外分析仪测定;TLC用板为GF254(青岛海洋化工有限公司)高效薄层层析硅胶板。催化剂醋酸钯购买于J & K Scientific Ltd,实验所用其他试剂均购买于普通试剂公司。
1.2 合成步骤
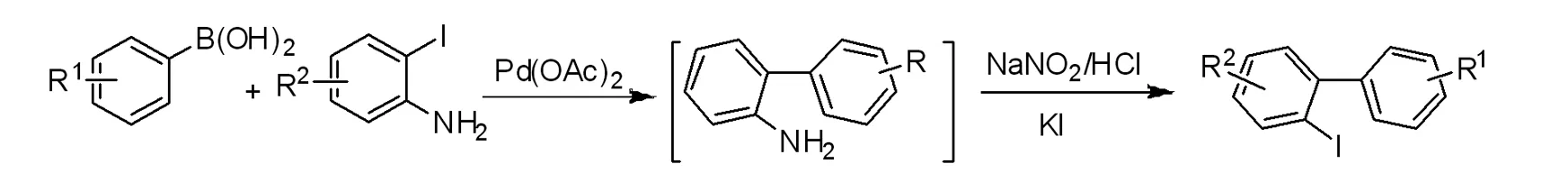
图1 2-碘联芳烃的合成路线
Fig.1 Synthesis route of 2-iodine biaryl compounds
在250 mL三口瓶中加入2-碘苯胺搅拌溶液(10 mmol)、芳基硼酸(13 mmol)、碳酸钾(25 mmol)和Pd(OAc)2(0.05 mmol, 0.5 mol %),置换为氮气,然后加入丙酮和水的混合溶剂50 mL(V∶V=1∶1)。在氩气氛围下回流反应,用TLC监测反应进程。反应完毕后,旋出溶剂进行回收。在上述粗产物2-氨基联芳烃的三口瓶中,加入100 mL H2O的混合溶剂、5 mL浓盐酸冷却至0℃,缓慢滴加NaNO2(15 mmol)的水溶液20mL,冰水浴继续搅拌反应,30min后缓慢滴加KI(15 mmol)的水溶剂10 mL,30min后滴加完毕,继续反应60min,恢复室温反应过夜。乙酸乙酯萃取(3×60 mL),无水MgSO4干燥,蒸出溶剂,进行柱层析纯化得目标产物2-碘联芳烃,具体反应过程见图1。
2 结果与讨论

表1 2-碘联芳烃的合成
邻氨基碘苯可以与苯硼酸发生偶联,通过重氮化反应得到2-碘联芳烃化合物,产率为94% (Entry 1a);当苯硼酸的4位连有甲基、甲氧基时,能得到较高的产率,分别为94%和81%(Entry 1b-1c)。但当苯硼酸的4位连有吸电子基团时,产率稍微下降,如氯、三氟甲基、乙酰基底物产率只有80%和62%(Entry 1d-1f)。但选用2-甲基苯硼酸作为底物时,产率只有71%(Entry 1g),这可能与甲基的位阻效应有关。当3-甲基苯硼酸进行反应时,产率为89%(Entry 1h);此外,3-甲基苯硼酸及二取代的苯硼酸底物均可以顺利反应(Entry 1h-1i);此外,我们也尝试了4-甲基苯硼酸与取代的邻氨基碘苯进行反应,也能得到不错的产率(Entry 1j-1k)。从上述实验结果可以看出,邻氨基碘苯与一系列取代的苯硼酸可以发生偶联,通过重氮化反应一锅法制备2-碘联芳烃化合物。
3 产品的表征
3.1 2-碘联苯(1a)
无色油状物,产率94%。1H NMR (400 MHz,CDCl3) δ 7.99 (dd, J = 7.9,1.0 Hz,1H),7.49~7.39 (m,4H),7.39~7.31 (m,3H),7.06 (ddd,J = 7.9,7.4,1.8 Hz,1H);13C NMR (101 MHz, CDCl3) δ 146.58,144.15,139.44,130.04,129.23,128.74,128.07,127.91,127.60,98.60;GC-MS:280。
3.2 2-碘-4'-甲基-1,1'-联苯(1b)
白色固体,产率90%。1H NMR (400 MHz, CDCl3) δ 7.97 (d, J= 7.9 Hz,1H),7.39 (dd,J= 7.5,0.9Hz,1H),7.31 (dd,J= 7.6,1.6 Hz,1H),7.26 (s,4H),7.03 (td,J= 7.8,1.7 Hz,1H),2.44 (s,3H);13C NMR (101 MHz,CDCl3) δ 146.59,141.35,139.45,137.37,130.13,129.11,128.63,128.58,128.08,98.80,21.28;GC-MS:294。
3.3 2-碘-4'-甲氧基-1,1'-联苯(1c)
白色固体,产率81%。熔点:48℃。1H NMR (400 MHz,CDCl3) δ 7.95 (dd,J = 7.9,1.0 Hz,1H),7.38 (td,J = 7.5,1.1 Hz,1H),7.33~7.25 (m,3H),7.01 (td,J = 7.8,1.8 Hz,1H),6.98~6.94 (m,2H),3.87 (s,3H);13C NMR (101 MHz,CDCl3) δ 159.06,146.24,139.46,136.73,130.41,130.18,128.49,128.09,113.27,99.17,55.26. GC-MS:310。
3.4 2-碘-4'-氯-1,1'-联苯(1d)
无色油状物,产率84%。1H NMR (400 MHz,CDCl3) δ 7.96 (dd,J= 7.9,0.9 Hz,1H),7.50~7.37 (m,3H),7.37~7.25 (m,3H),7.05 (td,J= 7.8,1.7 Hz,1H);13C NMR (101MHz,CDCl3) δ 145.34,142.47,139.61,133.72,130.67,130.00,129.11,128.22,98.48,98.36;GC-MS:314。
3.5 2-碘-4'-三氟甲基-1,1'-联苯(1e)
无色油状物,产率80%。1H NMR (400 MHz,CDCl3) δ 7.98 (dd,J = 7.9,0.7 Hz,1H),7.70 (d,J = 8.1 Hz,2H),7.47 (d,J = 8.0 Hz,2H),7.42 (td,J = 7.5,0.9 Hz,1H),7.29 (dd,J = 7.6,1.6 Hz,1H),7.08 (td,J = 7.7,1.6 Hz,1H);13C NMR (101 MHz,CDCl3) δ 147.48 (q,JC-F = 1.0 Hz),145.18,139.67,129.90,129.76 (q,JC-F = 32.5 Hz),129.70,129.39,128.27,124.97 (q,JC-F= 3.7 Hz),124.16 (q,JC-F = 272.1 Hz),97.80;GC-MS:294。
3.6 2-碘-4'-乙酰基-1,1'-联苯(1f)
浅黄色油状物,产率62%,熔点:103 ℃。1H NMR (400 MHz,CDCl3) δ 8.03 (d,J = 8.4 Hz,2H),7.97 (dd,J = 8.0,0.9 Hz,1H),7.49~7.37 (m,3H),7.29 (dd,J = 7.6,1.6 Hz,1H),7.07 (td,J = 7.8,1.7 Hz,1H),2.66 (s,3H);13C NMR (101 MHz,CDCl3) δ 197.70,148.71,145.49,139.66,136.19,129.83,129.61,129.33,128.24,128.08,97.72,26.69;GC-MS:322。
3.7 2-碘-2'-甲基-1,1'-联苯(1g)
白色固体,产率71%,熔点: 39 ℃。1H NMR (400 MHz,CDCl3) δ 7.94 (dd,J= 8.0,1.0 Hz,1H),7.40 (td,J= 7.5,1.2 Hz,1H),7.32 (td,J= 7.4,1.4Hz,1H),7.30~7.25(m,2H),7.22 (dd,J= 7.6,1.7 Hz,1H),7.10~7.02(m,2H),2.08 (s,3H);13C NMR (75 MHz,CDCl3) δ 20.1,100.1,125.6,128.0,128.1,128.7,129.2,129.7,129.9,135.7,138.9,144.4,146.8;GC-MS:294。
3.8 2-碘-3'-甲基-1,1'-联苯(1h)
浅黄色油状物,产率89%。1H NMR (400 MHz,CDCl3) δ 7.99 (d,J = 7.9 Hz,1H),7.41 (t,J = 7.4 Hz,1H),7.36 (dd,J =11.6,6.9 Hz,2H),7.25 (d,J = 7.4 Hz,1H),7.20 (s,2H),7.06 (td,J = 7.8,1.1 Hz,1H),2.46 (s,3H);13C NMR (101 MHz,CDCl3) δ 146.71,144.10,139.41,137.52,130.01,129.91,128.64,128.30,128.02,127.77,126.32,98.62,21.46;GC-MS:294。
3.9 2-碘-3',4'-二甲基-1,1'-联苯(1i)
浅黄色油状物,产率 72%。1H NMR (400 MHz,CDCl3) δ 7.98 (d,J = 7.9 Hz,1H),7.40 (t,J = 7.4 Hz,1H),7.33 (d,J = 7.6 Hz,1H),7.23 (d,J = 7.6 Hz,1H),7.16~7.13 (m,2H),7.04 (t,J = 7.6 Hz,1H),2.36 (d,J = 2.1 Hz,6H);13C NMR (101 MHz,CDCl3) δ 146.56,141.68,139.34,136.00,135.86,130.33,130.05,129.10,128.43,127.97,126.58,98.77,19.78,19.56;GC-MS:308。
3.10 2-碘-4-氯4'-甲基-1,1'-联苯(1j)
白色固体,产率73%,熔点: 59 ℃。1H NMR (400 MHz,CDCl3) δ 7.96 (d,J = 1.6 Hz,1H),7.41~7.32 (m,1H),7.30~7.17 (m,5H),2.44 (s,3H);13C NMR (101 MHz,CDCl3) δ 145.12,140.19,138.64,137.73,133.34,130.50,129.00,128.74,128.25,98.67,21.28;GC-MS:328。
3.11 2-碘-4',5-二甲基-1,1'-联苯(1k)
白色固体,产率 83%,熔点73 ℃。1H NMR (400 MHz,CDCl3)δ 7.89 (d,J= 8.1 Hz,1H),7.38~7.27 (m,4H),7.21 (d,J= 1.8 Hz,1H),6.92 (dd,J= 8.1,1.7 Hz,1H),2.50 (s,3H),2.40 (s,3H);13C NMR (101 MHz,CDCl3)δ 146.31,141.36,139.18,138.06,137.25,131.10,129.59,129.08,128.59,94.62,21.28,20.87;GC-MS:308。
4 结论
我们通过钯催化芳基硼酸底物与邻碘苯胺进行偶联反应,偶联产物不用分离直接进行重氮化反应一锅法实现一系列2-碘联芳烃化合物的合成。该方法以水和丙酮为溶剂,催化剂的用量低至0.2%,绿色环保,操作简单,这为我们进行2-碘联芳烃化合物的后续转化研究提供了坚实的物质基础。
[1]Schneider N,Lowe D M,Sayle R A,et al. Big data from pharmaceutical patents: A computational analysis of medicinal chemists' bread and butter[J]. Journal of Medicinal Chemistry,2016,59(9):4385-4402.
[2]Liu J,Lotesta S D,Sorensen E J.A concise synthesis of the molecular framework of pleuromutilin[J]. Chemical Communications,2011,47(5):1500-1502.
[3]Wu B,Liu Q,Sulikowski G A.Total synthesis of apoptolidinone[J].Angewandte Chemie International Edition,2004,43:6673-6675.
[4]Hanazawa T,Koyama A,Wada T,et al.Efficient convergent synthesis of 1α,25-dihydroxyvitamin D3 and its analogues by suzuki?miyaura coupling[J].Organic Letters,2003,5(4):523-525.
[5]Miyaura N,Suzuki A.Palladium-catalyzed cross-coupling reactions of organoboron compounds[J].Chemical Reviews,1995,95(7):2457-2483.
[6]Han F S.Transition-metal-catalyzed Suzuki-Miyaura cross-coupling reactions: a remarkable advance from palladium to nickel catalysts[J].Chemical Society Reviews,2013,42(12):5270-5298.
[7]Wu X F,Anbarasan P,Neumann H,et al.From noble metal to nobel prize: palladium‐catalyzed coupling reactions as key methods in organic synthesis[J].Angewandte Chemie International Edition,2010,49(48):9047-9050.
[8]Suzuki A. Cross‐coupling reactions of organoboranes: An easy way to construct C-C bonds (nobel lecture)[J].Angewandte Chemie International Edition,2011,50(30):6722-6737.
[9]Hartwig J F.Transition metal catalyzed synthesis of arylamines and aryl ethers from aryl halides and triflates: scope and mechanism[J].Angewandte Chemie International Edition,1998,37(15):2046-2067.
[10]Bhunia S,Pawar G G,Kumar S S,et al.Selected copper‐based reactions for C-N, C-O, C-S, and C-C bond formation[J]. Angewandte Chemie International Edition,2017,56(51): 16136-16179.
[11]Grushin V V.Cyclic diaryliodonium ions: old mysteries solved andnew applications envisaged[J].Chemical Society Reviews,2000,29:315-324.
[12]Chatterjee N,Goswami A.Synthesis and application of cyclic diaryliodonium salts: A platform for bifunctionalization in a single step[J]. European Journal of Organic Chemistry,2017(21):3023-3032.
[13]Jiang H,Zhang Y,Chen D,et al.An approach to tetraphenylenes via Pd-catalyzed C-H functionalization[J].Organic Letters,2016,18(9):2032-2035.
