低温胁迫下外源ABA对玉米幼苗抗寒性的影响
2018-07-06石如意王腾飞裴玉贺宋希云
石如意,王腾飞,李 军,裴玉贺,宋希云
(1.青岛农业大学 生命科学学院,山东 青岛 266109;2.青岛农业大学 农学院,山东 青岛 266109)
玉米是我国重要的粮食作物,而低温严重影响着玉米的生长发育、产量与品质,提高玉米的耐寒性是其抗逆研究的一个重要方面[1]。研究表明,低温胁迫下植物体内活性氧(ROS)的“产生-清除”平衡机制被打破,导致活性氧在细胞内的快速积累,引发氧化胁迫。如果冷害持续时间较长,细胞会出现一系列生理生化功能的紊乱,最终导致植物的死亡[2]。植物体内活性氧的清除主要靠细胞内的保护酶系统如CAT、SOD、POD和APX等,苏群等[3]研究发现,低温胁迫下保护酶的酶活性出现不同程度的升高,外源调节物对玉米幼苗保护酶活性的提高具有积极的作用。
李春燕等[4]研究发现在低温条件下,小麦体内的内源激素水平会发生改变。Yang等[5]发现猕猴桃果实经过12 ℃低温处理3 d,果实内ABA、IAA、ZR的含量增加,但GA3含量下降,耐寒性明显增强。然而,Ding等[6]发现水杨酸处理后上调了番茄果实赤霉素合成关键基因GA3OX1的表达,促进了GA3的合成,减轻了低温造成的伤害。Wang等[7]用1 mmol/L H2O2处理番茄植株,发现叶片中ABA和ZR的含量增加,GA3含量降低,明显地提高了植物的抗寒性。这些研究表明,植物通过调控基因表达,改变了内源激素的水平,从而对低温等逆境做出应答。
植物的抗寒性是由多基因控制的数量性状,一些与植物耐受低温胁迫相关的基因相继被克隆和鉴定出来。由Asr基因家族编码的Asr蛋白是生物体中与逆境有关的家族蛋白,植物受到逆境胁迫(如低温、干旱、盐胁迫等)后,Asr蛋白大量表达,可以缓解逆境引起的伤害,增强了植物耐冷和耐旱性[8-9]。利用蛋白质双向电泳技术,杨猛等[10]从玉米中筛选到一个受低温诱导的Asr1基因。Fad基因编码一种脂肪酸去饱和酶,在番茄叶绿体中过表达LeFad7基因明显增强了番茄的耐低温能力[11]。一些编码保护酶的基因如Cat和Apx1等,它们的转录水平也受低温诱导[12]。Dreb转录因子在植物抵抗非生物胁迫中起到关键作用,过表达菊花DmDreba基因提高转化烟草耐低温能力[13]。
ABA是一种植物响应逆境胁迫的重要信号因子,通过喷施外源ABA可以有效缓解逆境胁迫造成的伤害[14]。Huang等[15]发现,利用外源ABA处理狗牙根,明显增强了其对低温的抗性,且耐寒品种比冷敏感品种更加显著。尽管前人对外源ABA处理提高植物抗逆性方面做了大量的研究工作,但对不同玉米品种苗期抗寒性的研究却较少。因此,本研究以2种不同耐寒性的玉米品种为材料,进行低温和外源ABA处理,从生理生化、分子水平上揭示了苗期在受低温胁迫下生理差异以及抗冷的分子机制,提出了适合我国北方地区玉米生产中应对低温冷害的策略。
1 材料和方法
1.1 试验材料
本试验选用2个玉米品种:耐寒品种青农105由青岛农业大学农学院玉米中心育成,冷敏感品种农华101购自山东省莱阳市种子公司。釆用盆栽方式播种。
1.2 试验方法
在常温(25 ℃)条件下培养玉米至三叶一心时,选取健壮、长势均一的幼苗,将试验材料分为3组,第1组:以清水常温作为对照(25 ℃);第2组:昼温/夜=(10±0.5)℃低温培养(10 ℃);第3组:叶面喷施ABA+昼温/夜=(10±0.5)℃低温培养(10 ℃A),ABA浓度15 mg/L,每株喷施5 mL,处理25 h后,将植株放置于光照培养箱中进行低温处理,光照时间为12 h,光强为10 000 lx,相对湿度60%~70%。试验共重复3次,每个重复处理10株。低温胁迫4 d后,剪取相同部位叶片快速置于液氮中保存。
1.3 生理生化指标测定
参照张以顺等[16]《植物生理学实验教程》中的方法,测定在低温条件下外施ABA后玉米叶片的生理生化指标。主要通过以下测量方法:细胞膜相对透性的测定采用电导率法;MDA含量的测定采用硫代巴比妥酸法;可溶性糖含量的测定采用蒽酮比色法;超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法;过氧化氢酶(CAT)活性测定采用比色法;过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)活性测定采用愈创木酚法。内源激素含量测定釆用酶联免疫吸附法[17](ELISA)。每个处理重复测定3次,取平均值。
1.4 抗寒相关基因的表达分析
从https://www.ncbi.nlm.nih.gov网站上查找与玉米抗寒性相关基因,找到各基因cDNA序列,利用Primer Primier 5软件设计实时荧光定量引物(表1)。参照TaKaRa公司的RNA提取说明书,利用其RNA提取试剂盒提取叶片总RNA。cDNA第1链合成参照反转录试剂盒(TaKaRa公司)说明书完成。以Actin1基因作为内参基因,相对定量采用2-ΔΔCt方法[18]。

表1 实时荧光定量引物信息汇总Tab.1 Primers used in amplication of sequence in the RT-PCR analysis
1.5 数据处理
采用Microsoft Excel 2007进行整理数据,用SPPS软件进行数据方差分析和显著性检验,差异显著性水平为0.05。
2 结果与分析
2.1 低温胁迫下外源ABA对玉米幼苗叶片丙二醛、相对电导率和可溶性糖的影响
丙二醛(MDA)是膜脂过氧化的终产物,其含量的高低是反映膜损伤程度的重要指标之一。与25 ℃相比,在低温胁迫下农华101叶片中MDA的含量(以鲜质量计)增幅是青农105的3倍(图1-A)。10 ℃+ABA处理与10 ℃相比,青农105的MDA含量下降了35.6%,农华101下降了29.7%,说明施加外源ABA降低了MDA含量,减轻了低温对细胞膜的破坏程度,而青农105的MDA下降的幅度更大,能更好地减轻冷胁迫对玉米的伤害。
相对电导率的大小直接反映了细胞膜结构和功能的受损程度。在低温胁迫条件下,细胞膜透性增大,胞内电解质外渗,相对电导率增加。从图1-B可以看出,与25 ℃相比,在低温胁迫下2个玉米品种的细胞膜透性上升,青农105的电导率增幅较小。10 ℃+ABA处理与10 ℃相比,青农105的电导率下降了48.4%,农华101下降37.0%,说明低温下外施ABA对抗寒品种青农105的相对电导率作用更明显。
通过提高渗透调节物质的含量来增强渗透调节能力,也是植物提高抗逆能力的途径之一。从图1-C可以看出,在10 ℃低温与25 ℃常温相比,青农105的可溶性糖含量较对照提高了4倍,而农华101也比对照提高了2倍,说明低温胁迫引起了这2个品种的可溶性糖含量明显上升,但青农105的增幅较大。10 ℃+ABA处理与10 ℃低温相比,青农105的可溶性糖含量增加了16.5%,农华101增加了48.7%。与相对电导率和MDA含量的降低相比,植物通过可溶性糖含量的升高来减缓低温对植物细胞的伤害,说明植物对低温的胁迫应答是一个极其复杂的生理过程。

柱形图上不同字母表示处理间存在显著性差异P<0.05。图2-4同。There are significant difference between different letters on the column graph P<0.05.The same as Tab.2-4.
2.2 低温胁迫下外源ABA对玉米幼苗叶片抗氧化酶活性的影响
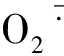
过氧化氢酶(CAT)通过分解H2O2,来维护细胞膜系统的稳定性。从图2-B可以看出,低温胁迫提高了玉米幼苗叶片的CAT活性(以鲜质量计),青农105的增幅是农华101的2倍。外源ABA处理进一步提高了低温胁迫下CAT活性,减少H2O2的积累。10 ℃+ABA处理与10 ℃相比,青农105的CAT活性增加了18%,农华101增加了8.4%。结果表明,低温下外施ABA大幅提高了青农105的CAT活性,从而增强了青农105的抗寒性。
抗坏血酸过氧化物酶(APX)也是清除H2O2的重要酶之一。从图2-C可以看出,低温处理后2个品种的APX活性均有所增加(以鲜质量计)。在低温胁迫条件下,喷施ABA使青农105的APX活性增加了9.2%,农华101增加了5.7%。由此可见,低温胁迫会使玉米幼苗叶片的APX活性增加,外源ABA进一步提高了低温胁迫下APX的活性,其中对青农105的APX活性增加更明显。
POD在细胞保护酶系统中负责清除光呼吸、线粒体电子传递过程中产生的H2O2。从图2-D可以看出,与25 ℃对照相比,10 ℃低温使2个玉米品种的POD活性均有所下降。在低温胁迫条件下,喷施ABA使青农105的POD活性增加了8.5%,农华增加了1.7%。由此可见,POD不同于SOD、CAT等酶,在低温胁迫下POD的活性先出现降低,但施加外源ABA后提高了青农105的POD活性有所增加,而农华101则没有变化。外源ABA提高了低温胁迫下POD的活性,而对青农105的POD活性增加更明显。
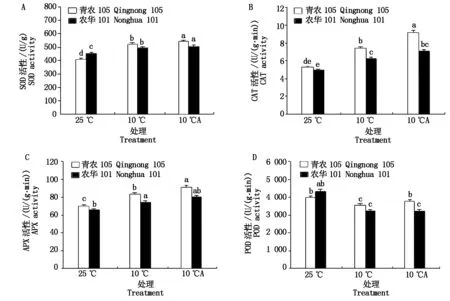
图2 低温胁迫下外源ABA对玉米幼苗叶片抗氧化酶活性的影响Fig.2 Effects of exogenous ABA on antioxidant enzyme activity of leaves of maize seedlings under low temperature stress
2.3 低温胁迫下外源ABA对玉米幼苗叶片内源激素含量活性的影响
脱落酸(ABA)是一种重要的抗逆激素,在植物的胁迫应答中发挥重要作用。由图3-A可知,与25 ℃常温相比,10 ℃低温使2个品种的ABA含量均有所上升,但青农105具有更高的ABA含量。在低温胁迫下,ABA处理使青农105的内源ABA含量增加了12.3%,农华101增加了7.2%。这说明,低温胁迫会增加玉米幼苗叶片的内源ABA合成能力,而外源ABA处理则进一步增加了低温胁迫下内源ABA的含量,其中,对抗寒性强的青农105而言,其含量增加更加明显。
从图3-B可知,与25 ℃常温相比,2个玉米品种的GA3含量在10 ℃低温时均有所下降,尤其是青农105的降幅较大。在低温胁迫条件下,外施ABA处理使青农105的GA3含量下降了11.5%,农华101下降了9.0%。这说明,低温胁迫降低了玉米幼苗叶片的GA3的合成能力,而外源ABA则使内源GA3的合成能力进一步下降,其中对抗寒性强的青农105而言,外源ABA处理使GA3的合成能力下降更明显。
从图3-C可以看出,与25 ℃常温相比,10 ℃低温青农105的ZR含量下降,而农华101的ZR略有上升。10 ℃+ABA处理与10 ℃相比,青农105的ZR含量下降了12.7%,农华101下降了8.3%。从图3-D可以看出,与25 ℃常温相比,10 ℃低温胁迫下青农105的IAA含量下降而农华101的却上升。10 ℃+ABA处理与10 ℃相比,青农105的IAA含量下降了3.3%,农华101下降了1.2%。由此可见,低温下不同抗寒玉米品种中ZR和IAA合成调控机制存在差异,而外源ABA处理则对2种玉米品种中内源激素ZR和IAA的合成起了负的调控作用。

图3 低温胁迫下外源ABA对玉米幼苗叶片内源激素含量活性的影响Fig.3 Effect of exogenous ABA on endogenous hormone content activity in leaves of maize seedlings under low temperature stress
2.4 低温胁迫下外源ABA对玉米幼苗抗寒相关基因表达的影响
由图2-A-C可以看出,低温胁迫导致青农105和农华101的SOD、CAT、APX保护酶活性提高,外施ABA处理进一步提高了它们在低温胁迫下的表达水平,而且变化趋势一致。为了从分子水平上获得证据,选取Apx1和Cat3基因进行了RT-PCR分析。从图4-A可以看出,在10 ℃低温时,2个品种的Cat3基因表达水平均表达上调,青农105和农华101分别为25 ℃常温对照的2.90,1.29倍。喷施外源ABA后,2个品种的Cat3基因表达量进一步增加。从图4-B中看出,在10 ℃低温时,2个品种的Apx1基因表达上调,青农105和农华101分别为25 ℃常温对照的2.48,1.46倍。喷施外源ABA后,2个品种的Apx1基因表达量进一步增加。在低温胁迫条件下,2个玉米品种的Apx1和Cat3基因表达均上调。在喷施外源ABA后,这2个基因的表达水平又进一步提高,其中青农105的表达水平显著高于农华101,这与酶活的测定结果相吻合。
脂肪酸去饱和酶(FAD)可以增加细胞膜的脂肪酸不饱和度,提高细胞膜的流动性,从而增强抗寒性。Fad8基因编码一种脂肪酸去饱和酶,为此,设计引物,通过RT-PCR分析了Fad8基因在低温胁迫以及在低温胁迫下施加外源ABA对其相对表达量的影响。结果如图4-C所示,在10 ℃低温条件下,青农105和农华101的Fad8基因表达水平均上升,青农105和农华101分别为25 ℃常温的6.19,1.30倍。喷施外源ABA后,青农105的基因表达量出现上调,而农华101却出现了下调,由此可见,低温胁迫诱导2个玉米品种Fad8基因的表达上调,外源ABA进一步促进青农105的基因表达,抑制农华101的基因表达。
研究表明Asr基因家族在植物对逆境的胁迫应答中发挥作用,在施加外源ABA后玉米幼苗叶片Asr1基因的表达水平显著上调。为了进一步验证该基因在玉米苗期抗冷性的作用,分析了青农105和农华101的基因相对表达量。从图4-D中可以看出,低温处理使青农105的表达水平上调,而农华105则出现下调。喷施外源ABA后,这2个品种的基因相对表达量均表现出上调。由此可见,低温胁迫诱导品种青农105的基因表达,抑制农华101的基因表达。而外施ABA促进2个品种在低温胁迫下Asr1基因的表达,从而提高玉米幼苗的抗寒性。
Dreb转录因子与EREBP/AP2 DNA区域结合,介导植物对干旱、低温的耐性。为此,分析了Dreb1基因在低温处理以及外施ABA后的表达情况。结果如图4-E所示,在低温胁迫下,青农105的Dreb1基因表达上调,农华101表达下调,而在喷施外源ABA后,青农105的Dreb1基因表达量继续升高,而农华101的表达水平则进一步降低。这说明Dreb1基因在不同抗冷能力的玉米品种中表达行为差异较大。
Lip蛋白属于一类bZip转录因子,它受低温的强烈诱导。从图4-F的RT-PCR结果分析发现,Lip15基因在2个玉米品种中均受低温的诱导表达,青农105和农华101分别为25 ℃对照的3.05,1.69倍。喷施外源ABA后,青农105的Lip15基因表达出现下调而农华101的基因表达上调。由此可见,低温诱导了Lip15基因的表达,而外源ABA处理抑制了抗寒能力较强的青农105在低温胁迫条件下该基因的表达水平。
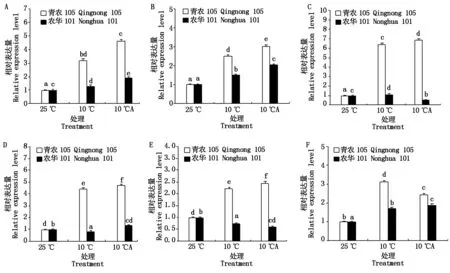
A.外源ABA处理对低温胁迫下玉米幼苗Cat3基因相对表达量的影响;B.外源ABA处理对低温胁迫下玉米幼苗Apx1基因相对表达量的影响;C.外源ABA处理对低温胁迫下玉米幼苗Fad8基因相对表达量的影响;D.外源ABA处理对低温胁迫下玉米幼苗Asr1基因相对表达量的影响;E.外源ABA处理对低温胁迫下玉米幼苗Dreb1基因相对表达量的影响;F.外源ABA处理对低温胁迫下玉米幼苗Lip15基因相对表达量的影响。
A.Effect of exogenous ABA on relative expression ofCat3 gene in maize seedlings under low temperature stress;B.Effect of exogenous ABA on relative expression ofApx1gene in maize seedlings under low temperature stress;C.Effect of exogenous ABA on relative expression ofFad8 gene in maize seedlings under low temperature stress;D.The effect of exogenous ABA on the relative expression ofAsr1 gene in maize seedlings under low temperature stress;E.The effect of exogenous ABA on the relative expression ofDreb1 gene in maize seedlings under low temperature stress;F.The effect of exogenous ABA on the relative expression ofLip15 gene in maize seedlings under low temperature stress.
图4低温胁迫下外源ABA对玉米幼苗抗寒相关基因表达的影响
Fig.4EffectofexogenousABAontheexpressionofcoldresistancerelatedgenesinmaizeseedlingsunderlowtemperaturestress
3 讨论
玉米是一种喜温作物,当遭受低温胁迫时其生长发育受到抑制,严重时会导致死亡[19]。玉米幼苗在低温胁迫条件下,MDA含量升高,说明膜脂过氧化作用增强,导致膜系统受到破坏,胞内电解质外渗,相对电导率增加,这与前人研究报道一致[20]。青农105与农华101相比,MDA含量和相对电导率增幅较小,说明耐冷性的品种受到的低温伤害程度较小。可溶性糖作为一种重要的渗透调节物质,可以调节细胞内外的渗透平衡,缓冲细胞质过度脱水引发的渗透胁迫。在低温下,2个玉米品种的可溶性糖含量均出现快速积累。ABA是一种植物响应逆境胁迫下重要的信号因子,喷施外源ABA可以减轻逆境对植物的伤害[21]。本试验结果表明,喷施一定浓度的外源ABA可以降低MDA的含量和相对电导率的大小,提高可溶性糖的含量,减轻低温胁迫带来的氧化胁迫和渗透胁迫。
低温胁迫条件下植物体内的“活性氧产生与清除”动态平衡状态被打破,导致活性氧快速累积。为清除活性氧带来的氧化胁迫,细胞内的保护酶系统(如SOD、POD、CAT、APX)协同作用,降低活性氧的含量水平来减轻对细胞的伤害。研究发现,外施水杨酸提高了低温胁迫下小麦幼苗APX、CAT和SOD的活性,增强了冬小麦的抗寒性[22]。本试验结果表明,低温胁迫处理引起2个玉米品种SOD、CAT和APX活性不同程度增加,但低温下POD活性在2个玉米品种中均出现下降。外施ABA进一步增加了SOD、CAT和APX活性,POD活性在青农105出现小幅增长,而农华101则没有变化。这说明POD酶活性在抗冷性不同的作物中存在一定的差别。
内源激素的水平在植物的逆境响应中发挥着重要的作用,张巽等[23]研究发现低温影响灌浆期玉米内源激素的含量。本试验也证实外源ABA处理增加了低温胁迫下2个玉米品种的ABA含量,但IAA却在2个抗性不同的玉米品种中表现不一,如10 ℃低温使青农105的IAA含量下降,农华101的IAA含量上升;而ABA处理使青农105和农华101的IAA含量均下降。与IAA的变化相似,低温导致GA3、ZR的含量在抗冷性的青农105中有所下降,而在农华101中却变化不显著,外施ABA进一步降低了它们的合成能力。由此可见,外源ABA处理正向调控了内源ABA的合成,增强了对低温的耐受能力,同时负调控了IAA、ZR和GA3的合成,这可能与低温胁迫下植物生长受抑制有关。
植物的抗寒性是由多基因控制的数量性状。Apx1基因在植物应对逆境胁迫发挥重要作用,这已在拟南芥、水稻、龙爪稷中得到验证[24-26]。过表达LeFad7的转基因番茄比野生型具有更高的低温耐受性[27]。玉米幼苗经低温和外源ABA处理后,Cat3共同的表达水平明显提高[28]。本研究中,低温胁迫诱导了2个玉米品种的Apx1基因、Fad8基因、Lip15基因、Cat3基因及青农105的Dreb1基因、Asr1基因的表达,抑制了农华101的Dreb1基因、Asr1基因的表达,这与前人研究相一致,而外源ABA处理进一步诱导了低温胁迫下2个品种的Apx1基因、Asr1基因、Cat3基因、青农105的Dreb1基因、Fad8基因及冷敏感品种农华101的Lip15基因的表达。
所有结果表明,外施ABA降低了低温胁迫引起的MDA含量和相对电导率,提高了可溶性糖含量。同时明显提高了低温胁迫下2个玉米品种的SOD、CAT、APX活性和内源ABA的含量,降低了GA3、ZR、IAA含量,增强了低温胁迫下一些与逆境胁迫相关基因的表达。通过分析ABA对青农105和农华101的抗寒效果,发现耐寒性强的玉米品种效果更明显。因此,在冷害频发的我国北方地区,可以采用采取如下策略保障春玉米的生产:尽量选用耐寒能力较强的玉米品种;在获悉冷害来临之前,通过喷施一定浓度的ABA来减轻低温对玉米苗期的伤害。
参考文献:
[1] 郭楠楠,陈学林,张 继,等. 复合外源物质对玉米幼苗抗寒性的影响[J]. 广西植物,2017,37(4):504-510.
[2] Gill S S,Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry,2010,48(12):909-930.
[3] 苏 群,李 晶. 低温胁迫下外源水杨酸对玉米幼苗保护酶的影响[J]. 现代化农业,2017(8):46-48.
[4] 李春燕,杨 景,张玉雪,等. 小麦分蘖期冻害后增施恢复肥的产量挽回效应及其生理机制[J]. 中国农业科学,2017,50(10):1781-1791.
[5] Yang Q Z,Zhang Z K,Rao J P,et al. Low-temperature conditioning induces chilling tolerance in `Hayward′ kiwifruit by enhancing antioxidant enzyme activity and regulating en-dogenous hormones levels[J]. Journal of the Science of Food and Agriculture,2013,93(15):3691-3699.
[6] Ding Y,Zhao J H,Nie Y,et al. Salicylic-acid-induced chilling- and Oxidative-stress tolerance in relation to gibberellin homeostasis,C-Repeat/Dehydration-responsive element binding factor pathway,and antioxidant enzyme systems in Cold-stored tomato fruit[J]. Journal of Agricultural and Food Chemistry,2016,64(43):8200-8206.
[7] Wang L,Zhao R R,Zheng Y Y,et al. SIMAPK1/2/3 and antioxidant enzymes are associated with H2O2-Induced chilling tolerance in tomato plants[J]. Journal of Agricultural and Food Chemistry,2017,65(32):6812-6820.
[8] 程维舜,孙玉宏,曾红霞,等. ASR蛋白与植物的抗逆性研究进展[J]. 园艺学报,2013,40(10):2049-2057.

[10] 杨 猛,庄文锋,魏 湜,等. 玉米苗期受低温胁迫蛋白表达差异研究[J]. 核农学报,2013,27(11):1742-1748.
[11] Liu X Y,Teng Y B,Li B,et al. Enhancement of low-temperature tolerance in transgenic tomato plants overexpressing Lefad7 through regulation of trienoic fatty acids[J]. Photosynthetica,2013,51(2):238-244.
[12] Lin K H,Huang H C,Lin C Y. Cloning,expression and physiological analysis of broccoli catalase gene and Chinese cabbage ascorbate peroxidase gene under heat stress[J]. Plant Cell Reports,2010,29(6):575-593.
[13] 杨艳芳,武 剑,朱 凯,等. 过量表达菊花DmDREBa基因提高转化烟草耐低温能力[J]. 植物研究,2016,36(5):721-729.
[14] Wang G J,Miao W,Wang J Y,et al. Effects of exogenous abscisic acid on antioxidant system in weedy and cultivated rice with different chilling sensitivity under chilling stress[J]. Journal of Agronomy and Crop Science,2013,199(3):200-208.
[15] Huang X E,Shi H Y,Hu Z R,et al. ABA is involved in regulation of cold stress response in bermudagrass[J]. Frontiers in Plant Science,2017,8:1613.
[16] 张以顺,黄 霞,陈云凤. 植物生理学实验教程[M]. 北京:高等教育出版社,2009:128-129.
[17] Li Q,Li P,Sun L,et al. Expression analysis of β-glucosidase genes that regulate abscisic acid homeostasis during watermelon(Citrulluslanatus)development and under stress conditions[J]. Journal of Plant Physiology,2012,169(1):78.
[18] 徐丽华,刘春雷,常玉梅,等. 双标准曲线相对定量PCR试验原理与方法[J]. 生物技术通报,2011(1):70-75.
[19] Bilska-Kos A,Grzybowski M,Jonczyk M A. In situ localization and changes in the expression level of transcripts related to intercellular transport and phloem loading in leaves of maize(ZeamaysL.)treated with low temperature[J]. Acta Physiologiae Plantarum,2016,38(5):1-10.
[20] 李馨园,杨 晔,张丽芳,等. 外源ABA对低温胁迫下玉米幼苗内源激素含量及Asr1基因表达的调节[J]. 作物学报,2017,43(1):141-148.
[21] Zhang L,Gao M,Hu J,et al. Modulation role of abscisic acid(ABA)on growth,water relations and glycinebetaine metabolism in two maize(ZeamaysL.)cultivars under drought stress[J]. International Journal of Molecular Sciences,2012,13(3):3189-3202.
[22] Yu J,Cang J,Li Y P,et al. Salicylic acid-induced antioxidant protection against low temperature in cold-hardy winter wheat[J]. Acta Physiologiae Plantarum,2016,38(11):1-10.
[23] 张 巽,张 萍,陈璐洁,等. 灌浆期低温对离体玉米子粒灌浆过程及内源激素的影响[J]. 玉米科学,2017,25(2):49-54.
[24] Yang H J,Mu J Y,Chen L C,et al. S-Nitrosylation positively regulates ascorbate peroxidase activity during plant stress responses[J]. Plant Physiology,2015,167(4):1604-1615.
[25] Bhatt D,Saxena S C,Jain S,et al. Cloning,expression and functional validation of drought inducible ascorbate peroxidase(Ec-apx1)fromEleusinecoracana[J]. Molecular Biology Reports,2013,40(2):1155-1165.
[26] Rosa S B,Caverzan A,Teixeira F K,et al. Cytosolic APx knockdown indicates an ambiguous redox responses in rice[J]. Phytochemistry,2010,71(5/6):548-558.
[27] Liu X Y,Li B,Yang J H,et al. Overexpression of tomato chloroplast omega-3 fatty acid desaturase gene alleviates the photoinhibition of photosystems 2 and 1 under chilling stress[J]. Photosynthetica,2008,46(2):185-192.
[28] Ribas-Carbo M,Aroca R,Gonzalez-Meler M A,et al. The electron partitioning between the cytochrome and alternative respiratory pathways during chilling recovery in two cultivars of maize differing in chilling sensitivity[J]. Plant Physiology,2000,122(1):199-204.
