转epsps-G6基因棉花的Southern杂交及遗传特性分析
2018-07-06燕树锋许蒙蒙祝水金郭新海铁双贵
燕树锋,许蒙蒙,祝水金,郭新海,铁双贵
(1.河南省农业科学院 粮食作物研究所,河南 郑州 450002;2.浙江大学 农业与生物技术学院农学系,浙江 杭州 310085)
草甘膦(Glyphosate)又名农达、草甘宁、镇草宁和膦甘酸等,是一种非选择、内吸传导、广谱、灭生性有机磷类除草剂,每年使用量约为8 500万kg,是全球应用最广泛的除草剂[1-2]。草甘膦作用机制是在莽草酸途径中与结构类似物磷酸烯醇式丙酮酸(PEP)竞争5-烯醇式丙酮酰莽草酸-3-磷酸合酶(EPSPS)活性位点,当除草剂草甘膦与EPSPS酶结合,形成稳定的复合体EPSPS-S3P-草甘膦,造成莽草酸大量积累,阻断了芳香族氨基酸及其次生产物的合成,进而导致植株死亡[3-4]。
在转基因抗草甘膦棉花方面,Mon1445包含1个cp4-epsps基因,是第一个获得商业化应用的抗草甘膦棉花品种;Mon88913包含不同启动子驱动的2个cp4-epsps基因;拜耳公司的GHB614包含1个来源于玉米双突变的2mepsps基因;在全球获批商业化应用的转基因抗草甘膦棉花品种中,大多为上述3个转化事件及其组配的杂交组合[5-6]。
我国转基因抗虫棉应用率达93%,国产化比例超过95%,而国产转基因抗草甘膦棉花尚在研发过程中[7]。因此,本研究将浙江大学克隆并成功转化陆地棉品种中棉所49获得的8个转epsps-G6基因抗草甘膦棉花株系为材料,对具有我国自主知识产权的转基因抗草甘膦棉花进行分子鉴定和遗传分析,旨在为抗草甘膦棉花新种质的育种应用和商业化生产等提供科学依据。
1 材料和方法
1.1 试验材料
G6-1、G6-4、G6-5、G6-7、G6-11、G6-19、G6-20、G6-25,是浙江大学通过花粉管通道法将其克隆的epsps-G6基因导入陆地棉品种中棉所49所获得的8个转基因株系,经PCR检测和草甘膦抗性鉴定证实目的基因已导入棉花基因组且草甘膦抗性得到表达;非转基因的遗传背景亲本中棉所49,由中国农业科学院棉花研究所提供;陆地棉标准系TM-1,由浙江大学祝水金教授课题组自交保存。
PCR引物由生工生物工程(上海)股份有限公司合成;TaqDNA聚合酶和限制性内切酶购于宝生物工程(大连)有限公司;Southern杂交试剂盒DIG-High Prime DNA Labeling and Detection Starter Kit I,由罗氏(Roche)公司生产;普通生化试剂购自北京鼎国生物技术有限公司。
1.2 转基因棉株的DNA提取
采用CTAB法提取转基因抗草甘膦棉花及其背景亲本中棉所49(对照)基因组DNA,经0.8%琼脂糖凝胶电泳之后,条带整齐一致,无降解现象,紫外分光光度计测定的DNA浓度为500~1 000 ng/μL,OD260/280为1.8~1.9,能够满足PCR和分子杂交的需要。
1.3 Southern杂交检测
epsps-G6基因探针标记过程中所用引物序列为F:5′-ACAAGCTGAAGGGCCTGACCTA-3′和R:5′-CTCTGGTTCTCCAGGGTGATGTC-3′,目标片段长度为388 bp,用DIG-High Prime DNA Labeling and Detection Starter Kit I试剂盒进行探针标记;Southern点杂交所需棉花基因组DNA含量为2 μg左右,直接点样于尼龙膜上并自然晾干后,进行DNA变性、中和(5×SSC中10~20 s)和DNA固定(120 ℃烘箱中30 min)等,其他预杂交、杂交、洗涤及免疫过程与Southern杂交相同;Southern杂交所需棉花基因组DNA含量为20~30 μg,双酶切时选用的限制性内切酶为Hind Ⅲ和EcoR Ⅰ,单酶切时选用限制性内切酶EcoRⅠ,酶切后使用0.8%琼脂糖凝胶进行电泳8~10 h,并使用毛细管印迹法进行DNA转膜;探针标记、探针灵敏度确定、预杂交、杂交及检测等操作过程均严格按照罗氏Southern杂交试剂盒说明书要求进行。
1.4 抗草甘膦性的遗传分析
选用经Southern杂交鉴定为单拷贝插入、自交纯合且草甘膦抗性强的3个转基因株系G6-1、G6-5、G6-19,分别与转基因遗传背景材料(中棉所49)和陆地棉标准系(TM-1)进行正反交,配制F1杂交组合,将F1杂交组合种植并自交后获得F2杂交组合。F1和F2杂交组合草甘膦抗性鉴定均为待植株长至2~4片真叶时,喷施20 mmol/L浓度的草甘膦溶液,喷药7 d后调查各群体内的抗性分离情况,并统计草甘膦抗性植株和不抗植株的比例,计算实测值与期望值的比率,并用χ2进行测验。
1.5 统计分析
用Microsoft Excel 2007软件进行χ2和P值计算,计算P值所用统计函数为CHIDIST。
2 结果与分析
2.1 转基因株系的Southern点杂交分析
分别取2 μg转基因株系和非转基因对照中棉所49的基因组DNA,直接点样于尼龙膜上,用地高辛标记后的epsps-G6基因片段做探针进行Southern点杂交。由Southern点杂交结果(图1)可知,非转基因的中棉所49没有检测到杂交信号,转基因株系G6-5、G6-19、G6-20、G6-25均检测到较强的黑色点信号,这表明epsps-G6目的基因已经成功导入棉花基因组。

CK.非转基因对照(中棉所49);1~4.转化株系编号(G6-25、G6-19、G6-5、G6-20)。CK.Non-transgenic control(CCRI-49);1-4.Putative transgenic lines(G6-25,G6-19,G6-5,G6-20).
2.2 转基因株系的双酶切Southern杂交分析
用限制性内切酶Hind Ⅲ和EcoR Ⅰ对PCR检测阳性的转基因棉花株系和非转基因对照中棉所49的基因组DNA进行双酶切,电泳分离后转移到带正电的尼龙膜上,用地高辛标记后的epsps-G6基因片段做探针进行Southern杂交检测。由双酶切Southern杂交结果(图2)可知,非转基因中棉所49没有检测到杂交信号,转基因株系G6-1、G6-25、G6-5、G6-19、G6-4、G6-11、G6-20均检测到长度一致的杂交条带,这进一步说明epsps-G6目的基因已经成功导入到棉花基因组。

CK.非转基因对照(中棉所49);1~7.转化株系编号(G6-1、G6-25、G6-5、G6-19、G6-4、G6-11、G6-20)。CK. Non-transgenic control(CCRI-49);1-7. Putative transgenic lines(G6-1,G6-25,G6-5,G6-19,G6-4,G6-11,G6-20).
2.3 转基因株系的单酶切Southern杂交分析
用限制性内切酶EcoR Ⅰ对PCR检测阳性的转基因抗草甘膦棉花株系基因组DNA进行单酶切,电泳分离后转移到带正电的尼龙膜上,用地高辛标记后的epsps-G6基因片段做探针进行单酶切的Southern杂交检测(图3),结果表明,转基因株系G6-25、G6-19、G6-20、G6-1、G6-7、G6-4、G6-5、G6-11均检测到1~2条杂交条带,其中G6-25、G6-20、G6-7、G6-4含有2个拷贝的epsps-G6基因,G6-19、G6-1、G6-5、G6-11含有单拷贝的epsps-G6基因,8个样品中未检测到多拷贝的epsps-G6基因,这也进一步证实epsps-G6目的基因已经成功导入棉花基因组。

1~8.转化株系编号(G6-25、G6-19、G6-20、G6-1、G6-7、G6-4、G6-5、G6-11)。1-8. Putative transgenic lines(G6-25,G6-19,G6-20,G6-1,G6-7,G6-4,G6-5,G6-11).
2.4 抗草甘膦性状的遗传分析
选用含有单拷贝epsps-G6基因、自交纯合且草甘膦抗性强的3个转基因株系G6-1、G6-5和G6-19,分别与转基因遗传背景材料(中棉所49)和陆地棉标准系(TM-1)进行正反交,配制F1和F2杂交组合。2~4片真叶长出时喷施20 mmol/L浓度草甘膦进行抗性鉴定,喷药7 d后调查抗性植株和不抗植株的数量,并进行χ2测验,分析结果见表1。由转基因株系G6-1、G6-5、G6-19与TM-1和中棉所49正反交F1杂交组合的草甘膦抗性鉴定结果可知,3个转基因株系正反交杂种F1均表现为抗草甘膦,这表明抗草甘膦的epsps-G6基因均导入棉花核基因组,不受细胞质效应的影响;由正反交F2杂交组合的草甘膦抗性鉴定结果可知,3个转基因株系的草甘膦抗性基因经χ2检验均符合3∶1的分离规律,这表明G6-1、G6-5、G6-19均插入了单拷贝的epsps-G6基因,该遗传分析结果与单酶切Southern杂交检测结果相互印证。

表1 转基因棉花抗草甘膦性状的遗传分析Tab.1 Genetic analysis of glyphosate-resistant trait in transgenic cotton
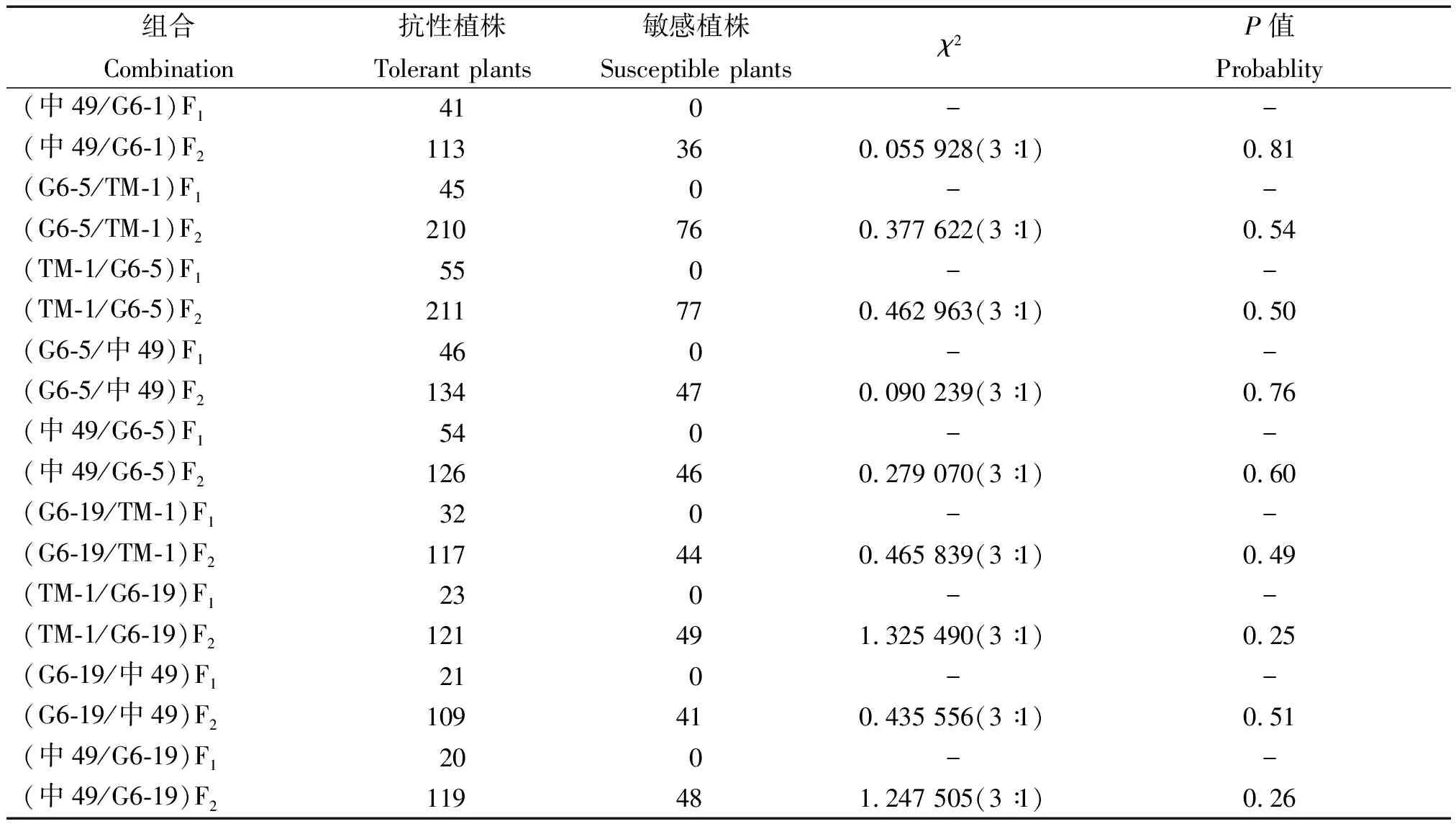
表1(续)
3 结论与讨论
目前,得到商业化应用的抗草甘膦基因主要包括对草甘膦不敏感的epsps基因,如cp4-epsps、2mepsps、mepsps等或在草甘膦发生作用前降解草甘膦的基因,如gat4601、gat4621和goxv247等,其中单独的goxv247基因对草甘膦的抗性水平不足,商业化时常与对草甘膦不敏感的epsps基因合用[8-9]。抗草甘膦epsps-G6基因是浙江大学克隆自假单胞杆菌,并通过花粉管通道和茎尖农杆菌介导等方法将该基因成功导入陆地棉品种中,这为自主知识产权的转基因抗草甘膦棉花新品种选育等提供种质基础[10-11]。
在转基因植物分子鉴定方面,Southen杂交技术假阳性率较低,可更好的证实外源基因整合入植物基因组;与定量PCR技术相比,可更直观的鉴定外源基因在植物基因组上的拷贝数,因此成为转基因研究中不可或缺的关键技术之一。地高辛标记与放射性标记相比,不受试验条件限制,安全风险较低,通过对地高辛标记Southern杂交条件的优化和摸索,可取得与放射性标记相同的试验效果,现已基本取代放射性标记,被广泛用于转基因植物的分子鉴定程序[12-15]。Southern点杂交由于只需少量DNA(2 μg左右),1 d内即可完成,可用于Southern杂交的条件摸索和转基因植株的初步鉴定;双酶切的Southern杂交虽能更好表明外源基因整合入植物基因组,但不能鉴定转基因株系的拷贝数;单酶切的Southern杂交不仅可明确目标基因的拷贝数,还可与遗传分析相互印证,来鉴定转基因株系的遗传稳定性。本研究通过Southern点杂交、双酶切和单酶切的Southern杂交均证实目标基因已经整合入棉花基因组,且G6-25、G6-20、G6-7、G6-4含有2个拷贝的epsps-G6基因,G6-19、G6-1、G6-5、G6-11含有单拷贝的epsps-G6基因,这为转epsps-G6基因抗草甘膦棉花的育种应用等提供必要的分子基础。
王秀红等[16]利用农杆菌介导法将抗草甘膦的epsps基因导入玉米,发现部分T1转基因株系不符合孟德尔遗传规律。此外,多项研究表明花粉管通道法、基因枪法、超声波介导法等外源基因直接导入的方法易造成转基因株系早代(T1和T2)分离不符合孟德尔遗传的现象,但3代(T3)后趋于正常,并可稳定遗传[17-19]。本研究所使用材料早代有符合也有不符合孟德尔遗传规律的现象,但自交纯合后使用经Southern杂交鉴定为单拷贝插入的3个转基因株系G6-1、G6-5、G6-19与其背景亲本中棉所49和陆地棉标准系TM-1进行正反交的遗传分析,结果表明,这3个转基因株系与中棉所49和TM-1正反交均符合3∶1的孟德尔分离规律,这再次证实上述3个转基因株系均为单位点插入,抗性基因得到稳定遗传,这与上述研究结果一致[20]。
参考文献:
[1] Liang C,Sun B,Meng Z,et al. Co-expression of GR79 EPSPS and GAT yields herbicide-resistant cotton with low glyphosate residues[J]. Plant Biotechnology Journal,2017,15(12):1622-1629.
[2] 赵锦慧,郭 婕,胡彦民. 应用诱变法筛选玉米抗草甘膦突变株系的研究[J]. 河南农业科学,2011,40(4):49-52.
[3] Wang Y Y,Zhou Z L,Wang X X,et al. Genome-wide association mapping of glyphosate-resistance inGossypiumhirsutumraces[J]. Euphytica,2016,209(1):209-221.
[4] 李世民,沈海龙,刘 迪,等. 盛蕾期转基因抗草甘膦棉花对草甘膦的抗性研究[J]. 河南农业科学,2010,39(10):46-48.
[5] 王旭静,张 欣,刘培磊,等. 复合性状转基因植物的应用现状与安全评价[J]. 中国生物工程杂志,2016,36(4):18-23.
[6] 温广月. 抗草甘膦作物研究进展[J]. 世界农药,2010,32(1):10-17.
[7] 燕树锋,刘海芳,铁双贵,等. 通过草甘膦浸种鉴定抗草甘膦棉花[J]. 分子植物育种,2016,14(3):604-607.
[8] 王 慧,闫晓红,徐 杰,等. 我国抗草甘膦基因的发掘现状[J]. 农业生物技术学报,2014,22(1):109-118.
[9] Dill G M. Glyphosate-resistant crops:history,status and future[J]. Pest Management Science,2005,61(3):219-224.
[10] 燕树锋,刘海芳,铁双贵,等. EPSPS外源基因对陆地棉农艺性状和纤维品质的影响[J]. 棉花学报,2015,27(5):489-493.
[11] 欧 婷,何秋伶,陈进红,等. 基于抗草甘膦基因的棉花茎尖农杆菌介导转化方法的研究[J]. 棉花学报,2013,25(5):410-416.
[12] 周长发,张 锐,张 晓,等. 地高辛随机引物法标记探针的Southern杂交技术优化[J]. 中国农业科技导报,2009,11(4):123-128.
[13] 张 晓,张 锐,于源华,等. 基于DIG-化学发光法的Southern blot方法优化[J]. 生物技术通报,2011(9):205-210.
[14] 刘 禄,牛焱焱,雷 昊,等. 基于地高辛标记对小麦进行Southern杂交分析主要影响因素的优化和验证[J]. 植物遗传资源学报,2012,13(2):182-188.
[15] 王小丽,杜建中,郝曜山,等. 转BADH基因玉米植株的获得及其耐盐性分析[J]. 作物学报,2014,40(11):1973-1979.
[16] 王秀红, 史向远, 白建荣, 等. 抗草甘膦基因的玉米转化及后代遗传分析[J]. 华北农学报, 2011, 26(1): 117-121.
[17] 王守才,王国英,丁群星,等. 转基因在玉米中的遗传分离与整合特性的研究[J]. 遗传学报,1999,26(3):254-261.
[18] 马 盾,周小云,黄乐平. 花粉管通道法转基因棉花后代的遗传特性[J]. 西北农业学报,2008,17(3):147-149.
[19] 刘昭军,李 铁,刘丽艳,等. 花粉管通道介导的抗除草剂基因(bar)对大豆的遗传转化[J]. 大豆科学,2007,26(3):310-314.
[20] 燕树锋,祝水金,刘海芳,等. 转EPSPS基因抗草甘膦棉花的遗传分析[J]. 华北农学报,2015,30(3):54-57.
