艾草可燃性特征的转录组学研究
2018-07-06刘苗苗吴家文吴生兵周美启
刘苗苗,吴家文,吴生兵,周美启
(1.安徽中医药大学研究生院,安徽 合肥 230012;2.安徽中医药大学 新安医学教育部重点实验室,安徽 合肥 230038;3.安徽道地中药材品质提升协同创新中心,安徽 合肥 230012;4.安徽中医药大学针灸经络研究所,安徽 合肥 230038)
艾叶是菊科蒿属植物艾草ArtemisiaargyiLevl.et Vant.的干燥叶,其作为灸法的主材料已有数千年历史。艾绒(干燥艾叶研磨后去杂质而成)作为灸材,一般来说受制于艾绒的可燃性和单纯的温热作用,但也包涵着许多其他未知因素,如药物作用[1]。艾绒的易燃性是艾灸产生临床治疗作用的基础,与艾叶中的艾叶挥发油含量丰富[1]、纤维素等有机化合物含量高有一定关系。艾叶挥发油主要为单萜类和倍半萜类物质[2]。艾叶挥发油和植物纤维素的合成分别受制于萜类物质和纤维素合成的重要功能基因[3]。转录组测序作为分析功能基因及基因表达的最佳手段,已逐渐应用于中医药领域。WANG等[4]通过对黄花蒿腺毛组织(青蒿素产生的部位)的转录组测序,发现萜类和黄酮类物质的合成酶基因,表明腺毛是萜类和黄酮类物质重要的次生代谢活动的场所。目前,关于艾叶的生物分子学研究远远落后于对其化学及药理的研究[2],而艾叶中的功能基因表达与其生物特性的联系未见报道。本研究拟通过艾草转录组测序,比较分析艾草中叶、茎、根组织的基因表达谱,并对这些功能基因进行京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)注释得到萜类物质和纤维素合成的途径,探求参与这两条次生代谢途径的关键酶基因,从基因水平揭示艾草易燃性特性的转组学基础,同时亦为艾叶作为灸材提供实验依据。
1 材料与方法
1.1 植物材料与cDNA文库的制备 艾草于2016年5月花未开时采摘自安徽中医药大学药园,经安徽中医药大学杨青山老师鉴定为菊科蒿属植物艾草ArtemisiaargyiLev. et Vant.。将新鲜艾草用灭菌超纯水洗净、滤纸吸干水分,叶、茎、根分开采集,迅速置于液氮中冷冻,保存于-80 ℃冰箱。用RNA试剂盒分别提取3个组织的总RNA,并用Nano Drop和Agilent 2100检测其纯度、浓度和完整性。合格的总RNA用DNase Ⅰ消化后,带有Oligo(dT)的磁珠富集mRNA并片段化处理。以短片段mRNA为模板合成第一链cDNA,然后合成第二链cDNA,对其进行纯化回收、黏性末端修复,接着在cDNA的3′端加上碱基A并连接接头,选择长度合适的片段进行PCR扩增。最后,构建好的cDNA文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System进行质检。
1.2 转录组测序与数据组装 使用Illumina Hiseq 4000平台(华大基因,武汉)对合格的叶、根、茎cDNA文库进行测序。对测序后得到的原始读段中低质量、接头污染及未知碱基N含量过高的读段进行过滤,从而得到高质量读段并保存为FASTQ格式。使用Trinity软件[5]通过Inchworm,Chrysalis和Butterfly 3个模块依次对高质量读段进行de novo组装,再用TGICL软件[6]将组装后的转录本进行聚类去冗余,最终得到功能基因。功能基因分为clusters和singletons两部分,其基因家族的编号分别以CL和Unigene开头。
1.3 功能基因的KEGG注释与表达量计算 使用NCBI BLAST将功能基因与KEGG数据库(http://www.genome.jp/kegg)进行比对,获取功能基因注释信息。根据注释的Ko编号查找具体的生物学通路,确定艾草功能基因中参与萜类化合物及植物纤维素合成相关的基因。运用Bowtie2软件[7]将高质量读段比对到功能基因上,然后使用RSEM软件[8]计算3个样品中基因的表达水平,得到每个功能基因的标准表达量即FPKM(fragments per kilobase of exon model per million mapped fragments,每1百万个映射上的读段中映射到外显子的每一千个碱基上的读段个数)值。
2 结果
2.1 转录组测序结果 本研究对艾草进行转录组测序,共得到33.46千兆(gigabyte,GB)高质量读段,其Q 20%和Q 30%分别大于98%和95%,表明数据质量可靠,可用于下一步de novo组装。对高质量读段组装并聚类去冗余后得到99 807个功能基因,其总长度、平均长度、N50分别为92 726、525、929、1 456 bp,GC%为40.79%,说明功能基因完整性较高,可对其进行功能注释。将功能基因比对到KEGG数据库后,44 750个(44.84%)功能基因得到注释,共涉及135条代谢通路,主要包括6个方面的分子间相互作用和反应网络,即新陈代谢、细胞过程、环境信息加工、遗传信息加工、人类疾病和生物体系统。笔者按基因获得注释的量的多少进行排序,选取前10个代谢通路(见图1)。涉及代谢途径的功能基因数量最多有9 705个,占21.69%,其次是与次生代谢产物合成相关的功能基因,有5 578个,占12.46%,其余主要富集于碳代谢、氨基酸生物合成、淀粉与蔗糖代谢、嘌呤代谢、苯丙素生物合成等代谢途径。

图1 KEGG功能注释(横坐标表示功能基因的数目,纵坐标表示各种代谢通路)
2.2 代谢途径分析
2.2.1 单萜类与倍半萜类生物合成相关基因的鉴定与分析 单萜类与倍半萜类物质是艾叶挥发油的主要成分,两者生物合成的途径分为异戊烯焦磷酸(isopentenyl-5-pyrophosphate, IPP)及二甲丙烯焦磷酸(dimethylallyl pyrophosphate,DMAPP)前体物质的合成阶段和牦牛儿基焦磷酸(geranyl diphosphate,GPP)、法尼基焦磷酸(farnesyl diphosphate,FPP)等萜类骨架构建和糖基化、羟基化等修饰反应阶段[9]。其中IPP与DMAPP通过甲羟戊酸(mevalonate,MVA)途径和2C-甲基-4-磷酸-4D-赤藓糖醇(2-C-methyl-D-erythritol-4-phosphate,MEP)途径合成[9],随后经过一系列催化作用生成倍半萜类与单萜类产物,见图2。
通过对艾草功能基因的KEGG代谢通路的分析,共有241个功能基因映射到萜类骨架合成通路(Ko00900)上,其中116个功能基因编码萜类骨架合成途径中16种关键酶,包括乙酰CoA转乙酰基酶(acetyl-CoA-acetyltransferase,AATC),甲基戊二酰辅A合成酶(3-hydroxy-3-methylglutaryl-CoA synthase,HMGS)等6个 MVP途径酶;1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS),1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)等8个MEP途径酶和催化萜类骨架前体生成单萜类与倍半萜类物质的牦牛儿基焦磷酸合成酶(geranyl diphosphate synthase,GPPS)及法尼基焦磷酸合酶(farnesyl diphosphate synthase,FPPS),见表1。

图2 单萜类与倍半萜类生物合成途径

表1 单萜类和倍半萜类物质合成关键酶基因
根据功能基因的FPKM值,将FPKM≥1(FPKM≥1的基因定义为表达基因)作为判断基因表达的阈值[9],评估上述16种萜类物质合成关键酶在艾叶、根、茎中的表达水平。基于表1中编码萜类合成关键酶的116种基因,筛选得到叶、根和茎中的表达基因分别有56、66和64个,对应不同酶的表达基因的数目在3个组织中的分布见图3,其中编码HMGR的表达基因在叶、根、茎中均最多。另外,筛选在3个组织中的FPKM之和不小于3的编码16种酶的基因共65个,用log2(FPKM+1)表达式的值将这65个基因的表达水平标准化进行层次聚类分析[10](见图4),可知根和茎聚类较紧密,说明这两种组织中基因的整体表达水平更相近。在整个艾草转录组中,发现编码MVD的基因只有1个,命名为Unigene7594;编码CMS的基因也只有2个,命名为CL7571.Contig1和CL7571.Contig2,它们在3个组织中共表达,且在叶中的表达水平均最高,其次是茎和根,提示这两种关键酶是MVA和MEP途径中的限速酶,对酶基因的调控直接影响次生代谢的速度和终产物的产量。
2.2.2 纤维素合成途径分析 纤维素是自然界中分布最广、含量最多的一种多糖,是人类重要的生物能源原料,具有高度易燃性。植物纤维素的合成是由蔗糖合酶(sucrose synthase,SuSy)催化蔗糖和尿苷二磷酸(uridine diphosphate,UDP)反应生成尿苷二磷酸-葡萄糖(uridine diphosphate -glucose,UDP-G)和果糖;UDP-G经过纤维素合成酶(cellulose synthase,CesA)和其他辅酶催化,再由细胞骨架蛋白等修饰共同完成的复杂过程[11]。另外,细胞外蔗糖在葡萄糖-6-磷酸异构酶(glucose-6-phosphate isomerase,GPI)、葡萄糖磷酸变位酶(phosphoglucomutase,PGM)、尿苷三磷酸-葡萄糖-1-磷酸尿苷酰转移酶(uridine triphosphate-glucose-1-phosphate uridylyltransferase,UGP2)等酶的作用下也能够合成UDP-G[12]。根据艾草转录组背景,在淀粉与蔗糖代谢途径(Ko00500)中,发现有119个编码蔗糖合酶的基因,且在叶、茎、根中表达基因分别有85、97、90个;另外编码CesA的基因只有1个并在叶、根、茎中均有表达,其对应的FPKM值分别为1.0、1.44、1.0。见表2。
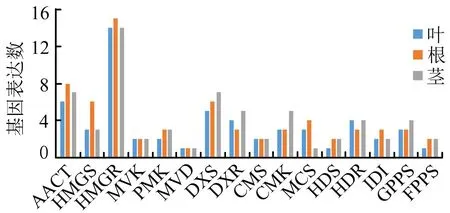
图3 单萜类和倍半萜类物质合成关键酶基因在叶、根、茎中的表达数目分布情况
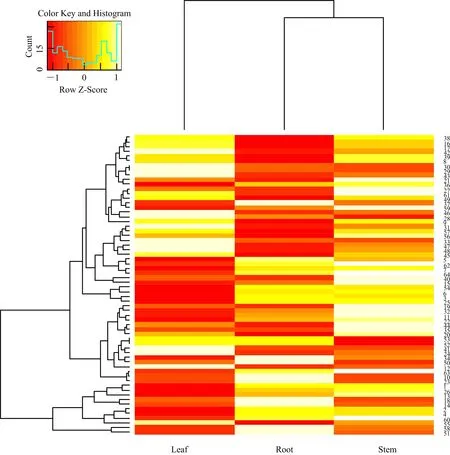
注:颜色的强弱表示基因的表达水平,红色代表低表达水平,黄色代表高表达水平

表2 纤维素合成途径及相关基因
3 讨论
本实验对艾草的叶、根、茎3个组织进行了转录组测序,de novo组装后得到99 807个功能基因,再比对到KEGG数据库中得到萜类和纤维素合成的代谢通路,发现并分析了与萜类物质和纤维素合成相关的关键酶基因。值得关注的是,艾草的3个组织中仅存在1个MVD表达基因和2个CMS表达基因,并且这3个基因均在叶中表达水平最高,提示它们很可能是萜类代谢途径的限速酶。已知高等植物的萜类物质合成都依赖于MVA和MEP途径,MVD是MVA途径中催化形成IPP的最后一个酶,LIAO等[12]基于银杏的转录组数据对MVD基因的表达及功能研究后认为银杏MVD是MVA途径中的关键酶;CMS为MEP途径中的第3个关键酶,在拟南芥中超量表达青蒿CMS基因导致以DMAPP为前体物质合成的叶绿素a、叶绿素b和类胡萝卜素的含量显著增加,表明青蒿CMS对萜类物质的合成具有关键作用[13]。MVD与CMS基因的高表达使艾叶中萜类物质含量可能比根和茎更多,为艾草中选择叶组织为灸材提供分子水平支持。根据KEGG分析,在叶、根和茎中都存在控制萜类和纤维素合成的重要功能基因,说明不仅叶具有可燃性特性,根和茎也有这一生物特性,提示根和茎可能具有开发为灸材的潜力,进而增加资源利用率,但其燃烧时有无临床治疗效应还需进一步研究。
本研究首次对艾叶可燃烧性的相关基因进行挖掘和分析,初步解释了艾叶可燃性的物质基础,从基因层面上论述了艾叶作为灸材的合理性。此外,艾草转录组数据(GSE102404)作为一份宝贵的基因资源,也丰富了我国中草药基因库。
参考文献:
[1] 洪宗国.中医灸法选择艾叶作为灸材的机理研究[J].中南民族大学学报(自然科学版),2015(1):47-51.
[2] 王惠君,王文泉,卢诚,等.艾叶研究进展概述[J].江苏农业科学,2015,43(8):15-19.
[3] 张元,康利平,郭兰萍,等.艾叶的本草考证和应用研究进展[J].上海针灸杂志,2017,36(3):245-255.
[4] WANG W,WANG Y,ZHANG Q,et al.Global characterization of Artemisia annua glandular trichome transcriptome using 454 pyrosequencing[J]. BMC Genomics,2009,10(1):465.
[5] GRABHERR M G,HAAS B J, YASSOUR M,et al.Full-length transcriptome assembly from RNA-Seq data without a reference genome[J].Nature Biotechnology,2011,29(7):644.
[6] PERTEA G,HUANG X,LIANG F,et al.TIGR gene indices clustering tools(TGICL): a software system for fast clustering of large EST datasets[J].Bioinformatics,2003,19(5):651-652.
[7] LANGMEAD B,SALZBERG S L.Fast gapped-read alignment with Bowtie 2[J].Nature Methods,2012,9(4):357.
[8] LI B,DEWEY C N.RSEM:accurate transcript quantification from RNA-Seq data with or without a reference genome[J].BMC Bioinformatics,2011,12(1):323.
[9] WANG Q J,ZHANG M,WANG J W.Recent research on isoprenoid biosynthetic pathway and metabolic regulation of functional isoprenoids in medicinal plants[J].Botanical Research,2012,1(2):23-29.
[10] ZHU J,GENG C,ZHU S,et al. Identification of tissue-specific protein-coding and noncoding transcripts across 14 human tissues using RNA-seq[J].Scientific Reports,2016,6:28400.
[11] 李春秀,齐力旺,王建华,等.植物纤维素合成酶基因和纤维素的生物合成[J].生物技术通报,2005(4):5-11.
[12] LIAO Y,XU F,HUANG X,et al.Characterization and transcriptional profiling of Ginkgo biloba, mevalonate diphosphate decarboxylase gene (GbMVD) promoter towards light and exogenous hormone treatments[J]. Plant Molecular Biology Reporter,2015,34:1-16.
[13] 张曼,向礼恩,王辉,等.青蒿2-C-甲基-D-赤藓醇-4-磷酸胱氨酰转移酶基因克隆与分析[J].药学学报,2016(8):1334-1339.
(收稿日期:2017-12-04;编辑:曹健)
[Abstract]ObjectiveTo study the flammability characteristics ofArtemisiaargyi(A.argyi) on the basis of transcriptome.MethodsAfter picking freshA.argyi, the total RNA of leaves, roots, and stems was extracted, and the cDNA libraries of the three tissues were established for high-throughput sequencing. High-quality reads were obtained by filtering the raw reads after sequencing, and then were de novo assembled using Trinity software to obtain functional genes, which were annotated by Kyoto Encyclopedia of Genes and Genomes (KEGG), and the expression levels of functional genes were also calculated.ResultsBy high-throughput sequencing ofA.argyi, a total of 99 807 functional genes were obtained. After comparing them with the KEGG database, the metabolic pathways for terpenoids and cellulose syntheses were obtained. It was found that 116 genes were involved in the synthesis of terpenoids, and 16 key enzymes were encoded; 119 genes were involved in cellulose synthesis, and 5 key enzymes were encoded. Among the key enzymes for the synthesis of terpenoids, only one MVD gene and two CMS genes existed in each of leaves, roots, and stems, and the expression levels of these three key enzyme genes were highest inA.argyileaves.ConclusionThere are many key enzyme genes involved in terpenoids and cellulose syntheses inA.argyi, but the expression of the most critical ones, rate-limiting enzymes, inA.argyileaves is higher than that in roots and stems, which may be one of the key factors for the selection ofA.argyileaves as moxibustion material.
[Keywords]Artemisiaargyi; Flammability; Terpenoids; Cellulose; Functional gene
