甲基睾酮对雌核发育翘嘴鲌幼鱼性别分化基因表达的影响
2018-07-04余秋果刘士力贾永义张莹莹王在照顾志敏
王 成,余秋果,刘士力,贾永义,张莹莹,张 婷,王在照,顾志敏
(1.浙江省淡水水产研究所 农业部淡水渔业健康养殖重点实验室/浙江省淡水水产遗传育种重点实验室,浙江湖州 313001;2.西北农林科技大学 动物科技学院,陕西杨凌 712100)
翘嘴鲌(Culteralburnus)属鲤形目,鲤科,鲌属,俗称白鱼,主要分布于长江中下游各地区水域。该鱼能把其他小型鱼类转化为高经济价值的鱼肉蛋白,属中上层大型淡水经济鱼类,在湖泊和水库中占有重要地位[1]。生产中发现,该鱼性成熟后雌性比雄性生长快。因此,该鱼的全雌化养殖对提高养殖产量和经济效益具有重要意义。目前,该鱼的全雌培育主要采用雌核发育方法,但该方法对技术要求高,操作复杂,且胚胎孵化率低[2]。诱导伪雄鱼是大量生产该鱼全雌性鱼苗的有效途径[3],而雄激素的浓度和诱导关键时间点的选择是该过程中的难点。因此,在该鱼发育早期,了解其性别决定相关基因的表达模式,以及这些基因在雄激素诱导下的表达变化可为其性别控制提供指导。
鱼类的性别决定机制主要包括遗传决定和环境决定2种模式[4]。在遗传决定模式中,鱼类性别由常染色体和性染色体基因共同决定[5],鱼类性别在发育早期明显地表现为双向潜力,而性别决定基因与鱼类性别分化的方向有密切关系[6]。到目前为止,还没有关于翘嘴鲌性别决定基因的研究。据报道,抗缪勒氏管激素(amh)、芳香化酶基因( cyp19a1a)、核受体超家族0B1( dax1)、叉头框因子L2( foxl2)、Y染色体性别决定基因( sox9)以及双性别mab-3相关因子1( dmrt1)基因在鱼类性别分化中发挥重要作用。在哺乳动物中,amh能抑制雌性生殖器官的发育,相反地,该基因能促进雄性生殖器官发育,对雄性性别分化有重要作用[7-10]。Miura等[11]从日本鳗(Anguillajaponica)未成熟的精巢细胞中鉴定出amh类似物,发现该基因可能参与性别决定和睾丸分化。 cyp19a1a是 cyp19a1的一种亚型,在卵巢组织中特异性表达,其编码的细胞色素P450芳香化酶是类固醇合成过程中的限速酶,可催化雄激素转化为雌激素,诱导肝脏卵黄蛋白原的合成,促进卵子发育早中期物质能量的积累,保证卵子的正常发育[12-13]。 dax1基因是位于X染色体上性反转决定区内的一个候选基因[4],该基因可作为一种转录抑制因子与其受体如雌激素受体或雄激素受体相互作用[14-15],从而调节性腺和肾上腺的发育以及类固醇激素的合成。在罗非鱼(Oreochromismossambicus)中, dax1基因在雌鱼性腺中的表达量高于雄鱼性腺[16],但其在虹鳟(Oncorhynchusmykiss)中的表达模式却恰好相反[17]。 foxl2基因是Forkhead/HNF-3相关转录因子家族的一员,参与卵巢和其他细胞的分化过程[18];该基因也可以促进 cyp19a1的转录表达[19-20]。哺乳动物的 foxl2基因在卵巢中特异性表达,该基因的缺失会导致卵巢颗粒细胞发育为精巢支持细胞。罗非鱼 foxl2基因在性腺分化早期开始表达直至个体成熟,参与其性腺分化的整个过程[20]。sox是一类基因的总称,这类基因的特点是均含有SRY样HMG盒(High mobility group box),但不同种鱼的SRY存在多样性[21]。在多种sox基因中,仅有 sox9基因参与性别分化,斑马鱼(Daniorerio)中有2种该基因, sox9a和 sox9b,这2种基因均可与AACAAAG特异序列结合[22]。 sox9a和 sox9b在斑马鱼成鱼中有不同的表达模式, sox9a基因在脑、肾、肌肉、精巢、胸鳍中均有表达;而 sox9b基因仅在卵巢中表达[23]。dmrt家族基因均具有一个锌指样的DNA结合结构域,这类家族基因与动物生殖器官发育和功能维持有关,在哺乳动物精巢中特异性表达,并通过DM结构域调控性别分化相关基因的表达;鱼类中该基因在胚胎发育期不表达,在处于性别分化期的幼鱼性腺和成鱼精巢中表达量较高,而在成鱼卵巢中表达量较低[12]。
本研究主要检测amh、 cyp19a1a、 dax1、 foxl2、 sox9和 dmrt1基因在雌核发育翘嘴鲌发育早期的表达模式,探究雌核发育翘嘴鲌性腺发育的关键时间点;用不同质量分数MT暴露雌核发育的翘嘴鲌幼鱼,检测这些基因在不同质量分数MT和不同处理时间下表达量的变化情况,筛选诱导伪雄性翘嘴鲌的适宜激素质量分数和处理时间,为生产实践中翘嘴鲌伪雄鱼的诱导奠定基础。
1 材料与方法
1.1 材 料
2015年6月于浙江淡水水产研究所八里店养殖基地进行雌核发育翘嘴鲌的人工诱导,采用饵料拌喂法对出膜后4日龄的幼鱼进行MT暴露。用乙醇喷雾法处理幼鱼饲料,按照6、60 mg/kg的质量分数称取MT(纯度99.0%,D-86199 Augsburg,Germany)溶于φ=95%的乙醇中,充分溶解后喷洒在饲料粉上,对照组饵料用不含MT的相同体积的φ=95%乙醇处理,35 ℃烘干后使用。
1.2 方法
1.2.1 MT暴露与取样 将4日龄的雌核发育翘嘴鲌幼鱼,用50 L的塑料桶进行8周的暴露试验,设置6、60 mg/kg试验组和空白对照组,分别记为MT6、MT60和CK,每缸120尾受试鱼,3 个平行。分别用含有6、60 mg/kg的MT饲料和乙醇饲料投喂,每天定时定点投喂3次,按其体质量的3%~5%投饵。暴露7、14、21、28、35、42、49和 56 d后分别取样1次,每缸每次随机选取15尾鱼,其中5尾用于RNA提取,5尾冻存进行激素测定,5尾用于组织学检测。在解剖前,测量鱼的体长、全长和体质量等指标。
1.2.2 总RNA提取与反转录 按照RNAiso plus(TakaRa)试剂操作说明书提取总RNA,用10 g/L琼脂糖凝胶电泳检测其完整性,并用微量核酸测定仪检测RNA质量,保证A260/A280的比值在1.8~2.1,用DNase I(TakaRa)消化处理去除DNA污染。按照M-MLV First Strand cDNA Kit(Invitroge)说明书合成cDNA第1链。
1.2.3 引物合成 利用翘嘴鲌转录组数据库中的amh、 dax1、 cyp19a1a、 foxl2、 dmrt1基因序列,设计实时荧光定量PCR引物(表1),引物由南京金斯瑞生物科技有限公司合成。
1.2.4 内参基因的选择 选择2个稳定的内参基因β-actin和 ef1a,计算2个内参基因的几何平均值[24],建立标准曲线对目的基因和内参基因进行定量。内参基因引物序列见表2。
1.2.5 实时定量 PCR 采用qRT-PCR 技术测定目的基因的表达量。qRT-PCR 的反应体系为:SYBR Premix ExTaq(Invitrogen)12.5 μL,上下游引物各0.5 μL,cDNA 1.0 μL,ddH2O 10.5 μL,总体积为25 μL,每个样品重复 3 次。PCR反应程序为:95 ℃预变性30 s,40个循环(95 ℃变性5 s;60 ℃退火及延伸30 s)。做熔解曲线,确定引物及反应是否正常。

表1 目的基因的实时定量 PCR检测引物序列Table 1 Primers of the target genes for quantitative real time PCR
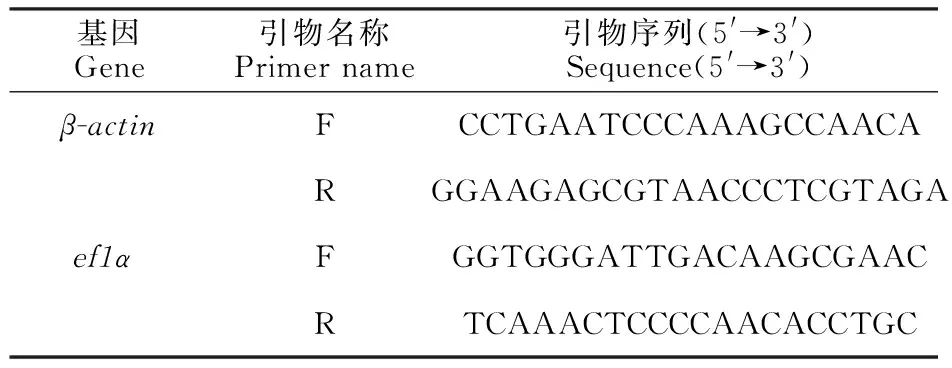
表2 内参基因的实时定量 PCR检测引物序列Table 2 Primers of the housekeeping genes for quantitative real time PCR
1.2.6 激素水平测定 采用ELISA方法检测翘嘴鲌幼鱼全鱼睾酮(T)、11-酮基睾酮(11-KT)以及雌二醇(E2)水平(上海鑫乐科技有限公司),由于幼鱼较小无法采集足够血液,因此测试样品为全鱼的组织研磨液。测定方法按试剂盒说明书进行。
1.2.7 翘嘴鲌性腺组织形态学观察 用Bouin氏液固定翘嘴鲌幼鱼全鱼(去头尾),酒精脱水,石蜡包埋,切片厚度8 μm,H.E.染色,光学显微镜下观察其性腺发育状况。
1.3 数据处理和统计分析
qRT-PCR数据处理采用2-ΔΔCt法,ΔΔCt=处理组(Ct目的基因-Ct内参)-对照组(Ct目的基因-Ct内参)。试验数据表示形式为“平均值±标准误”,用SPSS 20.0软件进行单因素方差分析(ANOVA)。
2 结果与分析
2.1 MT对翘嘴鲌幼鱼体长、体质量和全长的影响
由图1可知,MT6组幼鱼的全长和体质量在暴露28~56 d均显著高于CK组和MT60组(P<0.05),而幼鱼体长在14~56 d显著高于CK组和MT60组(P<0.05)。在整个暴露过程中,MT60组幼鱼的体质量相对于CK组有增加趋势,在处理56 d时体质量显著增加(P<0.05)。
2.2 性别分化相关基因在不同发育时期的相对表达量
由图2可知,在不同发育时期,翘嘴鲌幼鱼性别发育相关基因的表达模式不同。 dmrt1基因在4~60日龄幼鱼的发育过程中表达量均较低; foxl2基因在39~53日龄幼鱼中的表达量先增加后降低,但总体均高于其他发育时期;amh、 cyp19a1a和 dax1基因在46~60日龄幼鱼中的表达量先增加后降低,但总体均高于其他发育时期;而 sox9b在46~60日龄幼鱼中的表达量先降低后增加,但总体均高于其他发育时期。从性别发育相关基因在不同发育阶段的表达模式来看,在46~53日龄幼鱼中,性别分化相关基因的表达量均高于其他发育时期,表明46~53日龄可能是雌核发育翘嘴鲌卵巢发育的关键时期。
2.3 MT对翘嘴鲌性别分化相关基因表达的影响
如图3所示,不同质量分数MT暴露翘嘴鲌后,MT60组amh表达量在处理21 d时显著增加,处理35 d时显著降低(P<0.05);42和49 d时,MT6和MT60组均显著低于CK组(P<0.05)。对于 dax1基因,在处理49 d时,2种质量分数MT均显著抑制其表达,而在28 d时,MT6组的表达量也被显著抑制(P<0.05)。处理21和28 d时,MT60组 cyp19a1a的表达量显著上调(P< 0.05);而在42和49 d 时, 2 个MT组均显著下调(P< 0.05)。在整个暴露期间,翘嘴鲌 dmrt1的表达量一直维持较低水平,处理28 d 时,MT6组显著下降,而处理42 d时,MT6和MT60组均显著下降(P<0.05)。对于 foxl2基因,处理21和28 d时,MT60组均显著上调(P<0.05);而处理42 d时,2个MT处理组均显著下调(P<0.05);暴露至49 d时,2个MT处理组均显著上调(P<0.05);而在56 d时,MT60组的维持显著的高水平(P<0.05)。暴露42 d时,2个 MT处理组 sox9b表达量均显著降低(P<0.05);而在21 d和49 d时,MT60组显著上调(P<0.05)。

*. 表示不同组间差异显著(P<0.05),下同 Indicates significantly difference(P<0.05),the same below
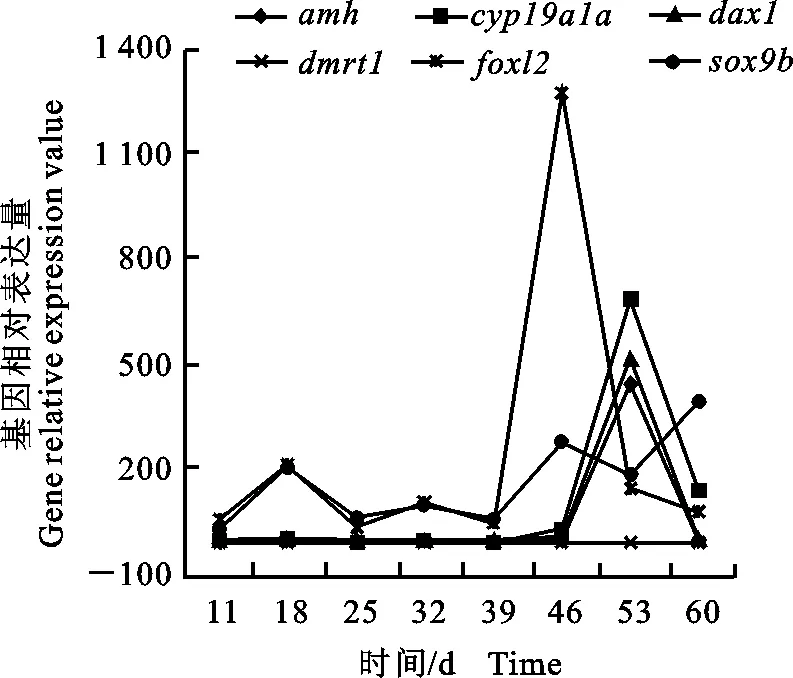
图2 不同发育时期性别分化相关基因的相对表达量Fig.2 Expression of sex differentiation related genes in different development periods
2.4 MT对翘嘴鲌性激素水平的影响
如图4所示,在MT处理28 d时,MT6组和MT60组的E2水平均显著升高,在42和49 d时,MT60组显著降低(P<0.05),而处理至56 d时,MT6组显著升高(P<0.05)。MT暴露21~56 d,2个MT组幼鱼中T的水平均显著降低,尤其在42~56 d,T水平与MT质量分数和暴露时间呈反比(P<0.05)。MT60组11-KT水平在第21天显著增加,而在第49天显著降低(P<0.05);MT6组11-KT水平在第28天、42天和56天均显著增加(P<0.05)。4~60日龄的翘嘴鲌全鱼组织学观察均未发现性腺组织(图4)。
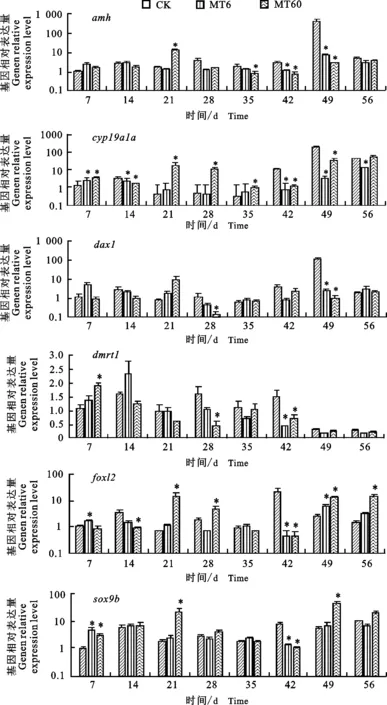
图3 MT暴露下翘嘴鲌幼鱼性别分化相关基因表达Fig.3 The relative expression of sex differentiation related gene in C.alburnus juveniles under MT exposure
3 讨 论
Higgs等[25]的研究结果表明,激素类药物能明显提高饲料转化率,并促进鱼类生长。本研究也发现低质量分数MT(6 mg/kg)处理翘嘴鲌超过28 d后,能显著增加幼鱼体长、全长和体质量,这表明适宜质量分数的MT能促进翘嘴鲌的生长,但这种促进作用与MT的质量分数并不呈正比,当质量分数过高时,这种促进作用反而减弱。
在虹鳟稚鱼和鲤鱼(CyprinuscarpioLinnaeus)的暴露试验中,当MT的质量分数小于10 mg/kg时,幼鱼体长与体质量均显著增加,但当MT的质量分数高于10 mg/kg时,反而会抑制幼鱼的生长[26-27]。
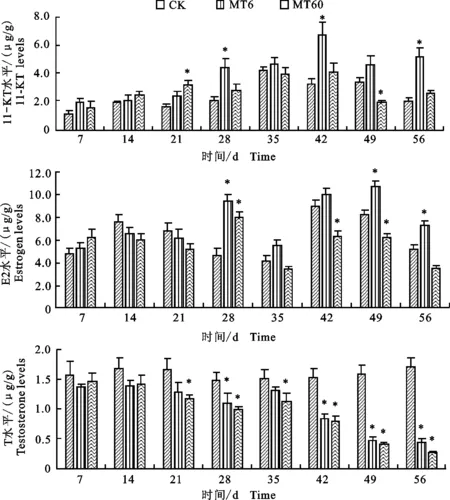
图4 翘嘴鲌幼鱼性激素水平Fig.4 Sex hormone levels in C.alburnus juveniles
不同种鱼类性腺形成的时期不同,黄颡鱼在14日龄时卵巢开始分化,随后逐步形成卵巢腔[28]。斑马鱼在25日龄时出现卵巢结构[29]。黄姑鱼在36日龄时原始生殖细胞开始进行有丝分裂,40日龄时已经能够观察到典型的卵母细胞,在46日龄时可观察到卵巢腔[30]。而半滑舌鳎在62日龄时卵巢才开始分化,至120日龄时形成明显的卵巢腔[31]。本研究中,组织切片中未观察到卵巢组织,表明翘嘴鲌的性腺发育可能相对较晚。然而在46~53日龄的幼鱼中,性别分化相关基因amh、 sox9b、 dax1、 cyp19a1a和 foxl2的表达量均高于其他发育时期,表明该阶段可能是雌核发育翘嘴鲌性腺分化的关键时期。
在雄性性腺分化期,amh可抑制缪勒氏管的形成和雌性生殖器官的发育,使中肾管发育为雄性生殖器官,是重要的性别分化因子[32-33]。哺乳动物的 dax1基因位于X染色体上性反转决定区,可抑制睾丸的发育[4]。在鱼类中, dax1在雌雄鱼性腺中均有表达,但表达量因物种而异[15-17]。在本研究中,amh和 dax1基因在MT处理下的表达模式十分相似,所以笔者推测,翘嘴鲌 dax1的功能可能与amh相似。此外,长时间MT处理下,这2个基因均能降低表达量以抵抗MT对卵巢发育的抑制作用。 dmrt1参与精巢功能的维持,在MT处理后引发性反转的雌性半滑舌鳎性腺中, dmrt1的表达量显著升高[34]。本研究中, dmrt1基因在4~60 d的发育过程中表达量一直较低,这可能是由于受试鱼均为雌鱼;但在MT暴露早期(7~14 d), dmrt1的表达量有所升高,这与在半滑舌鳎上的研究结果相一致[34];在暴露后期(21~56 d), dmrt1的表达量反而降低,这可能与机体对MT的反馈调节作用有关。
cyp19a1a基因是催化内源性雄激素转化为雌激素的关键酶,研究中发现,乙炔雌二醇能显著抑制稀有鮈鲫 cyp19a1a基因的表达[35]。而本研究中,在MT暴露的7~56 d, cyp19a1a的表达量也发生显著变化。 foxl2基因是极少数保守的卵巢分化基因,能促进哺乳动物和鱼类 cypl9ala基因的表达[36-37]。本研究中,在MT暴露的7~42 d, cyp19a1a表达受到的调控与 foxl2较为一致,这表明MT可能通过影响 foxl2的表达调节 cypl9ala的表达。此外, sox9b与 foxl2也有着类似的表达模式,表明雌核发育的翘嘴鲌中这2种基因可能存在比较密切的关系, sox9b可能也参与 cypl9ala的表达调控。与 cypl9ala基因表达量的变化一致,翘嘴鲌幼鱼的E2、T以及11-KT水平也发生显著变化,受MT处理的影响,T的水平与MT质量分数和暴露时间呈反比,这表明外源性雄激素MT抑制机体内源性雄激素T的合成。机体内的E2和11-KT均是由T转化而来,而在本研究中,6 mg/kg 的MT能升高E2和11-KT的水平,表明低质量分数MT可促进机体T向E2和11-KT转化;但60 mg/kg的MT反而会降低E2和11-KT水平,这表明过高质量分数的外源雄激素MT可能会干扰机体类固醇激素的合成。
性腺分化时间的确定对性反转过程十分关键,类固醇激素可在性别分化前有效地诱导鱼类性别的转变,本研究结果表明,雌核发育翘嘴鲌卵巢发育的关键时期可能在46~53日龄。之前的研究表明,用含有30~60 mg/kg 17α-甲基睾酮的饵料连续投喂莫桑比克罗非鱼(Tilapiamossambica)3~4周能有效诱导其向雄性转化[38];而用含50和100 mg/kg雄激素的饵料处理异育银鲫(Carassiusauratusgibelio),不仅不能使其向雄性转化,反而会使其性腺萎缩,使卵巢发育受到抑制[39]。这表明雄激素的浓度对鱼类性腺转化具有关键作用。在本研究56 d的暴露试验中,6和60 mg/kg MT对幼鱼生长、性别分化相关基因的表达模式以及内源性T水平的影响较为一致,这表明60 mg/kg的质量分数并没有达到过量抑制的效果。而在60 mg/kg MT处理下,E2水平下降,表明MT可能抑制翘嘴鲌卵巢发育。
参考文献Reference:
[1] 王 伟. 翘嘴鲌(Culteralbunus)群体遗传多样性及鲌亚科鱼类系统发生的研究[D].上海:华东师范大学,2007.
WANG W.Study on population genetie diversity of (Culteralbunus) and phylogeny of Cultrinae[D].Shanghai:East China Normal University,2007.
[2] 李 停,贾永义,刘士力,等.二次正交旋转组合设计优化人工诱导翘嘴鲌雌核发育[J].中国水产科学,2016,23(1):77-89.
LI T,JIA Y Y,LIU SH L,etal.Optimizing conditions to induce artificial gynogenesis inCulteralburnususing a quadratic orthogonal rotation design[J].JournalofFisherySciencesofChina,2016,23(1):77-89.
[3] 徐竹青.牙鲆全雌化研究的新进展[J].中国水产,2005(8):80-80.
XU ZH Q.New process of feminization ofBastardhalibut[J].ChinaFisheries,2005(8):80-80.
[4] 郑 尧,王在照,陈家长.调控鱼类性腺分化基因的研究进展[J].水生生物学报,2015,39(4):798-810.
ZHENG Y,WANG Z ZH,CHEN J ZH.Progressess on the study of sex difference genes in fish[J].ActaHydrobiologicaSinica,2015,39(4):798-810.
[5] JRGENSEN A,MORTHORST J E,ANDERSEN O,etal.Expression profiles for six zebrafish genes during gonadal sex differentiation[J].ReproductiveBiologyandEndocrinology,2008,6(5):181-190.
[6] 王德寿,吴天利.鱼类性别决定及其机制的研究进展[J].西南师范大学学报(自然科学版),2000,25(3):296-304.
WANG D SH,WU T L.Fish sex determination and its mechanisms:a review[J].JournalofSouthwestChinaNormalUniversity(NaturalScienceEdition),2000,25(3):296-304.
[7] GIUILI G,SHEN W H,INGRAHAM H A.The nuclear receptor SF-1 mediates sexually dimorphic expression of Müullerian inhibiting substance,in vivo[J].Development,1997,124(9):1799-1807.
[8] LEE M M,DONAHOE P K.Müllerian inhibiting substance:a gonadal hormone with multiple functions[J].EndocrineReviews,1993,14(2):152-164.
[9] MNSTERBERG A,LOVELLBADGE R.Expression of the mouse anti-mullerian hormone gene suggests a role in both male and female sexual differentiation[J].Development,1991,113(2):613-624.
[10] LANE,ANDREW H,LEE,etal.Müllerian inhibiting substance:a nontraditional marker of gonadal function[J].CurrentOpinioninEndocrinologyDiabetesandObesity,2001,8(6):296-300.
[11] MIURA T,MIURA C,KONDA Y,etal.Spermatogenesis-preventing substance in Japanese eel[J].Development,2002,129(11):2689-2697.
[12] 文爱韵,尤 锋,徐永立,等.鱼类性别决定与分化相关基因研究进展[J].海洋科学,2008,32(1):74-80.
WEN A Y,YOU F,XU Y L,etal.Research progress on the study of sex determination and differentiation relateds to gene of fish[J].MarineSciences,2008,32(1):74-80.
[13] DEVLIN R H,NAGAHAMA Y,DEVLIN R H,etal.Sex determination and sex differentiation in fish:an overview of genetic,physiological,and environmental influences[J].Aquaculture,2002,208(3/4):191-364.
[14] ZHANG H,THOMSEN J S,JOHANSSON L,etal. DAX-1 functions as an LXXLL-containing corepressor for activated estrogen receptors[J].JournalofBiologicalChemistry,2000,275(51):39855-39859.
[15] HOLTER E,KOTAJA N,MKELA S,etal.Inhibition of androgen receptor(AR) function by the reproductive orphan nuclear receptor DAX-1[J].MolecularEndocrinology,2002,16(3):515-528.
[16] WANG D S,KOBAYASHI T,SENTHILKUMARAN B,etal.Molecular cloning of DAX1 andSHPcDNAs and their expression patterns in the Nile tilapia,Oreochromisniloticus[J].BiochemicalandBiophysicalResearchCommunications,2002,297(3):632-640.
[17] BARON D,HOULGATTE R,FOSTIER A,etal.Large-scale temporal gene expression profiling during gonadal differentiation and early gametogenesis in rainbow trout[J].BiologyofReproduction,2005,73(5):959-966.
[18] CARLSSON P,MAHLAPUU M F.Transcription factors:key players in development and metabolism [J].DevelopmentalBiology,2002,250(1):1-23.
[19] SRIDEVI P,CHAITANYA R K,DUTTA-GUPTA A,etal. FTZ-F1 and FOXL2 up-regulate catfish brain aromatase gene transcription by specific binding to the promoter motifs[J].BiochimicaetBiophysicaActa-Biomembranes,2012,1819(1):57-66.
[20] YOSHIURA Y,SENTHILKUMARAN B,WATANABE M,etal.Synergistic expression of Ad4BP/SF-1 and cytochrome P-450 aromatase(ovarian type) in the ovary ofNiletilapia,Oreochromisniloticus,during vitellogenesis suggests transcriptional interaction[J].BiologyofReproduction,2003,68(5):1545-1553.
[21] 张 悦,鲁晓萱,单祥年.性别决定基因的研究进展[J].遗传,2000,22(5):328-330.
ZHANG Y,LU X X,SHAN X N.Progress in research on sex determinating genes[J].Hereditas,2000,22(5):328-330.
[22] CHIANG F L,PAI C I,WYATT M,etal.Two sox9 genes on duplicated zebrafish chromosomes:expression of similar transcription activators in distinct sites[J].DevelopmentalBiology,2001,231(1):149-163.
[23] 陈 芸,王艺磊,田 佳,等.斑马鱼性别决定相关基因的表达分析[J].水生态学杂志,2010,3(5):10-16.
CHEN Y,WANG Y L,TIAN J,etal.Expression analysis of genes which related to sex determination of zebrafish[J].ReservoirFisheries,2010,3(5):10-16.
[24] VANDESOMPELE J,PRETER K D,PATTYN F,etal.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].GenomeBiology,2002,3(7):0034.1-0034.11.
[25] HIGGS D A,FAGERLUND U H,MCBRIDE J R,etal.Influence of combinations of bovine growth hormone,17 alpha-methyltestosterone,and L-thyroxine on growth of yearling coho salmon(Oncorhynchuskisutch)[J].CanadianJournalofZoology,1977,55(6):1048-56.
[26] 马尚助,于凌杰,刘明波,等.应用17α-甲基睾丸酮促进虹鳟稚鱼生长的试验[J].淡水渔业,1990(4):6-7.
MA SH ZH,YU L J,LIU M B,etal.The growth experiment of 17 alpha methyl testosteroneOncorhynchusmykissjuvenile[J].FreshwaterFisheries,1990(4):6-7.
[27] 任维美.投喂含雄性激素饲料可有效提高鲤鱼产量[J].国外水产,1989(3):45-45.
REN W M.Effectively improve the production of feeding containing testosterone feed carp[J].ForeignFisheriesPeriodicals,1989(3):45-45.
[28] 王 晶,王 冰,李纪同,等.斑马鱼性腺发育的组织学观察[J].基因组学与应用生物学,2011,30(2):168-174.
WANG J,WANG B,LI J T,etal.Histological observation of zebrafish gonad development[J].GenomicsandAppliedBiology,2011,30(2):168-174.
[29] 彭丽娜,卢建国,栾培贤,等.黄颡鱼(Pelteobagrusfulvidraco)性腺分化的组织学观察[J].水产学杂志,2014,27(3):48-51.
PENG L N,LU J G,LUAN P X,etal.Observation on gonadal differentiation in Yellow CatfishPelteobagrusfulvidraco[J].ChineseJournalofFisheries,2014,27(3):48-51.
[30] 耿 智.黄姑鱼早期生长和性腺发育研究[D].浙江舟山:浙江海洋学院,2012.
GENG ZH.Research on the early growth and gonad development of the spotted maigreNibeaalbiflora[D].Zhoushan Zhejiang:Zhejiang Ocean University,2012.
[31] 马学坤,柳学周,温海深,等.半滑舌鳎性腺分化的组织学观察[J].渔业科学进展,2006,27(2):55-61.
MA X K,LIU X ZH,WEN H SH,etal.Histological observation on gonadal sex differentiation inCynoglossussemilaevisGunther[J].MarineFisheriesResearch,2006,27(2):55-61.
[32] 刘姗姗.半滑舌鳎AMH基因的克隆及表达分析[D].上海:上海海洋大学,2012.
LIU SH SH.Molecular cloning and expression analysis ofAMHgene fromCynoglossussemilaevisGunther[D].Shanghai:Shanghai Ocean University,2012.
[33] 蒋香菊,吴阳升,张 利,等.羔羊卵巢AMH的免疫组织化学分析[J].西北农业学报,2014,23(7):19-24.
JIANG X J,WU Y SH,ZHANG L,etal.Immunocy tochemical study of anti-Miillerianhormone in ovarian follicles from lambs[J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(7):19-24.
[34] 邓思平,陈松林.半滑舌鳎 Dmrt1α基因的cDNA克隆及其表达[J].中国水产科学,2008,15(4):577-584.
DENG S P,CHEN S L.Molecular cloning and expression of Dmrt1 α gene fromCynoglossussemilaevisGunther[J].JournalofFisherySciencesofChina,2008,15(4):577-584.
[35] 王晶晶,刘小林,秦 芳,等.稀有鮈鲫芳香化酶基因的表达及内分泌干扰物(EDCs)暴露对其表达的影响[J].西北农业学报,2011,20(1):35-39.
WANG J J,LIU X L,QIN F,etal.Expression of cytochrome P450 aromatase genes and effects of EDCs exposure on their expression in rare minnow(Gobiocyprisrarus)[J].ActaAgriculturaeBoreali-occidentalisSinica,2011,20(1):35-39.
[36] WANG D S,KOBAYASHI T,ZHOU L Y,etal. Foxl2 up-regulates aromatase gene transcription in a female-specific manner by binding to the promoter as well as interacting with ad4 binding protein/steroidogenic factor 1[J].MolecularEndocrinology,2007,21(3):712-725.
[37] MARINA S G,MALLE P,PAILHOUX E,etal.Isolation of chicken homolog of the FOXL2,gene and comparison of its expression patterns with those of aromatase during ovarian development [J].DevelopmentalDynamics,2004,231(4):859-870.
[38] 邬国民,练慧英.应用甲基睾丸素诱导莫桑非洲鲫雄性化的研究[J].遗 传,1979,1(6):36-39.
WU G M,LIAN H Y.Research on the application of methyl testosterone inducing mozambique’s African carp male-like[J].Hereditas,1979,1(6):36-39.
[39] 张甫英,胡 炜,汪亚平,等.应用雄性激素诱导异育银鲫性转化的研究[J].遗 传,2000,22(1):25-27.
ZHANG F Y,HU W,WANG Y P,etal.Methyltestosteroneinduction of sex reversal in allogynogenetic crucian carp[J].Hereditas,2000,22(1):25-27.
