短期玉米秸秆还田对冷凉地区土壤 真菌多样性的影响
2018-07-04萨如拉杨恒山高聚林张丽娟张玉芹范秀艳李纯燕
萨如拉,杨恒山,高聚林,张丽娟,张玉芹,范秀艳,李纯燕
(1.内蒙古民族大学农学院, 内蒙古 通辽 028000; 2.内蒙古农业大学职业技术学院, 内蒙古 包头 014199)
秸秆还田能提高土壤养分含量、调节土壤微生物群落结构和多样性,微生物多样性和群落结构在一定程度上反映农田生态系统基本情况。前人主要对森林[1-8]、退化草场[8-9]、荒漠草原[10-13]、保护地[14-17]、茶园[18]、果园[19-20]、旱田[21-24]、稻田[25-27]、药用植物根际[28-29]、花卉根际[30-31]、烟草[32]、生物土壤结皮[33]、露天矿区复垦[34]、重金属污染[35-37]和农药残留[38]等土壤真菌结构及多样性进行了研究,耕作方式有连作大豆[21]、黑土区玉米连作[23]、沟垄覆膜连作马铃薯[24]、稻田垄作免耕[25]、秸秆还田的稻田[27]和秸秆还田植烟田[32]等。研究方法为PCR-DGGE技术[2,9,17-18,32,34],微生物纯培养、镜检形态鉴定[13-16,22-23,25,28-30,38],构建真菌ITS克隆文库[4-5],构建真菌18SrDNA文库[11,33],结合Biolog微平板分析-变性梯度凝胶电泳(DGGE)方法[21]和真菌ITS序列高通量测序[1,3,6,24]等;多数研究者采用形态学鉴定和18S rDNA-PCR-DGGE分子鉴定法。前人对冷凉地区秸秆还田的连作玉米田真菌多样性研究较少,虽然18S rDNA-PCR-DGGE方法较纯培养方法有很大进步,但有局限性;DGGE仅反映有限优势微生物类群,在很大程度上极可能低估土壤微生物物种组成并高估其丰度;而高通量测序能较为全面和准确反映土壤微生物群落结构[39]。为探索冷凉地区秸秆还田土壤真菌多样性,于2014~2015年在冷凉地区设置秸秆粉碎深翻和旋耕还田试验,以常规耕作秸秆不还田为对照,运用高通量测序技术分析土壤真菌多样性,描述短期玉米秸秆还田对冷凉地区土壤真菌群落结构的影响。以期为正确评价冷凉地区秸秆还田生态效益提供理论依据。
1 材料与方法
1.1 供试材料
试验点地处西辽河平原(43°36′N、122°22′E),海拔178 m,年均气温6.8℃,年均降水量399.1 mm,无霜冻期150 d左右,≥10℃年活动积温3 200℃。试验于2014—2015年在内蒙古民族大学农场进行,供试土壤为灰色草甸土,耕层土壤有机质24.6 g·kg-1、全氮0.96 g·kg-1、碱解氮58.78 mg·kg-1、速效磷10.81 mg·kg-1、速效钾79.92 mg·kg-1,土壤pH值8.3。试验地为连作多年的玉米地。
1.2 试验设计
设3个处理,常规耕作秸秆不还田(CK)、秸秆深翻还田(SF)和秸秆旋耕还田(XG),春播前玉米秸秆全量粉碎还田,旋耕还田采用旋耕机实施,作业深度15 cm,深翻方式为人工深翻,深度30 cm。分0~10、10~20 cm和20~30 cm土层,9个样;标记为CK1、CK2、CK3、SF1、SF2、SF3、XG1、XG2和XG3。
1.3 土壤样品采集
春玉米吐丝期各处理分0~10、10~20、20~30 cm土层,“S”形15点混合取样,混合均匀后,按四分法取部分土样装入已经灭菌的无菌袋中。一部分鲜样进行土壤可培养真菌数量测定,一部分放入-70℃冷冻备用。
1.4 测定指标与方法
1.4.1 土壤真菌计数 采用稀释平板法,在改良马丁氏培养基上分离土壤真菌并计数,每克干土中真菌数量(CFU·g-1)=(同一稀释度样品菌落数×稀释倍数)/(1-土壤含水率);SPSS软件进行显著性分析。
1.4.2 高通量测序
(1)土壤微生物DNA提取 采用改良SDS高盐缓冲液抽提法。
(2)DNA测序与数据处理过滤 对真菌ITS1区进行测序,引物为ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′和ITS1M:5′-GCTGCGTTCTTCATCGATGC-3′;对原始数据进行拼接,将拼接得到的序列进行质量过滤,并去除嵌合体,得到高质量的Tags序列。
(3)微生物组成和丰度计测 在相似性97%水平上对序列进行聚类,以测序所有序列数的0.005%作为阈值过滤操纵分类单元(OTU)。物种注释RDP Classifier置信度阈值为 0.8;邻接法分析系统进化树。
(4)微生物多样性计算 采用Mothur version v.1.30分析alpha指数。
2 结果分析
2.1 真菌数量差异分析
由表1可知,吐丝期SF和XG均与CK有极显著差异,SF与XG间差异不显著。各土层中真菌数为SF>XG>CK。

表1 不同秸秆还田方式对耕层土壤 真菌数量的影响/(105·g-1)
注:数据后不同字母表示同土层不同处理的差异显著性(P<0.05)。
Note: Different letters indicate the significant difference between treatments of the same soil layer(P<0.05).
2.2 OTU分析
测序共获得1800630对Reads,双端Reads拼接、过滤后共产生1 681 670条Clean tags,获得1062个OTU。表2可知,OTU数随土层下移逐渐下降,CK1的OTU数最多,CK3的OTU数最少;同土层OTU为CK1>XG1>SF1,XG2>SF2>CK2,SF3>XG3>CK3;由图1可知,3个处理共有OTU为630,SF与XG共有OTU为761,SF与CK共有OTU为740,XG与CK共有OTU为703;CK特有OTU为52,SF特有OTU为27,XG特有OTU为39。

表2 样品OTU个数分布图
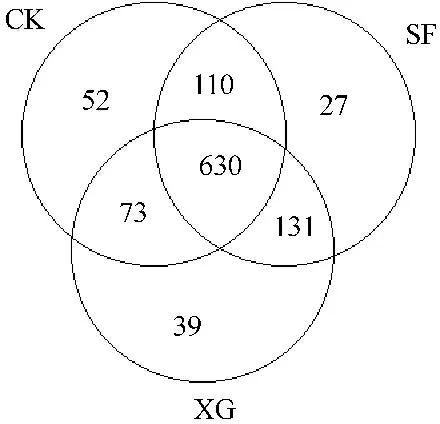
图1组间OTU Venn图
Fig.1 OTU Venn map of each group
2.3 土壤真菌种类分析
由图2可知,30%~70%为未知真菌;共属4门,17纲,36目,81属。在门分类水平上属6个类群,包括:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)和接合菌门(Zygomycota)。除XG2,子囊菌门为优势种群,其次为担子菌门;各处理优势种群所占比例不同,0~20 cm处差异不显著,CK3中子囊菌门相对丰度最高,XG2中担子菌门相对丰度最高。在属水平上,优势类群(相对丰度>1.0%)有14个,其中马拉色氏霉菌属(Malassezia)、被孢霉属(Mortierella)、葡萄孢属(Botrytis)、Pseudogymnoascus、隐球菌属(Cryptococcus)为各样品共有;Lachnella为CK1特有,曲霉属为CK3特有,Ophiosphaerella为秸秆还田深层土壤特有;金孢子菌属、Volvariella、Conocybe和青霉属存在于CK和秸秆还田深层土壤中;CK1和CK2中优势属有马拉色氏霉菌属、被孢霉属和葡萄孢属;而CK3中葡萄孢属为优势属;XG中被孢霉属相对丰度比CK高,但马拉色氏霉菌属丰度较低,葡萄孢属丰度更低;XG1和XG2中耐冷酵母是优势菌,其相对丰度比其它样品高;SF中葡萄孢属、Lachnella、曲霉属和角担菌属菌种均未出现;SF1优势菌属为被孢霉属和耐冷酵母属;SF2出现了Ophiosphaerella,其优势菌属为被孢霉属;SF3优势菌为葡萄孢属。真菌物种数为CK1>SF1>XG1,CK2>XG2>SF2,XG3>SF3>CK3;CK真菌种类数多,但类群丰度均不高。

注:Others为丰度低于1%的部分,Unknown为未得到分类学注释的OTU。
Note: Others were less than 1% of the abundance, Unknown were OTU that has not been annotated in taxonomy.
图2在门(A)及属(B)水平上土壤真菌种类和相对丰度
Fig.2 Soil fungal species and relative abundance at the level of the phylum (A) and the genus (B)
2.4 不同土层真菌分布
随土层下移子囊菌门相对丰度逐渐上升,接合菌门相对丰度在CK中逐渐上升,而SF中有下降趋势。随土层下移XG中马拉色氏霉菌属、葡萄孢属、Pseudogymnoascus和隐球菌属相对丰度逐渐上升;SF中马拉色氏霉菌属相对丰度变化不明显,而被孢霉属和耐冷酵母相对丰度逐渐下降,葡萄孢属和Conocybe相对丰度逐渐上升。真菌种类数为CK2>CK1>CK3,XG3>XG2>XG1,SF3>SF2>SF1;CK中随土层下移马拉色氏霉菌属相对丰度减少;由图3可知,马拉色氏霉菌属、被孢霉属、Lachnella、Pseudogymnoascus、Volvariella和耐冷酵母菌属与土壤深度呈负相关,葡萄孢属、金孢子菌属、隐球菌属、Conocybe、青霉属、曲霉属、角担菌属和Ophiosphaerella与土壤深度呈正相关;土壤深度对金孢子菌属、Lachnella、Ophiosphaerella和耐冷酵母菌属的影响程度较大。XG1与SF1、XG2与SF2之间距离较近,说明这两对样品微生物群落差异较小。
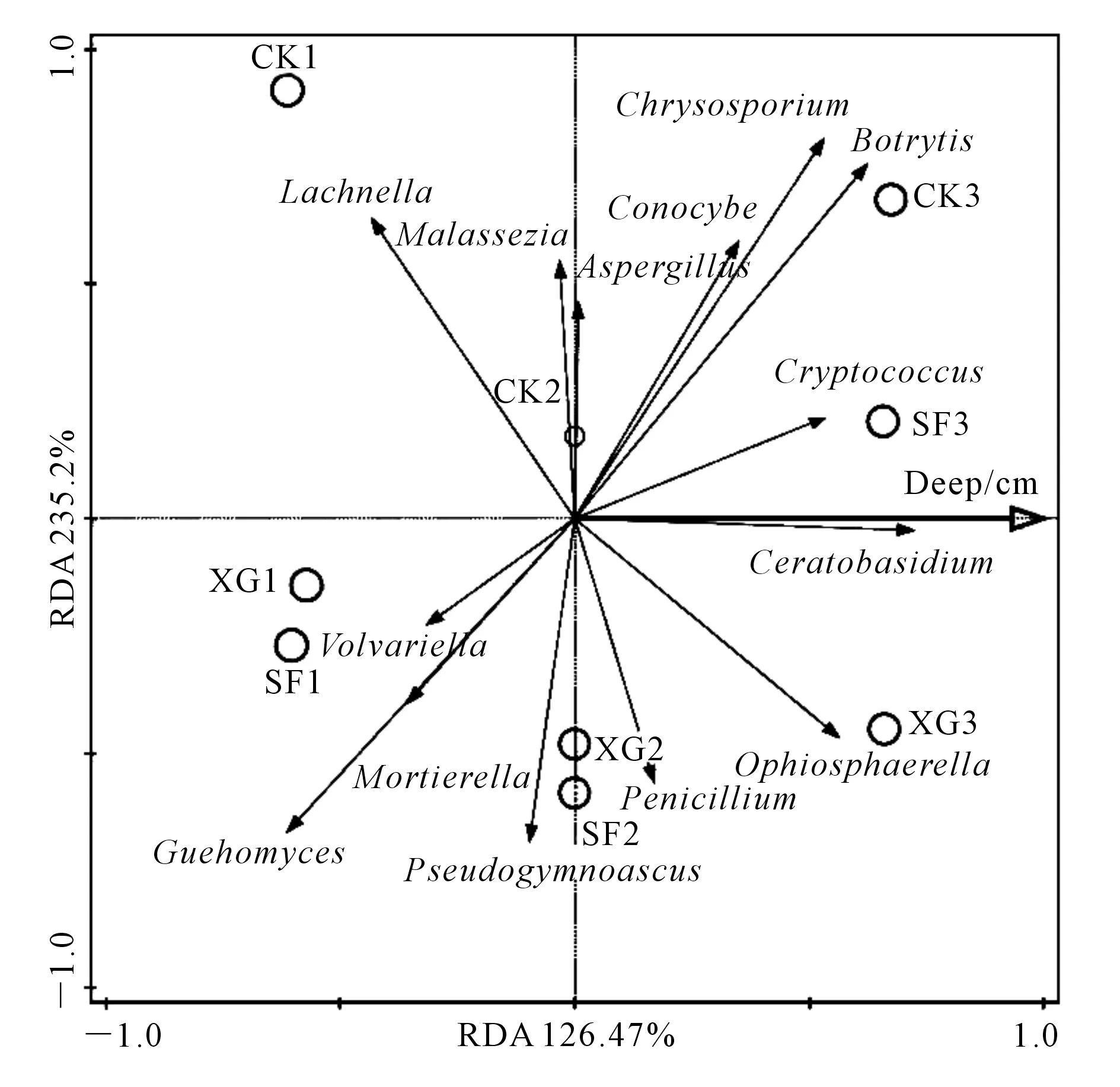
图3 属水平样品间物种多样性RDA分析Fig.3 RDA analysis of species diversity in the genus level
2.5 土壤真菌多样性分析
由表3可知,各处理真菌群落丰度及多样性存在差异,表征真菌丰富度的ChaoI指数和均匀度指数Ace为CK1>XG1>SF1,XG2>SF2>CK2,SF3>XG3>CK3;SF和XG 10~30 cm真菌优势类群丰度均增加,Shannon指数为CK1>SF1>XG1,CK2>SF2>XG2,XG3>CK3>SF3;秸秆还田后0~10 cm土层真菌群落丰富和多样性均降低。
2.6 土壤真菌相似性分析
由图4可知,各样品聚为2簇,CK2、SF3和CK3真菌群落相似性大,聚为一簇;SF1和XG1与CK1先聚为第一小簇,SF2与XG2聚为第二小簇,再与XG3聚为另一大簇。

表3 Alpha多样性指数统计
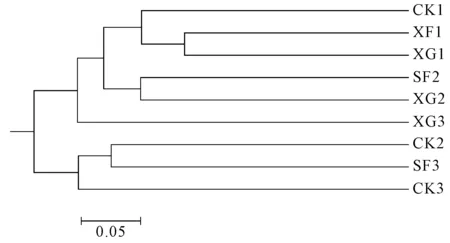
图4 样品UPGMA聚类树Fig.4 UPGMA cluster tree of samples
3 讨 论
真菌是有机物质分解和土壤生物量的主要组成部分,在农业生态系统中起着重要作用[24];其区系结构与多样性是表征土壤肥力和健康的重要指标。玉米秸秆还田改变环境因素,从而影响土壤真菌群落特性及生长。本研究中,秸秆旋耕和深翻还田均能增加土壤可培养真菌数量;秸秆还田对10~30 cm土壤的影响尤为显著,有可能是秸秆腐熟可降解成葡萄糖和木糖等,与拔节期追施的尿素共同有助于优势真菌群的增加[19]。郭梨锦等[27]研究表明,短期秸秆还田只提高表层土壤(0~5 cm)微生物群落的生物量,但不影响微生物群落结构和多样性,这与本研究结果不一致,这可能是研究对象和生态环境的不同导致。
4 结 论
冷凉地区玉米秸秆还田显著提高土壤可培养真菌数量。秸秆还田后土壤真菌优势菌属发生变化;秸秆深翻还田和旋耕还田0~20 cm土层真菌群落差异较小。秸秆深翻和旋耕还田均可增加10~30 cm土层真菌群落丰度。
参考文献:
[1] 冀锦华,王小兵,孟建宇,等.大兴安岭森林表层土壤真菌多样性的分析[J].北方农业学报,2016,44(3):5-10.
[2] 赵文静,赵宝军,崔岱宗,等.额尔古纳自然保护区6种林型土壤真菌群落结构的多样性[J].东北林业大学学报,2016,44(7):76-79.
[3] 王艳云,郭笃发.应用高通量测序技术研究柽柳、獐茅土壤真菌多样性[J].生物技术通报,2016,32(7):48-53.
[4] 谭 燕,何文高,米 瑶,等.运用ITS克隆文库解析桉树种植地土壤真菌群落多样性[J].西南师范大学学报(自然科学版),2013,38(9):68-73.
[5] 刘 敏,黄惠琴,徐友林,等.红树林生态系统中不同生境不同深度土壤的可培养真菌的多样性[J].微生物学通报,2014,41(10):1969-1975.
[6] 高微微,康 颖,卢 宏,等.城市森林不同林型下土壤基本理化特性及土壤真菌多样性[J].东北林业大学学报,2016,44(3):89-94,100.
[7] Heikki Setälä, Mary Ann McLean. Decomposition rate of organic substrates in relation to the species diversity of soil saprophytic fungi[J]. Occologia, 2004,139(1):98-107.
[8] 夏围围,贾仲君.高通量测序和DGGE分析土壤微生物群落的技术评价[J].微生物学报,2014,54(12):1489-1499.
[9] 寇书萌.呼伦贝尔退化草场土壤AM真菌多样性及微生物改良的研究[D].上海:上海师范大学,2016.
[10] 李 玲.北方主要草地类型中土壤真菌多样性及群落结构的比较研究[D].长春:东北师范大学,2015.
[11] 刘 丽,贾美清,刘成宝,等.气候变干变暖对内蒙古荒漠草原土壤可培养真菌的组成及多样性的影响[J].宁夏农林科技,2014,55(1):37-39.
[12] 苟燕妮.放牧绵羊对陇东草原土壤细菌和真菌群落结构及多样性的影响[D].兰州:兰州大学,2015.
[13] 蔡晓布,彭岳林,盖京苹,等.藏北高寒草原土壤活性有机碳对AM真菌物种多样性的影响[J].农业工程学报,2011,28(增刊1):216-223.
[14] 潘 静,高晓敏,郝 静,等.大棚土壤真菌物种多样性[J].内蒙古农业大学学报(自然科学版),2015,36(5):27-34.
[15] 吕国忠,孙晓东,李 贺.东北地区保护地土壤真菌多样性的研究[J].大连民族学院学报,2006,(1):6-8.
[16] 胡 兰,杨 威,徐 婧,等.棉隆与生化黄腐酸对设施土壤真菌多样性的影响[J].沈阳农业大学学报,2014,45(2):217-220.
[17] 杨 昊,Pablo Gonzalez Perez,张 瑞,等.碳氮有机物料对有机菜田土壤真菌多样性影响的模拟试验[J].上海交通大学学报(农业科学版),2015,33(4):1-10.
[18] 袁赛艳,陈 暄,房婉萍,等.茶树修剪物对茶园土壤真菌群落多样性影响研究[J].茶叶科学,2015,35(3):255-262.
[19] 程存刚,赵德英,吕德国,等.植物源有机物料对果园土壤微生物群落多样性的影响[J].植物营养与肥料学报,2014,20(4):913-922.
[20] Alguacil Maria del Mar, Torrecillas Emma, Torres Pilar, et al. Long-term effects of irrigation with waste water on soil AM fungi diversity and microbial activities: the implications for agro-ecosystem resilience[J]. Plos One, 2012,7(10):1-7.
[21] 宋 洁.连作土壤寄生真菌多样性及对大豆胞囊线虫抑制作用[D].哈尔滨:东北农业大学,2016.
[22] 盖京苹,冯 固,李晓林.我国北方农田土壤中AM真菌的多样性[J].生物多样性,2004,12(4):435-440.
[23] 刘淑霞,周 平,赵兰坡,等.吉林黑土区玉米田土壤真菌的多样性[J].东北林业大学学报,2008,36(7):42-46.
[24] 徐雪雪,王 东,秦舒浩,等.沟垄覆膜连作马铃薯根际土壤真菌多样性分析[J].水土保持学报,2015,29(6):301-305.
[25] 胡 宇,蒋先军,田 波,等.稻田垄作免耕对土壤真菌多样性分布的影响[J].土壤,2007,39(6):964-967.

[27] 郭梨锦,曹凑贵,张枝盛,等.耕作方式和秸秆还田对稻田表层土壤微生物群落结构和多样性的短期影响[J].农业环境科学学报,2013,32(8):1577-1584.
[28] 邵 璐.辽宁碱蓬根际土壤真菌多样性及其病原拮抗菌的筛选[D].大连:辽宁师范大学,2015.
[29] 慕东艳,吕国忠,孙晓东,等.黑龙江省药用植物根际土壤真菌多样性[J].生态学报,2013,33(1):229-237.
[30] 杨 红,姜慧明,吕国忠,等.辽宁地区花卉根际土壤真菌种群多样性研究[J].沈阳农业大学学报,2014,45(5):625-628.
[31] 常瑞恒,皇甫超河,杨殿林,等.生物替代对黄顶菊根际土壤真菌群落多样性的影响[J].中国农学通报,2011,27(33):60-66.
[32] 李小林,李昕竺,袁红梅,等.烟草土壤真菌群落结构和多样性及环境因子对其影响[J].四川师范大学学报(自然科学版),2015,38(1):134-141.
[33] 赵宇龙,张晓军,金一荻,等.毛乌素沙漠生物土壤结皮真菌群落多样性分析[J].内蒙古农业大学学报,2011,32(2):170-174.
[34] 陈来红,董红丽,马万里,等.准格尔露天矿区复垦过程中土壤真菌多样性及其变化研究[J].广东农业科学,2011,(12):5-8.
[36] Zarei Mehdi, Hempel Stefan, Wubet Tesfaye, et al. Molecular diversity of arbuscular mycorrhizal fungi in relation to soil chemical properties and heavy metal contamination[J]. Environmental Pollution, 2010,158(8):2757-2765.
[37] Montiel-Rozas María Del Mar, López-Garcíalvaro, Kjφller Rasmus, et al. Organic amendments increase phylogenetic diversity of arbuscular mycorrhizal fungi in acid soil contaminated by trace elements[J]. Mycorrhiza, 2016,26(6):575-585.
[38] 许秀强,李 敏,刘润进.农药污染土壤中AM真菌多样性初步调查[J].青岛农业大学学报(自然科学版),2009,26(1):1-3.
[39] 夏围围,贾仲君.高通量测序和DGGE分析土壤微生物群落的技术评价[J].微生物学报,2014,54(12):1489-1499.
[40] 夏 强,秦 冰,王雅楠,等.麦玉秸秆还田对土壤真菌群落结构的影响[C]//中国土壤学会.面向未来的土壤科学(中册)-中国土壤学会第十二次全国会员代表大会暨第九届海峡两岸土壤肥料学术交流研讨会论文集,2012:865-872.
