ICH-FOS量表评估脑出血预后的临床研究
2018-07-04曹谡涵于若梅毛保义陶梦醒孙晓培
曹谡涵, 陈 佳, 郭 岩, 于若梅, 毛保义, 杨 西, 陶梦醒, 孙晓培
自发性脑出血(intracerebral hemorrhage,ICH)是导致死亡和残疾的主要疾病之一[1],在我国,占所有脑卒中的20%,高于西方国家[2],是导致死亡和残疾的主要疾病之一。它的年发生率为24.6人/10万人,30 d死亡率高达40%,研究显示[3]ICH患者1 y的生存率为46%,5 y生存率为29.2%,致死率极高。近年来,先后出现了10余种脑出血分级量表来对ICH患者的预后进行评估。它们制定的目的是用来预测ICH的短期病死率(30 d)或长期功能转归(3 m、6 m、或者1 y)。2001年Hemphill[4]首先提出oICH量表,其在预测脑出血发病30 d的死亡率的准确性已经得到广泛认可,但其预测功能预后的准确性欠佳。2013年,Ji R等[5]基于中国国家卒中登记数据库,建立了一个脑出血长期预测量表,即ICH-FOS。该量表在脑出血预测短期、中期及长期预后中较其他量表均显示出其优越性。但目前对于ICH-FOS的国内外验证少,本文将对FOS-ICH量表进行研究,探讨ICH-FOS量表在预测30 d死亡率及3个月功能预后方面的精确性,并与oICH量表进行比较。
1 资料与方法
1.1 研究对象 2015年1月1日-2015年12月30日期间收住于大连医科大学第一医院神内重症病房ICH患者,共130例,其中男性患者77例,女性患者53例。
入选标准:(1)年龄>18周岁;(2)入院时间在发病24 h内,且头部CT符合1995年全国第四次脑血管病学术会议关于脑出血的诊断标准;(3)均于发病24 h内行头部CT检查;(4)患者来源为急诊直接收入院或者由外院转入。排除标准:(1)原发性脑室出血;(2)颅内肿瘤出血;(3)梗死后出血;(4)既往有脑卒中病史导致生活依赖(mRS≥3分);(5)合并严重的肝脏、肾脏、心血管系统、呼吸系统、血液系统等疾病或合并任何部位的恶性肿瘤晚期;(6)住院期间行微创或外科手术治疗;(7)住院期间自行放弃治疗离院;(8)发病24 h内的头部CT影像学资料缺失;(9)不能配合随访或3个月随访失访。
1.2 研究方法 所有统计资料均在ICH患者入院时根据ICH-FOS量表及oICH量表赋分项进行采集并记录,包括了年龄、NIHSS评分、GCS评分、血糖、根据入院时的头部CT扫描确定血肿体积(采用ABC/2方法计算[6])、出血部位(幕上或幕下)、出血是否破入脑室;并对患者入院时分别进行oICH量表及ICH-FOS量表评分。采用mRS评分作为预后评价的指标,对患者家属进行随访,分别对ICH患者出血后30 d的生存情况、3个月的功能转归情况进行了解并记录,同时对3个月的功能转归情况进行mRS评分(mRS评分≥3分表示功能转归不良)。
1.3 统计学方法 所有统计数据均使用SPSS 19.0进行分析,根据患者入院时oICH量表及ICH-FOS量表的评分结果,分别以30 d死亡、3个月功能转归不良为状态变量,两个量表评分为检验变量,绘制30 d死亡的受试者工作特征(Receiver operating characteristic,ROC)曲线和3个月功能转归不良的ROC曲线,分别得出曲线下面积(area under the receiver operating characteristic curve,AuROC)、最大尤登指数(Youden Index)、最佳诊断点、敏感性、特异性、阳性预测值、阴性预测值。对两个量表在评价ICH患者30 d死亡结局和3个月功能转归不良的精确性方面进行比较。
2 结 果
2.1 一般特征 根据入选标准,共收集病例130人,最终参与研究121人,9人因失访被排除。30 d死亡率为32%(n=39),3个月功能转归不良比例为55%(n=67)。
2.2 ICH-FOS量表评分与30 d死亡率的关系 通过对本次研究中ICH患者的30 d生存情况(存活或者死亡)进行随访,得出其30 d的死亡率为32%(n=39)。然后,根据ICH患者入院时进行的ICH-FOS量表评分结果,得出了在不同分值的30 d死亡率,其中入院ICH-FOS量表评分为0~2分、3分、4分、5分、6分、7分、8分、9分、10分、11~15分对应的死亡率分别为0%、16.7%、28.6%、33.3%、42.9%、55.6%、70%、85.7%、88.9%、100%。总体趋势(见图1)所示,入院ICH-FOS量表评分越高,30 d死亡率越高。
2.3 ICH-FOS量表评分与3个月功能转归不良的关系 本研究通过随访得出ICH患者的3个月功能转归不良比例为55%(n=67),其中入院ICH-FOS量表评分为1分、2分、3分、4分、5分、6分、7分、8分、9分、10分、11分的患者;对应的3个月功能转归不良的比例分别为9.1%、14.3%、27.3%、28.6%、38.9%、50%、60%、77.8%、83.3%、90%。评分为12分以上时,ICH患者3个月功能转归均不良,存在中度-重度的残疾,即mRS≥3分。与评价30 d死亡率的趋势相同,入院ICH-FOS量表评分越高,3个月功能转归不良比例越大(见图2)。
2.4 ICH-FOS量表与oICH量表在评价30 d死亡结局方面的精确性比较 根据两个量表在预测30 d死亡结局方面的ROC曲线结果所示(见表1),其AuROC及95%可信区间分别为:oICH量表(0.911,0.850~0.972)、ICH-FOS量表(0.948,0.904~0.991)。ICH-FOS量表的AuROC值更大,表明其评价30 d死亡结局的精确性更好,且ICH-FOS量表的尤登指数最大(该指数最大时敏感度和特异度之和最大,且诊断界点为最佳),为0.773,最佳诊断界点是8分。
2.5 ICH-FOS量表与oICH量表在预测3个月功能转归不良方面的精确性比较 根据两个量表在预测3个月功能转归不良方面的ROC曲线结果所示(见表2),ICH量表的AuROC及95%可信区间分别为oICH量表 (0.822,0.749~0.895)、ICH-FOS量表(0.841,0.772~0.991)。同样,ICH-FOS量表的AuROC值更大,表明其预测3个月功能转归不良方面精确性更好。此外,评价3个月功能转归不良时,仍然是ICH-FOS量表的尤登指数大,为0.586,最佳诊断界点是7分。

表1 30 d死亡结局的曲线下面积,最大尤登指数时的敏感性、特异性、最佳诊断值、阳性预测值、阴性预测值

表2 3 m功能转归不良的曲线下面积,最大尤登指数时的敏感性、特异性、最佳诊断值、阳性预测值、阴性预测值
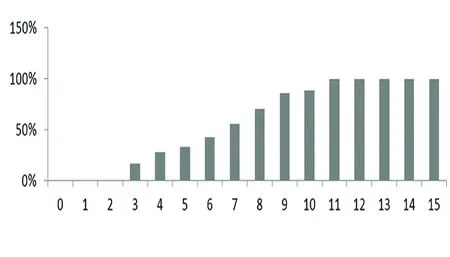
图1 ICH-FOS量表中各项分值的30 d死亡率
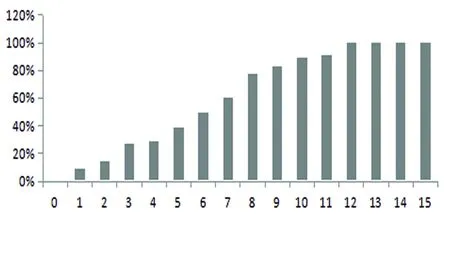
图2 ICH-FOS量表各项分值对应的3个月功能转归不良比例(mRS≥3分)
3 讨 论
自2001年Hemphill提出oICH量表以来,先后出现了10余种脑出血分级量表。目前,大多数ICH量表的研究人群主要来自西方国家的ICH患者,由于亚洲国家与西方国家的ICH患病特点不同,以往量表的适用范围可能会受到限制。有研究者[5,7,8]对现有部分量表在评价ICH预后方面的精确度进行了对比研究,目前仍没有哪一个量表被公认为最佳而广泛应用于临床。因此,Ji等人[5]于2013年制定了ICH-FOS量表,用于评估脑出血患者12个月的功能预后。该研究样本全部来自于中国卒中注册中心(China National Stroke Registry,CNSR),并将ICH-FOS量表与现有的ICH量表(包括oICH量表)均进行了比较,作者认为:无论是评价短期死亡率(30 d)还是长期的功能结局(3 m,6 m,1 y),ICH-FOS量表均更为优越。
本研究发现随着ICH-FOS评分的增大,患者30 d死亡率及3个月不良功能预后比例均逐渐增加,且具有很好的相关性,说明ICH-FOS量表除了可以预测不良预后,还可以很好的预测30 d死亡率。Jarno Satopaa等[9]对目前存在的包括ICH-FOS量表在内的19种评价脑出血预后的量表进行分析,实验共纳入882例患者,并对其住院期间、发病3个月及12个月的死亡率进行分析,结果显示ICH-FOS量表在预测脑出血患者住院期间、发病3个月及12个月的死亡率时均体现出良好的精确性。Ji等人的研究结果也表明[5]:ICH-FOS量表能很好地评价脑出血患者30 d死亡率及3个月不良转归比例。这与我们的研究结果一致。在现有的脑出血预后评估量表中,绝大部分是单纯评价死亡率或单纯评价功能预后的,临床上希望有一种量表能够很好的同时兼顾这两项功能,目前看来,ICH-FOS量表是最好的选择,我们的研究也证明了这一点。FOS量表虽然是为了评价功能预后而设计,但它吸收了以往量表的经验,选取的预测因子更为全面及有效,涵盖了与死亡及功能不良的大部分相关因素,因此,可以较好的同时预测这两方面内容。
同时,我们还将FOS量表和oICH量表进行了比较,发现在评价30 d死亡率的ROC曲线中,oICH量表、ICH-FOS量表的AuROC值分别为:0.911、0.94;评价3个月功能转归不良的ROC曲线中,oICH量表、ICH-FOS量表的AuROC值分别为:0.822、0.841。因此,笔者认为,FOS量表在评价ICH患者30 d死亡率和3个月功能转归不良方面均好于oICH量表,这与其他研究结论一致[5,9]。
ICH-FOS量表的原始设计目的是用来评价脑出血患者1 y的功能预后情况,而oICH量表主要是为了预测脑出血患者30 d的死亡率。我们的研究结果显示,ICH-FOS量表无论是预测在30 d死亡率还是3个月不良功能预后评估方面均好于oICH。原因可能有以下几方面:首先,ICH-FOS量表纳入的因素更加全面广泛,如加入了入院血糖[10]、血肿体积[11,12]等可以影响脑出血预后但又被其他量表忽视的指标;其次,ICH-FOS量表除了包括GCS评分外,还增加了NIHSS评分。Bruce[7]研究发现GCS评分与住院死亡率及3个月死亡率密切相关,NIHSS评分与3个月不良功能预后密切相关。而ICH-FOS量表正因为同时包含这两种评分,从而可以较好的同时评估脑出血患者的死亡率及功能预后。此外,NIHSS评分的纳入使得ICH-FOS量表具备了一定的优势,不仅评价时间点从30 d,3个月扩展到12个月,也提高了对短期死亡率和功能转归评价的精确度。再者,制定ICH-FOS量表的相关研究所纳入的样本量大(3255人),远大于oICH量表(152人)。从统计学角度看,样本量越大,研究结果越稳定;从临床研究角度来说,较大的样本量更能准确集中的体现ICH的发病特点,减少因ICH患者病程中的个体化差异带来的误差。
但是,Ji等人[5]的研究结果显示,ICH-FOS量表在评价3个月死亡率、6个月转归不良、6个月死亡率及1 y转归不良、1 y死亡率时具有明显优势,而在预测30 d死亡率及3个月转归不良比例时虽优于其他量表,但相差不大。Jarno Satopaa[9]也得出ICH-FOS量表在预测3个月及12个月死亡率时较其他量表优势更为明显。本研究因受随访时间限制,对患者只进行了3个月的跟踪随访,主要研究ICH-FOS量表在评价脑出血患者30 d死亡率及3个月不良转归比例方面的精确性,而ICH-FOS量表制定时旨在评价1 y的功能转归,未能完全体现出该量表对长期功能转归的优势。这一点还有待进一步随访完善。
脑出血的预后与多个因素相关,ICH-FOS量表虽然已经有较高的精确度,对影响功能转归的预测因子的纳入也是基于比较常见的和公认的因素,如年龄、血肿体积、血糖等。但是仍然有许多与ICH临床转归相关的因素存在争议。糖化血红蛋白被认为是影响脑出血预后的独立危险因素,在预测脑出血预后时比血糖更准确[13]。入院时C反应蛋白升高也是影响不良预后的独立危险因素[14];入院时中性粒细胞与淋巴细胞比率(NLR)比率越高,30 d ICH死亡率越大[15],因此,随着我们对脑出血的临床认识进一步加深及实验室研究的进步,在脑出血量表的相关危险因素中,有待纳入更多新出现的预测因子,以期能对现有量表不断完善,使得脑出血的临床预测更加准确及统一。同时,ICH-FOS量表的创建基于中国人群,其临床验证还不多,还需要在不同国家、不同种族患者群体中进一步验证。
[参考文献]
[1]Qureshi AI,Mendelow AD,Hanley DF,et al.Intracerebral haemorrhage[J].Lancet,2009,373(9675):1632-1644.
[2]Liu M,Wu B,Wang WZ,et al.Stroke in China:epidemiology,prevention,and management strategies[J].The Lancet Neurology,2007,6(5):456-464.
[3]Zhao D,Liu J,Wang W,et al.Epidemiological transition of stroke in China:twenty-one-year observational study from the Sino-MONICA-Beijing Project[J].Stroke,2008,39(6):1668-1674.
[4]Hemphill JC,Bonovich DC,Besmertis L,et al.The ICH score: a simple,reliable grading scale for intracerebral hemorrhage[J].Stroke,2001,32(4):891-897.
[5]Ji R,Shen H,Pan Y,et al.A novel risk score to predict 1-year functional outcome after intracerebral hemorrhage and comparison with existing scores[J].Critical Care,2013,17(6):R275.
[6]Kothari RU,Brott T,Broderick JP,et al.The ABCs of measuring intracerebral hemorrhage volumes[J].Stroke,1996,27(8):1304-1305.
[7]Bruce SS,Appelboom G,Piazza M,et al.A comparative evaluation of existing grading scales in intracerebral hemorrhage[J].Neurocritical Care,2011,15(3):498-505.
[8]Ruiz-Sandoval JL,Chiquete E,Romero-Vargas S,et al.Grading scale for prediction of outcome in primary intracerebral hemorrhages[J].Stroke,2007,38(5):1641-1644.
[9]Satopaa JMS,Meretoja A.Comparison of all 19 published prognostic scores for intracerebral hemorrhage[J].Journal of the Neurological Sciences,2017,379:103-108.
[10]Koga M,Yamagami H,Okuda S,et al.Blood glucose levels during the initial 72 h and 3 month functional outcomes in acute intracerebral hemorrhage:the SAMURAI-ICH study[J].J Neurol Sci,2015,350(1/2):75-78.
[11]Togha M,Bakhtavar K.Factors associated with in-hospital mortality following intracerebral hemorrhage:a three-year study in Tehran,Iran[J].BMC Neurology,2004,4:9.
[12]Salihovic D,Smajlovic D,Ibrahimagic OC,et al.Does the volume and localization of intracerebral hematoma affect short-term prognosis of patients with intracerebral hemorrhage[J].ISRN Neuroscience,2013,2013:327968.
[13]张广慧,何明利,徐 艳,等.糖化血红蛋白与脑出血患者预后的关系[J].中华神经医学杂志,2015,10:1018-1022.
[14]Di Napoli M,Parry-Jones AR,Smith CJ,et al.C-reactive protein predicts hematoma growth in intracerebral hemorrhage[J].Stroke,2014,45(1):59-65.
[15]Wang F,Hu S,Ding Y,et al.Neutrophil-to-lymphocyte ratio and 30-day mortality in patients with acute intracerebral hemorrhage[J].Journal of Stroke and Cerebrovascular Diseases:the Official Journal of National Stroke Association,2016,25(1):182-187.
