湖泊水体营养状态对沉积物好氧氨氧化菌异质性的影响
2018-07-02胡志新杨柳燕
孙 旭,胡志新,杨柳燕
(1.南京大学环境学院,江苏 南京 210023; 2.污染控制与资源化国家重点实验室,江苏 南京 210023;3.环境保护部南京环境科学研究所,江苏 南京 210042; 4.南京工程学院环境工程学院,江苏 南京 211167)
与反硝化耦合的硝化作用在湖泊氮循环中起着重要作用。氨氧化过程是硝化过程的限速步骤,氨氧化细菌(ammonia-oxidizing bacteria,AOB)是氨氧化过程的驱动者,但是随着对氨单加氧酶α亚基基因作为分子生物标记物研究的深入,发现在好氧氨氧化过程中还存在另一类原核微生物——氨氧化古菌(ammonia-oxidizing archaea, AOA)[1-2]。研究表明,在土壤、河口、海洋、淡水沉积物中均发现AOA的踪迹,且数量远超过AOB。在寡营养和极端环境中,AOA是好氧氨氧化过程的主要驱动者[3-4]。
AOA和AOB在不同生境的分化除了自身进化的差异外,环境因子如氨浓度、DO、pH等也是其分布的主要调控因素[5-7],另外,湖泊水体的营养状况也是影响沉积物氨氧化微生物分布和功能的一个潜在因素。研究表明,随着湖泊富营养化程度的加重,沉积物中AOA和AOB的多样性增加,且富营养状态湖泊沉积物中AOB的丰度和多样性都远远高于贫营养状态湖泊[8-11],但是也有研究表明,不同湖区沉积物中氨氧化微生物的丰度和多样性与湖泊营养状态无关[12-13]。本课题组前期研究发现,不同生态类型湖泊沉积物中AOA和AOB群落组成并无显著差异,而沉积物中有机质含量是影响AOA和AOB异质性分布的主要因子[14-15],湖泊生态类型与富营养化程度有时会存在不一致的现象,因此湖泊富营养化状态与湖泊沉积物好氧氨氧化菌组成的关系还存在争议[12,16]。鉴于湖泊生态系统的复杂性以及营养状态划定的差异,有必要对不同营养状况下好氧氨氧化菌的异质性进行深入研究。
本研究以江苏省7个湖泊为研究对象,利用分子生物学的方法,对不同营养状态湖泊沉积物中氨氧化菌的群落结构进行分析,目的在于了解不同营养状况下湖泊沉积物氨氧化菌的群落特征,同时探索其潜在的调控因子,为富营养化湖泊氮素控制提供理论依据。
1 材料与方法
1.1 研究区概况
以江苏省洪泽湖(HZ)、白马湖(BM)、高邮湖(GY)、玄武湖(XW)、石臼湖(SJ)、固城湖(GC)和太湖(T)7个湖泊为研究对象,具体采样点位置见图1。于2012年4月,用采水器采集距水面0.5 m处的上覆水,低温保存在1 L的聚乙烯瓶内,带回实验室立即测定叶绿素a(Chl-a)及其他常规理化指标。采用彼得森采集器采集湖泊沉积物样品,取表层5 cm样品混匀后放入无菌的聚乙烯自封袋,低温保存运回实验室,保存在-80℃低温冰箱中备用。

图1 湖泊采样点位置
1.2 水质常规理化指标分析

1.3 沉积物AOA和AOB丰度及群落结构分析
按照土壤DNA试剂盒(MoBio Laboratories, Carlsbad, USA)的操作说明提取沉积物基因组DNA,用50 μL无菌水洗脱后,用0.8%琼脂糖凝胶电泳验证及230、260、280 nm吸光值测定检验提取效率和纯度,用NanoDrop®2000分光光度计(NanoDrop Technologies Inc, Wilmington, DE) 测定待测DNA样品的浓度。采用引物AF/AR和1F/2R分别扩增AOA和AOB的amoA基因,其拷贝数采用荧光定量PCR方法(Bio-Rad CFX96 real-time System)进行分析,使用一系列10倍稀释的质粒制备标准曲线,AOA的amoA基因拷贝数从1.0×101μL-1到1.0 ×106μL-1,扩增效率为91.8%(R2=1.00);AOB的amoA基因拷贝数在1.0×102μL-1到1.0×107μL-1之间,扩增效率为90.2% (R2=0.99)。Ct值(threshold cycle)和数据分析通过iCycler software (version 1.0.1384.0 CR)完成[19]。采用CEQ 8000 Genetic Analyzer (Beckman CEQ8000)遗传分析仪分别用限制性内切酶MspⅠ和Hpy8Ⅰ对AOB和AOA的amoA基因进行限制性片段长度多态性(terminal restriction fragment length polymorphism,T-RFLP)分析[15]。
1.4 数据分析
湖泊营养状态采用综合营养状态指数(trophic status index, ITSI)法进行评价,评价指标参数包括Chl-a、TN、TP、CODMn和透明度共5项[20]。
以T-RFLP图谱中每一个限制性片段(T-RF)为一个可操作分类单元(operational taxonomic unit,OTU),OTU丰度按照Saikaly的方法计算,即以相对峰高值(每个T-RF的峰高除以累计峰高值,舍去小于2%的值)作为OTU丰度,峰高值低于200荧光单位的峰不予考虑。根据图谱中OTU的数目及其丰度用BIODAP程序进行Shannon-Wiener多样性指数计算。
采用SPSS 18.0软件进行数据方差和相关性分析,采用Canoco 4.5软件分析AOA和AOB的T-RFLP指纹图谱,确定其群落结构,所有的环境因子和每个T-RF的相对峰值都进行lg(x+1)转化,分别构成环境矩阵和物种矩阵,进行典范对应分析(canonical correspondence analysis, CCA)。
2 结果与分析
2.1 湖泊富营养化状态
如图2所示,根据水体综合营养状态指数ITSI,7个湖泊共计23个研究湖区的营养状态可分为两个等级,14个湖区处于中营养状态(30 图 2 不同湖泊不同湖区水体综合营养状态指数 采用荧光定量PCR方法分析湖泊沉积物AOA和AOB的丰度,结果见图3。随着湖泊营养状态的提升,沉积物AOA和AOB的丰度也有所增加,每克底泥AOA的amoA基因拷贝数从中营养状态的3.91×106增加到轻度富营养状态的1.30×107(P=0.06,T-test),AOB的amoA基因拷贝数从3.82×106增加到6.07×106(P=0.372,T-test)。同一营养化状态的湖泊沉积物AOA的丰度高于AOB的丰度,但二者之间并无显著差异。 图3 不同营养状态湖区AOA和AOB丰度箱线图(相同字母表示P>0.05) (a) AOA(b) AOB图4 湖泊沉积物中AOA和AOB amoA基因的T-RFLP指纹图谱 如图4所示,湖泊水体营养状态对AOA和AOB的优势种属并未产生影响。用限制性内切酶MspⅠ酶切得到AOA 6个主要片段T-RF56、T-RF74、T-RF90、T-RF94、T-RF99、T-RF434,优势片段T-RF 56和T-RF 74在中营养和轻度富营养湖泊沉积物均有检出;而片段T-RF90、T-RF94和T-RF99主要出现在中营养湖泊沉积物中,T-RF434出现在轻度富营养湖泊沉积物中。用限制性内切酶Hpy8Ⅰ酶切得到AOB 2个较高相对丰度的片段(T-RF60和T-RF155),其在不同营养状态湖泊沉积物均有检出;其他片段仅出现在1~3个湖区。 不同湖泊湖区沉积物中AOA和AOB群落多样性变化情况见图5。从图5可以看出,AOA群落Shannon-Wiener指数从中营养化湖泊的1.57下降到轻度富营养湖泊的1.39,AOB群落Shannon-Wiener指数从0.28上升到0.32,但是,湖泊水体营养状态对沉积物好氧氨氧化微生物群落多样性影响无显著性差异,然而在同一营养状态下,沉积物中AOA群落的多样性显著高于AOB群落。 图5 不同营养状态湖区沉积物AOA和AOB群落Shannon-Wiener指数箱线图 表1 AOA和AOB丰度和多样性与上覆水水质的相关性分析结果 注: *表示P<0.05;**表示P<0.01。 (a) AOA (b) AOB图6 湖泊上覆水理化性质与沉积物氨氧化菌的CCA分析 参考文献: [1]HERRMANN M,SCHEIBE A,AVRAHAMI S,et al.Ammonium availability affects the ratio of ammonia-oxidizing bacteria to ammonia-oxidizing archaea in simulated creek ecosystems[J].Applied and Environmental Microbiology,2011,77(5):1896-1899. [2]LIMPIYAKORN T,FURHACKER M,HABERL R,et al.amoA-encoding archaea in wastewater treatment plants:a review[J].Applied Microbiology and Biotechnology,2013,97(4):1425-1439. [3]CAO H L,LI M,HONG Y G,et al.Diversity and abundance of ammonia-oxidizing archaea and bacteria in polluted mangrove sediment[J].Systematic and Applied Microbiology,2011,34(7):513-523. [4]CEBRON A,BERTHE T,GARNIER J.Nitrification and nitrifying bacteria in the lower Seine River and estuary (France)[J].Applied and Environmental Microbiology,2003,69(12):7091-7100. [5]WESSEN E,SODERSTROM M,STENBERG M,et al.Spatial distribution of ammonia-oxidizing bacteria and archaea across a 44-hectare farm related to ecosystem functioning[J].International Society for Microbial Ecology,2011,5(7):1213-1225. [6]SZUKICS U,HACKL E,ZECHMEISTER-BOLTENSTERN S,et al.Rapid and dissimilar response of ammonia oxidizing archaea and bacteria to nitrogen and water amendment in two temperate forest soils[J].Microbiological Research,2012,167(2):103-109. [7]REED D W,SMITH J M,FRANCIS C A,et al.Responses of ammonia-oxidizing bacterial and archaeal populations to organic nitrogen amendments in low-nutrient groundwater[J].Applied and Environmental Microbiology,2010,76(8):2517-2523. [8]CHEN G Y,QIU S L,ZHOU Y Y.Diversity and abundance of ammonia-oxidizing bacteria in eutrophic and oligotrophic basins of a shallow Chinese lake (Lake Donghu)[J].Research in Microbiology,2009,160:173-178. [9]HERRMANN M,SAUNDERS A M,SCHRAMM A.Effect of lake trophic status and rooted macrophytes on community composition and abundance of ammonia-oxidizing prokaryotes in freshwater sediments[J].Applied and Environmental Microbiology,2009,75(10):3127-3136. [10]HUGONI M,ETIEN S,BOURGES A,et al.Dynamics of ammonia-oxidizing archaea and bacteria in contrasted freshwater ecosystems[J].Research in Microbiology,2013,164 (4):1-11. [11]HOU J,SONG C L,CAO X Y,et al.Shifts between ammonia-oxidizing bacteria and archaea in relation to nitrification potential across trophic gradients in two large Chinese lakes (Lake Taihu and Lake Chaohu)[J].Water Research,2013,47(7):2285-2296. [12]WU Y C,XIANF Y,WANG J J,et al.Heterogeneity of archaeal and bacterial ammonia-oxidizing communities in Lake Taihu,China[J].Environmental Microbiology Reports,2010,2(4):569-576. [13]AUGUET J C,CASAMAYOR E O.Partitioning of thaumarchaeota populations along environmental gradients in high mountain lakes[J].FEMS Microbiology Ecology,2013,84(1):154-164. [14]杨柳燕,王楚楚,孙旭,等.淡水湖泊微生物硝化反硝化过程与影响因素研究[J].水资源保护,2016,32 (1):12-22.(YANG Liuyan,WANG Chuchu,SUN Xu,et al.Study on microbial nitrification and denitrification processes and influence factors in freshwater lakes[J].Water Resources Protection,2016,32 (1):12-22.(in Chinese)) [15]SUN X,WANG A L,YANG L Y,et al.Spatial distribution of ammonia-oxidizing archaea and bacteria across eight freshwater lakes in sediments from Jiangsu of China[J].Journal of limnology,2014,173(2):312-324. [16]DAI J Y,GAO G,CHEN D,et al.Effects of trophic status and temperature on communities of sedimentary ammonia oxidizers in Lake Taihu[J].Geomicrobiology Journal,2013,30(10):886-896. [17]徐彩平,刘霞,陈宇炜.浮游植物叶绿素a浓度测定方法的比较研究[J].生态与农村环境学报,2013,29(4):438-442.(XU Caiping,LIU Xia,CHEN Yuwei.Comparison of methods for determination of phytoplankton chlorophyll-a[J].Journal of Ecology and Rural Environment,2013,29(4):438-442.(in Chinese)) [18]国家环境保护总局.水和废水监测分析方法 [M].4版. 北京:中国环境科学出版社,2002. [19]WU Y C,KE X B,HERNANDEZ M,et al.Autotrophic growth of bacterial and archaeal ammonia oxidizers in freshwater sediment microcosms incubated at different temperatures[J].Applied and Environmental Microbiology,2013,79(9):3076-3084. [20]王明翠,刘雪芹,张建辉.湖泊富营养化评价方法及分级标准[J].中国环境监测,2002,18(5):47-49.(WANG Mingcui,LIU Xueqin,ZHANG Jianhui.Evaluate method and classification standard on lake eutrophication[J].Environmental Monitoring in China,2002,18(5):47-49.(in Chinese)) [21]张丽梅,贺纪正.一个新的古菌类群:奇古菌门(Thaumarchaeota)[J].微生物学报,2012,54(2):411-421.(ZHANG Limei,HE Jizheng.A novel archaeal phylum:thaumarchaeota[J].Acta Microbiologica Sinica,2012,54(2):411-421.(in Chinese)) [22]KONNEKE M,BERNHARD A E,DE LA TORRE J R,et al.Isolation of an autotrophic ammonia-oxidizing marine archaeon[J].Nature,2005,437(7058):543-546. [23]ISOBE K,KOBA K,SUWA Y,et al.High abundance of ammonia-oxidizing archaea in acidified subtropical forest soils in southern China after long-term N deposition[J].FEMS Microbiology Ecology,2012,80(1):193-203. [24]ERGUDER T H,BOON N,WITTEBOLLE L,et al.Environmental factors shaping the ecological niches of ammonia-oxidizing archaea[J].FEMS Microbiology Review,2009,33(5):855-869. [25]吴俊锋,谢飞,陈丽娜,等.太湖重污染湖区底泥沉积物特性[J].水资源保护,2011,27(4):74-78.(WU Junfeng,XIE Fei,CHEN Lina,et al.Characteristics of bottom sediment in heavily polluted area of Taihu Lake [J].Water Resources Protection,2011,27 (4):74-78.(in Chinese)) [26]ALVES R J,WANEK W,ZAPPE A,et al.Nitrification rates in arctic soils are associated with functionally distinct populations of ammonia-oxidizing archaea[J].International Society for Microbial Ecology,2013,7(8):1620-1631. [27]FRENCH E,KOZLOWSKI J A,MUKHERJEE M,et al.Ecophysiological characterization of ammonia-oxidizing archaea and bacteria from freshwater[J].Applied and Environmental Microbiology,2012,78(16):5773-5780. [28]HUANG L Q,DONG H L,WANG S,et al.Diversity and abundance of ammonia-oxidizing archaea and bacteria in diverse Chinese paddy soils[J].Geomicrobiology Journal,2014,31(1):12-22. [29]JIN T,ZHANG T,YE L,et al.Diversity and quantity of ammonia-oxidizing archaea and bacteria in sediment of the Pearl River Estuary,China [J].Applied Microbiology and Biotechnology,2011,90(3):1137-1145. [30]乌云.乌梁素海上覆水体与表层沉积物污染特征及其污染物迁移转换规律研究[D].呼和浩特:内蒙古农业大学,2011.
2.2 湖泊水体营养状态对沉积物好氧氨氧化菌丰度的影响

2.3 湖泊水体营养状态对沉积物好氧氨氧化菌群落组成的影响


2.4 上覆水理化性质对沉积物氨氧化菌群落结构的影响


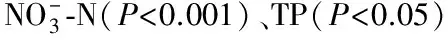


3 讨 论


4 结 论

