CuO/Fe3O4活化过一硫酸盐降解RhB
2018-07-02王雪如丁耀彬唐和清
王雪如,丁耀彬,唐和清
中南民族大学资源与环境学院,湖北 武汉 430074
随着印染工业的迅速发展,其生产废水已成为最主要的水体污染源之一。合成染料中应用最多的是偶氮染料,大约占有机染料的4/5。偶氮染料废水的成分复杂、可生性差、色度高且处理难度极大[1-3]。罗丹明 B(Rhodamine B,RhB)是最常使用的一种染料,具有潜在的致癌、致畸和致突变性[4],对人类的健康造成严重的威胁,故RhB的降解具有重要的意义。
国内外处理有机废水的技术通常有3类:物理法[5]、生物法[6]和化学法[7]。采用常规的物理法、生物法难以在技术和经济上达到要求,所以只能选择化学法,特别是氧化能力强的高级氧化技术。
基于硫酸根自由基(·SO4-)的高级氧化过程具有氧化能力强、矿化程度高、氧化剂本身稳定性好[8]、氧化剂利用率高、反应不受 pH 影响[9]、抗碳酸盐和氯化物等无机盐能力强[10]等优点,而且产生的·SO4-自由基的寿命比·OH长,提高了自由基对污染物的降解效率。因此,以·SO4-为基础的高级氧化技术成为了研究的热点。如Sorokin等[11]以FePcS为催化剂,以H2O2和过一硫酸盐(peroxy⁃monosulfate,PMS)(分 子 式 为 2KHSO5·KHSO4·K2SO4)为氧化剂降解并矿化氯酚时,发现以PMS为氧化剂的矿化率比以H2O2为氧化剂的要高。如Ding等[12]采用溶胶凝胶法制备了 CuFe2O4颗粒,构建了CuFe2O4活化PMS降解四溴双酚A(tetrabro⁃mobisphenolA,TBBPA)体系。当 CuFe2O4用量为0.1 g/L、PMS用量为0.2 mmol/L、污染物的投加量为10 mg/L时,该体系30 min内TBBPA的去除率达到99%,去除率远远高于单一的CuO和Fe3O4体系。Nie等[13]利用 Cu0/Fe3O4双金属材料活化 PMS降解多种有机污染物,相同条件下Cu0/Fe3O4-PMS体系100%的去除率远远高于单一的Cu0(28%)和Fe3O4(20%)。Zhang等[14]制备出了核壳结构的RGO/Fe3O4-Co3O4复合材料,将其用于高级氧化体系活化PMS降解有机染料。
如何高效活化过硫酸盐产生·SO4-是·SO4
-高级氧化技术的关键。常规的活化方法有微波、热、紫外光等物理方法和过渡金属离子等化学方法。物理方法经济成本高,而过渡金属离子等化学方法可以在常温常压下进行,不需要外加能量,因此被广泛研究应用。多种过渡金属离子都可以活化PMS,而铁系氧化物和铜系氧化物原料储量丰富易得,并且Cu、Fe双金属氧化物由于金属元素之间的协同作用表现出较单一铁氧化物更优良的催化性能[15-17]。
Lin等[18]用多种过渡金属制备出普鲁士蓝类似物MII3[MIII(CN)6]2(MII=Co,Cu,Fe,Mn,Ni;MIII=Co,Fe)。参考此方法先制备出Cu3[Fe(CN)6]2,再在空气气氛下煅烧使C-N键断裂,转化为双金属氧化物,制备出了纳米CuO/Fe3O4复合材料。发现纳米CuO/Fe3O4复合材料具有高效活化PMS降解有机污染物的能力。铜离子和铁离子的协同作用,加速了 Fe(III)/Fe(II),Cu(II)/Cu(I)的循环,促进了有机污染物的降解。
1 实验部分
1.1 试剂与表征
铁氰化钾、三水硝酸铜、氢氧化钠、硝酸、PMS、RhB、亚甲基蓝、金橙II、刚果红、日落黄、叔丁醇、乙醇。所用化学药品均为国药化学试剂,分析纯。实验用水为超纯水,电导率为18.2 MΩ/cm。
德国布鲁克公司X射线衍射(X-ray diffrac⁃tion,XRD)仪(D8ADVANCE 型,射线源为 CuKα靶射线,石墨单色器滤波,2θ为 10°~80°);美国热电公司X射线光电子能谱(X-ray photoelectron spec⁃troscopy,XPS)仪(VG Multilab 2000型),扫描电子显微镜(scanning electron microscopy,SEM)(FEI,Hitachi S-4800型),超纯水仪(Micropure UV,Ther⁃mo scientific),紫外可见分光光度计(EVOLVTION 201,Thermo scientific)。
1.2 实验方法
1.2.1 CuO/Fe3O4的制备 准确称取一定量的铁氰化钾和三水硝酸铜分别溶解到100 mL超纯水中。室温下边搅拌边将铁氰化钾溶液逐滴滴加到三水硝酸铜溶液中,将得到的悬浊液超声分散30 min,室温下继续搅拌均匀,静置陈化24 h。陈化后离心去除上清液,再用超纯水多次洗涤后即得沉淀物,60℃烘干。将中间体烘干后磨碎,置于马弗炉里煅烧,600℃保持1 h,得到黑色固体粉末即纳米CuO/Fe3O4。用同样的方法制备出单相的CuO和Fe3O4纳米颗粒。
1.2.2 催化降解实验 降解实验在30℃下于100 mL烧杯中进行。准确称取15 mg CuO/Fe3O4复合物分散于50 mL 30 μmol/L RhB溶液中,搅拌30 min使催化剂和污染物之间达到吸附解吸平衡。用NaOH调节溶液pH至碱性,加入一定量的PMS使pH为8.0同时引发反应,搅拌下取出1.0 mL,测污染物初始浓度作为c0,定时取样,立即加入0.05 mL乙醇(·SO4-淬灭剂)淬灭,并快速离心得到上清液,通过紫外可见分光光度计(UV)测定其最大吸收波长λmax=551 nm处的吸光度值。
2 结果与讨论
2.1 催化剂的表征
图1是CuO/Fe3O4的SEM图。由图1可见,制备的CuO/Fe3O4类似球形,表面粗糙,颗粒大小约为25 nm。图2是样品的XRD图谱,由图2可见,所得样品的XRD衍射峰与Fe3O4的标准图谱(JCPDS File NO.19-0629)相一致,在 2θ在 18.4°,30.1°,35.4°,43.1°,53.6°,57.1°,74.2°处出现的衍射峰分别对应于 Fe3O4的(111),(220),(311),(400),(422),(511),(440)晶面;且与 CuO 的标准图谱(JCPDS File NO.48-1548)相一致,在 2θ=38.9°,48.7°,66.2°,68.1°处出现的衍射峰,对应于CuO的(111),(202),(311),(220)晶面,说明成功制备了CuO/Fe3O4复合物。

图1 CuO/Fe3O4的(a)SEM图和(b)局部放大SEM图Fig.1 (a)and(b)SEM images of CuO/Fe3O4at different magnifications
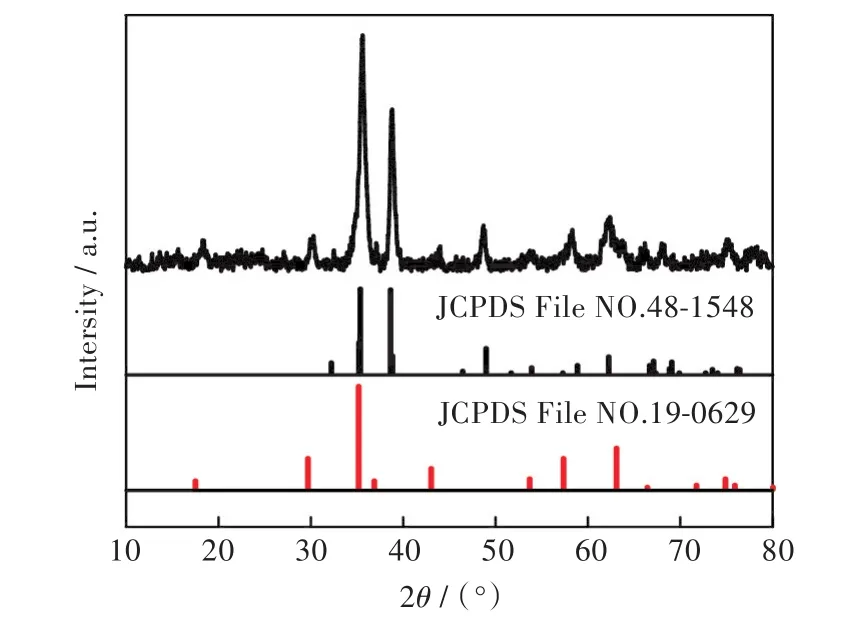
图2 CuO/Fe3O4的X射线衍射图谱Fig.2 XRD pattern of CuO/Fe3O4
图3是CuO/Fe3O4反应前后样品的XPS图谱。如图3(a)所示,在反应前后,催化剂表面的组成元素均是 C、Cu、Fe、O,C来自空气中的 CO2。图 3(b)是CuO/Fe3O4反应前后Cu 2p的XPS谱图,反应前催化剂的曲线中结合能954.0 eV和934.6 eV的两个峰值分别归属于Cu 2p1/2、Cu 2p3/2,未伴随卫星峰出现,证明在新催化剂表面,Cu的存在价态为Cu2+;而经过催化反应后,Cu 2p1/2和Cu 2p3/2的能谱峰向低结合能方向移动,出现了951.8 eV和932.1 eV的新峰,这说明有Cu+的生成。Fe2p的XPS能谱图如图3(c)所示,结合能712.4 eV和725.4 eV处的峰对应于Fe(III)的典型峰且伴随719.0 eV的卫星峰;结合能709.9 eV和723.4 eV处的峰对应于Fe(II)的典型峰且伴随715.5 eV的卫星峰。反应前后Fe 2p3/2和Fe 2p1/2的能谱峰向低结合能方向移动,说明反应过程发生了Fe(III)向Fe(II)的转变。经过分峰拟合分析,约有2%的Fe(III)转化成了 Fe(II),还原性 Fe(II)能够更好地活化PMS产生·SO4-。Zhang等[19]报道过相似的结果。

图3 CuO/Fe3O4反应前后的XPS谱图:(a)广谱;(b)Cu2p;(c)Fe2pFig.3 XPS spectra of CuO/Fe3O4before and after reaction:(a)Wide survey;(b)Cu2p;(c)Fe2p
2.2 CuO/Fe3O4活化PMS降解有机污染物性能
反应体系为:水浴温度30℃,RhB浓度30 μmol/L,CuO/Fe3O4催化剂 0.3 g/L,PMS 浓度0.4 mmol/L,初始pH=8.0。不同的反应体系对RhB的降解效果如图4(a)所示。由图4(a)可见,CuO/Fe3O4体系,20 min后污染物浓度几乎无变化,这是因为体系已经达到吸附平衡:PMS体系,污染物去除率约5%;CuO/Fe3O4-PMS体系,反应10 min后,污染物去除率接近100%。相同体系情况下,分别以单相的Fe3O4和CuO纳米颗粒做降解实验,相同时间内的去除率分别是35%和48%,降解效果远远低于CuO/Fe3O4-PMS体系。这说明CuO/Fe3O4复合物可以高效活化PMS降解RhB。
鉴于CuO/Fe3O4催化剂对RhB优良的降解性能,将CuO/Fe3O4-PMS体系应用于其他几种有机污染物的去除,选取亚甲基蓝(30 μmol/L),金橙II(30 μmol/L),刚果红(30 μmol/L),日落黄(30 μmol/L)染料为降解对象,降解体系条件与RhB的降解体系一致。CuO/Fe3O4-PMS体系对不同有机污染物的降解效果如图4(b)所示。亚甲基蓝和金橙II在15 min内去除率接近100%,刚果红和日落黄在10 min内去除率接近100%。以上结果表明,CuO/Fe3O4-PMS体系可以有效地降解多种有机污染物。
煅烧温度对RhB降解效果的影响如图5(a)所示,从图5(a)可以看出400℃、500℃、600℃时随着煅烧温度升高,降解效率提高,再升高煅烧温度,催化剂的降解效率反而降低。600℃制备的催化剂活化PMS的能力及其降解RhB的效果最好,在10 min时其降解效果达到了99%,因此选择600℃作为最适宜煅烧温度。这是因为600℃之前,前驱体中的C-N键没有被完全破坏,还未生成纯相的纳米CuO/Fe3O4颗粒;而600℃之后,温度过高,可能破坏了催化剂表面粗糙的微孔结构,影响了污染物与催化剂之间的吸附作用,降低了活性位点的捕获效率,因此再继续升高煅烧温度时,催化效率反而降低。

图5 (a)煅烧温度、(b)初始pH值、(c)PMS浓度、(d)CuO/Fe3O4用量对RhB降解效果的影响Fig.5 Effects of(a)calcination temperature,(b)initial solution pH,(c)PMS concentration and(d)CuO/Fe3O4mass concentration on degradtion of RhB
初始pH值对RhB降解效果的影响如图5(b)所示,初始pH在 4.0~10.0,CuO/Fe3O4-PMS体系均可达到较好的降解效果。pH=8.0时,降解效果最好。在中性偏碱的条件下,OH-会消耗Cu(II)与PMS反应生成的H+,促进反应进行,增大了≡CuI的生成速率,从而加速了自由基的产生。当体系碱性过强时,OH-会消耗HSO5-,因此 pH=8.0时,降解效果最好。
PMS浓度对RhB降解效果的影响见图5(c)。由图5(c)可以看出PMS的浓度为0.1 mmol/L、0.2 mmol/L、0.3 mmol/L、0.4 mmol/L时,随着PMS浓度的增大,其降解效率大大提高;PMS的浓度增大到0.6 mmol/L时,降解效率反而有微弱的降低。高PMS浓度下降解效率降低的原因是PMS和体系中的污染物发生了竞争反应,消耗了体系中的·SO4-。因此,PMS浓度为0.4 mmol/L时体系可以达到较优的降解效果。
CuO/Fe3O4用量对RhB降解效果的影响如图 5(d)所示,CuO/Fe3O4的投加量分别为 0 g/L、0.1 g/L、0.2 g/L、0.3 g/L,随着CuO/Fe3O4投加量的增加,降解效率越来越高,继续加大CuO/Fe3O4的投加量,降解效率并未继续提高,所以CuO/Fe3O4的最优投加量为0.3 g/L。
2.3 活性自由基的鉴定
过渡金属活化PMS去除有机污染物的降解机理被研究者关注并且已有不少报道。大多是主导的自由基反应。乙醇常作为·OH和的淬灭剂,叔丁醇常常作为·OH的淬灭剂。为了鉴定该反应体系中的活性物种是否为·SO4-主导,在反应开始时加入一定浓度的乙醇或叔丁醇,观察能否抑制污染物的降解,结果如图6所示。未加叔丁醇或乙醇的体系,在10 min时降解率为100%,加入100 mmol/L的叔丁醇时降解率为86%,加入100 mmol/L的乙醇时降解率为47%,当提高乙醇浓度,加入200 mmol/L的乙醇时降解率为25%。这表明,该体系中的氧化活性物种是大量的和少量的·OH以及别的活性物种。

图6 加入乙醇或叔丁醇对CuO/Fe3O4-PMS体系降解RhB的影响Fig.6 Effects of addition of ethanol or tert-butanol on degradation of RhB in system of CuO/Fe3O4-PMS
2.4 CuO/Fe3O4活化PMS的机理探究
自由基鉴定实验表明了反应体系中的活性物种的种类,XPS分峰拟合分析出了反应前后催化剂表面元素的价态变化,结合Zhang等[17]已经报道的CuFeO2-H2O2-BPA体系的研究结果,可以推测CuO/Fe3O4活化PMS降解RhB的反应机理,具体的反应过程如下:PMS首先与CuO/Fe3O4表面的铜和铁离子(≡CuII和≡FeIII)反应,生成表面亚铜和亚铁离子(≡CuI和≡FeII),见反应(1)和(2);而生成的表面亚铜和亚铁离子(≡CuI和≡FeII)与溶液中PMS反应生成·SO4-和·OH,见反应(3)和(4);表面亚铜和亚铁离子(≡CuI和≡FeIII)反应加速了铜离子和铁离子在反应体系中的循环,见反应(6);生成的·SO4-和·OH进攻污染物,进而将RhB进行降解矿化,见反应(7)和(8)。由于反应体系中≡CuI和≡FeIII的循环作用,加速了体系中活性物种的产生速率,体系中活性物种浓度的提高加速了一系列的降解反应,结果就形成了高效的降解体系。

3 结 语
分别以铁氰化钾和三水硝酸铜为铁源和铜源,采用共沉淀再煅烧两步得到CuO/Fe3O4磁性纳米颗粒。铜离子和铁离子的协同作用,加速了Fe(III)/Fe(II),Cu(II)/Cu(I)的循环,从而加速了催化剂表面的电子传递,提高了自由基的生成速率,因而,可以高效地降解有机污染物。该催化反应对设备要求不高,室温下即可快速反应,且对环境友好,在处理含染料废水方面具有较高的应用价值。
[1]SALAZAR R,BRILLAS E,SIRÉS I.Finding the best Fe2+/Cu2+combination for the solar photoelectro-Fenton treatment of simulated wastewater containing the industrial textile dye Disperse Blue 3 [J].Applied Catalysis B:Environmental,2012,115/116:107-116.
[2]TIAN S H,ZHANG J L,CHEN J,et al.Fe2(MoO4)3as an effective photo-Fenton-like catalystforthe degradation of anionic and cationic dyes in a wide pH range [J]. Industrial & Engineering Chemistry Research,2013,52(37):13333-13341.
[3]CAI C,ZHANG H,ZHONG X,et al.Electrochemical enhanced heterogeneous activation of peroxydisulfate by Fe-Co/SBA-15 catalyst for the degradation of Orange II in water[J].Water Research,2014,66:473-485.
[4]HORIKOSHIS,HOJO F,HIDAKA H,etal.Environmental remediation by an integrated microwave/UV illumination technique.8.Fate of carboxylic acids,aldehydes,alkoxycarbonyl and phenolic substrates in a microwave radiation field in the presence of TiO2particlesunderUV irradiation [J]. Environmental Science&Technology,2004,38(7):2198-2208.
[5]余响林,刘琼,黎汪周,等.可循环利用介孔SiO2材料的制备及其对染料的吸附性能[J].武汉工程大学学报,2011,33(5):8-11.
[6]GADD G M.Biosorption:critical review of scientific rationale,environmental importance and significance for pollution treatment[J].Journal of Chemical Technology and Biotechnology,2009,84(1):13-28.
[7]KANG Q,GAO B Y,YUE Q Y,et al.Residual color profiles of reactive dyes mixture during a chemical flocculation process[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2007,299(1/2/3):45-53.
[8]LAU T K,CHU W,GRAHAM N J D.The aqueous degradation of butylated hydroxyanisole by UV/S2O82-:study of reaction mechanisms via dimerization and mineralization [J]. Environmental Science &Technology,2007,41(2):613-619.
[9]ANIPSITAKISG P,DIONYSIOU D D.Radical generation by the interaction of transition metals with common oxidants [J]. EnvironmentalScience &Technology,2004,38(13):3705-3712.
[10]LIANG C J,WANG Z S,MOHANTY N.Influences of carbonate and chloride ions on persulfate oxidation of trichloroethylene at 20 ℃[J].Science of the Total Environment,2006,370(2/3):271-277.
[11]SOROKIN A,MEUNIER B.Oxidation of polycyclic aromatic hydrocarbons catalyzed by iron tetrasulfophthalocyanine FePcS:inverse isotope effects and oxygen labeling studies[J].European Journal of Inorganic Chemistry,2010,1998(9):1269-1281.
[12]DING Y B,ZHU L H,WANG N,et al.Sulfate radicals induced degradation of tetrabromobisphenol A with nanoscaled magnetic CuFe2O4asa heterogeneous catalyst of peroxymonosulfate[J].Applied Catalysis B:Environmental,2013,129:153-162.
[13]NIE G,HUANG J,HU Y Z,et al.Heterogeneous catalytic activation of peroxymonosulfate for efficient degradation of organic pollutants by magnetic Cu0/Fe3O4submicron composites [J]. Chinese Journal of Catalysis,2017,38(2):227-239.
[14]ZHANG L S,YANG X J,HAN E F,et al.Reduced graphene oxide wrapped Fe3O4-Co3O4yolk-shell nanostructures for advanced catalytic oxidation based on sulfate radicals[J].Applied Surface Science,2017,396:945-954.
[15]XIA M,LONG M C,YANG Y D,et al.A highly active bimetallic oxides catalyst supported on Al-containing MCM-41 for Fenton oxidation of phenol solution[J].Applied CatalysisB:Environmental,2011,110:118-125.
[16]NIE Y L,HU C,QU J H,et al.Photoassisted degradation of endocrine disruptors over CuOx-FeOOH with H2O2at neutral pH[J].Applied Catalysis B:Environmental,2009,87(1/2):30-36.
[17]TIMOFEEVA M N,KHANKHASAEVA S T,TALSI E P,et al.The effect of Fe/Cu ratio in the synthesis of mixed Fe,Cu,Al-clays used as catalysts in phenol peroxide oxidation [J]. Applied Catalysis B:Environmental,2009,90(3/4):618-627.
[18]LIN K Y A,CHEN B J,CHEN C K.Evaluating Prussian blue analogues MII3[MIII(CN)6]2(MII=Co,Cu,Fe,Mn,Ni;MIII=Co,Fe) asactivatorsfor peroxymonosulfate in water[J].RSC Advances,2016,6(95):92923-92933.
[19]ZHANG X Y,DING Y B,TANG H Q,etal.Degradation of bisphenol A by hydrogen peroxide activated with CuFeO2microparticles as a heterogeneous Fenton-like catalyst:efficiency,stability and mechanism[J].Chemical Engineering Journal,2014,236:251-262.
