抑钙剂NPS 2143对创伤失血性休克大鼠心血管功能的影响
2018-06-29陆军军医大学陆军卫勤训练基地战救技能训练教研室重庆400038陆军军医大学大坪医院野战外科研究所第二研究室创伤烧伤与复合伤国家重点实验室重庆40004
,, ,, (.陆军军医大学陆军卫勤训练基地战救技能训练教研室,重庆 400038;.陆军军医大学大坪医院野战外科研究所第二研究室,创伤、烧伤与复合伤国家重点实验室,重庆 40004)
抑钙剂(calcilytics)是特异性的细胞外钙敏感受体(calcium sensing receptor,CaSR)的别构抑制剂[1]。CaSR最早发现于牛的甲状旁腺细胞[2],它在钙代谢相关的组织器官中高表达,如甲状旁腺、肾脏、小肠和骨组织,CaSR在维持体内钙稳态中有重要作用。CaSR的别构激动剂也称为拟钙剂(calcimimetics),已被欧美国家批准用于临床治疗继发性甲状旁腺功能亢进;相对应的抑制剂也即是抑钙剂,目前用于骨质疏松症的治疗研究中[3-5]。近年来随着研究的深入,人们发现CaSR在心血管系统、脑和神经系统等的器官组织中也有丰富表达和重要功能[6-8]。本实验室前期研究发现,CaSR在血管收缩反应性调节中有着重要作用[9]。但其在休克后心血管功能障碍时的作用如何,目前尚不清楚。本研究通过观察抑钙剂NPS 2143对创伤失血性休克大鼠的存活情况、血压变化及血流动力学指标的影响,初步探讨CaSR在休克后血管功能调节中发挥的作用。
1 材料与方法
1.1 实验动物及试剂
128只清洁级SD大鼠,体质量180~230 g,由陆军军医大学第三附属医院野战外科研究所实验动物中心提供。抑钙剂NPS 2143(Tocris Bioscience,Bristol,UK;Cat.No.3626,Batch No.1B/160801)。
1.2 休克模型制备及实验分组
采用本实验室常规方法制备大鼠创伤失血性休克模型[10]:动物麻醉后,行右侧股骨骨折,通过左侧股动脉插管放血使血压下降至30 mmHg,并维持在此水平2 h,即为休克模型成功。随后通过左侧股静脉插管来复苏给药。96只大鼠用于存活实验,随机分为6组(n=16):正常组、休克组、乳酸林格氏液(LR)组、LR+NPS 2143 0.1 mg/kg组、LR+NPS 2143 1 mg/kg组、LR+NPS 2143 5 mg/kg组。32只大鼠用于观察血压及血流动力学指标,分为4组(n=8):正常组、休克组、LR组、LR+NPS 2143 1 mg/kg组。
1.3 观察24 h存活情况
在休克复苏结束后,拔出动静脉插管、结扎止血并缝合伤口,肌肉注射抗生素以预防感染,给予正常饮食,记录每只大鼠的死亡时间,直至复苏后24 h,计算24 h存活率。
1.4 检测血压及升压反应、血流动力学指标
在休克前、休克末、复苏1 h和复苏2 h时相点连续检测各项指标。通过股动脉插管连接水银血压计,记录平均动脉血压(MAP),通过股静脉插管推注去甲肾上腺素(NE,3 μg/kg),观察NE诱导的血压升高情况[10]。通过颈动脉插管至左心室、连接压力传感器和生理记录仪,记录各时相点的血流动力学指标:左心室收缩压(left ventricular systolic pressure,LVSP)、心率(heart rate,HR)、左心室压力最大上升/下降速率(maximal change rate of left intraventricular pressure,±dp/dtmax)[11]。
1.5 统计学分析
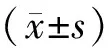
2 结果
2.1 NPS 2143对THS大鼠存活的影响
创伤失血性休克是一种致死的损伤因素,不进行治疗的休克大鼠平均存活时间仅为3 h左右,且存活均不超过10 h。给予LR复苏能一定程度上提高休克大鼠的存活时间,存活至24 h的大鼠数量为4只(总数16只)。NPS 2143 0.1 mg/kg输注后大鼠的存活情况与LR组相比无明显差异,而NPS 2143 1 mg/kg和5 mg/kg 可明显延长休克大鼠的存活时间,24 h存活大鼠分别为11只和9只,与LR组相比差异有统计学意义(P<0.05~0.01),见图1a、b。
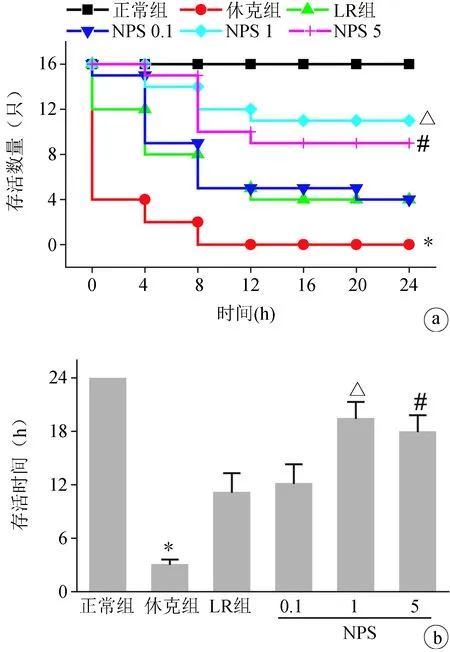
a:NPS 2143对THS大鼠24 h存活只数的影响;b: NPS 2143对THS大鼠24 h存活时间的影响 *:与正常组比较,P<0.01;#:与LR组比较,P<0.05;△:与LR组比较,P<0.01
图1NPS2143对THS大鼠24h存活数量和存活时间的影响(n=16)
2.2 NPS 2143对THS大鼠血压和升压反应的影响
正常大鼠血压在整个实验过程中无明显变化。休克模型大鼠血压被维持在30 mmHg,模型完成后休克大鼠血压随时间延长进一步降低。LR复苏后休克大鼠的血压有所上升。NPS 2143 1 mg/kg输注可使休克大鼠的血压进一步升高,在复苏2 h时明显高于LR组(P<0.01)。NE诱导的升压反应也显示了相似的变化趋势。休克后NE诱导的血压升幅显著降低,LR复苏有轻度的升高作用,NPS 2143输注对NE的升压效应有明显的改善作用(图2a、b)。
2.3 NPS 2143对THS大鼠血流动力学指标的影响
休克显著降低了大鼠的各项血流动力学指标。LR复苏对各项指标有一定程度的改善作用。1 mg/kg的NPS 2143输注可明显升高休克大鼠的LVSP和±dp/dtmax,在复苏2 h时明显高于LR组(P<0.05)。NPS 2143也使HR有所升高,但与LR组相比无统计学意义(图3a~d)。

a:NPS 2143对THS大鼠血压的影响;b:NPS 2143对THS大鼠血压升幅的影响; *:与正常组比较,P<0.01;△:与LR组比较,P<0.01
图2NPS2143对THS大鼠血压和血压升幅的影响(n=8)

a:LVSP(左心室收缩压);b:HR(心率);c:+dp/dtmax(左心室压力最大上升速率);d:-dp/dtmax(左心室压力最大下降速率) *:与正常组比较,P<0.01;#:与LR组比较,P<0.05
图3NPS2143对THS大鼠血流动力学指标的影响(n=8)
3 讨论
CaSR除了参与钙代谢相关疾病之外,还参与了肾脏疾病、肿瘤、心血管疾病和阿尔茨海默病等多种疾病的病理过程,因此CaSR调节剂在多种疾病治疗中的潜力得到了广泛关注。NPS 2143是第一个被报道的具有口服生物活性的小分子CaSR别构抑制剂(Calcilytics),其化学结构为N-[(R)-2-hydroxy-3-(2-cyano-3-chlorophenoxy)propyl]-1,1-dimethyl-2-(2-naphthyl)ethylamine[1,12]。NPS 2143能够抑制甲状旁腺中的CaSR活性,促进内源性甲状旁腺激素(PTH)分泌,其早期相关研究的主要目的是开发治疗骨质疏松的口服药物,且目前仍有待进一步的临床验证[13]。CaSR活化突变可引起常染色体相关的低钙血症(ADH)和Bartter综合症(BS5),这是一类罕见且在临床上缺乏有效治疗措施的疾病,抑钙剂可特异性抑制CaSR活性并纠正受体突变带来的一系列病理改变,动物实验显示NPS 2143对3种模拟人ADH疾病的模型小鼠都有治疗作用,一项小样本临床试验观察了另一种抑钙剂NPSP795对5名ADH患者的疗效,结果提示抑钙剂有可能是ADH和BS5极具潜力的一种治疗手段[14]。
随着心血管系统中存在CaSR被证实,拟钙剂和抑钙剂对心血管功能的影响也逐渐被发现[7,15]。Rybczynska等[16]发现,静脉推注NPS 2143可引起血压正常的Wistar大鼠血压升高,而对切除甲状旁腺的大鼠血压无明显影响,作者推测NPS 2143升高血压的作用可能与甲状旁腺分泌的高血压因子(parathyroid hypertensive factor,PHF)有关。另一项研究显示,阻断钙通道和血管紧张素1型受体(AT1)能抑制NPS 2143升高血压的作用,提示NPS 2143的作用机制可能不局限于调节激素分泌[17]。此外,在关于肺血管平滑肌细胞的研究中,Yamamura[18]发现CaSR参与了肺动脉高压的病理过程,而NPS 2143可阻止肺动脉高压和右心室肥大的发展。但是,与此同时也有一些相关研究,其结果并未发现NPS 2143对血压的调节作用。
前期大量的实验工作显示,复苏2 h后的治疗效果比较明显。复苏后2 h各项指标恢复较好的大鼠绝大多数能存活至24~72 h,而复苏后2 h各项指标较差的大鼠基本上不能存活至24 h,复苏后2 h的大鼠状态能够较好地反映该治疗方法是否有效,因此我们设置复苏后2 h作为重要的检测时相点。本实验结果提示,抑钙剂NPS 2143在低剂量(0.1 mg/kg)时对创伤失血性休克大鼠存活情况的影响与单纯给予LR复苏的效果相似,而中、高剂量的NPS 2143(1和5 mg/kg)都有较明显的延长休克动物存活时间和提高24 h存活只数的作用,其治疗效果显著优于单纯LR复苏,在两者之中,1 mg/kg剂量组略优于5 mg/kg剂量组。进一步的实验显示,NPS 2143(1 mg/kg)能够升高休克大鼠的血压,增加NE诱导的升压反应,改善休克后血流动力学指标(包括LVSP和±dp/dtmax),其作用明显优于LR组。
前期对离体血管的研究结果显示,拟钙剂cinacalcet能诱导内皮完整的预收缩的血管产生舒张,提示CaSR在血管舒缩调节中发挥着一定作用[9]。结合本实验结果,可以推测CaSR在休克后血管功能调节中发挥了重要作用,CaSR抑制剂NPS 2143有较好的休克治疗作用。抑钙剂发挥作用的机制可能是通过抑制CaSR,改善休克导致的血管平滑肌细胞钙超载,进而发挥血管细胞保护作用,但剂量过高时可能引起过度抑制,过度降低细胞内钙水平,从而影响血管收缩功能。另外,随着药物剂量的增加,可能出现的副作用也会对总体治疗效果产生影响。综上所述,CaSR对血管张力和血压调节是多靶点、多机制共同作用的复杂过程,其具体的调节机制仍需要进一步研究。
[参考文献]
[1] Nemeth EF,Goodman WG.Calcimimetic and calcilytic drugs: feats,flops,and futures[J].Calcif Tissue Int,2016,98(4):341-358.doi: 10.1007/s00223-015-0052-z.
[2] Brown EM,Gamba G,Riccardi D,et al.Cloning and characterization of an extracellular Ca2+-sensing receptor from bovine parathyroid [J].Nature,1993,366(6455):575-580.doi:10.1038/366575a0.
[3] Vahe C,Benomar K,Espiard S,et al.Diseases associated with calcium-sensing receptor[J].Orphanet J Rare Dis,2017,12(1):19.doi: 10.1186/s13023-017-0570-z.
[4] Cozzolino M,Galassi A,Conte F,et al.Treatment of secondary hyperparathyroidism: the clinical utility of etelcalcetide[J].Ther Clin Risk Manag,2017,13:679-689.doi: 10.2147/TCRM.S108490.
[5] Díaz-Soto G,Rocher A,García-Rodríguez C,et al.The calcium-sensing receptor in health and disease[J].Int Rev Cell Mol Biol,2016,327:321-369.doi: 10.1016/bs.ircmb.2016.05.004.
[6] Chiarini A,Armato U,Liu D,et al.Calcium-sensing receptors of human neural cells play crucial roles in Alzheimer's disease[J].Front Physiol,2016,7:134.doi: 10.3389/fphys.2016.00134.
[7] Schepelmann M,Yarova PL,Lopez-Fernandez I,et al.The vascular Ca2+-sensing receptor regulates blood vessel tone and blood pressure[J].Am J Physiol Cell Physiol,2016,310(3):C193-C204.doi: 10.1152/ajpcell.00248.2015.
[8] Smith KA,Ayon RJ,Tang H,et al.Calcium-sensing receptor regulates cytosolic [Ca2+] and plays a major role in the development of pulmonary hypertension[J].Front Physiol,2016,7:517.doi: 10.3389/fphys.2016.00517.
[9] 彭小勇,李 涛,刘良明,等.CaSR在大鼠血管收缩/舒张反应性调节中的作用[J].局解手术学杂志,2016,25(9):629-631.doi: 10.11659/jjssx.04E016053.
[10] Yang GM,Peng XY,Hu Y,et al.4-phenylbutyrate benefits traumatic hemorrhagic shock in rats by attenuating oxidative stress,not by attenuating endoplasmic reticulum stress[J].Crit Care Med,2016,44(7):e477-491.doi: 10.1097/CCM.0000000000001469.
[11] 杨光明,彭小勇,李 涛,等.环孢素A对严重创伤失血性休克大鼠的治疗作用[J].局解手术学杂志,2014,23(3):250-252.doi: 10.11659/jjssx.1672-5042.201403011.
[12] Nemeth EF,Delmar EG,Heaton WL,et al.Calcilytic compounds: potent and selective Ca2+receptor antagonists that stimulate secretion of parathyroid hormone[J].J Pharmacol Exp Ther,2001,299(1):323-331.
[13] Widler L.Calcilytics: antagonists of the calcium-sensing receptor for the treatment of osteoporosis[J].Future Med Chem,2011,3(5):535-547.doi: 10.4155/fmc.11.17.
[14] Mayr B,Glaudo M,Schöfl C.Activating calcium-sensing receptor mutations: prospects for future treatment with calcilytics[J].Trends Endocrinol Metab,2016,27(9):643-652.doi: 10.1016/j.tem.2016.05.005.
[15] Colella M,Gerbino A,Hofer AM,et al.Recent advances in understanding the extracellular calcium-sensing receptor[J].F1000 Res,2016,5.pii: F1000 Faculty Rev-2535.doi: 10.12688/f1000research.8963.1.
[16] Rybczynska A,Lehmann A,Jurska-Jasko A,et al.Hypertensive effect of calcilytic NPS 2143 administration in rats[J].J Endocrinol,2006,191(1):189-195.doi: 10.1677/joe.1.06924.
[17] Rybczynska A,Jurska-Jasko A,Boblewski K,et al.Blockade of calcium channels and AT1 receptor prevents the hypertensive effect of calcilytic NPS 2143 in rats[J].J Physiol Pharmacol,2010,61(2):163-170.
[18] Yamamura A.Pathological function of Ca2+-sensing receptor in pulmonary arterial hypertension.J Smooth Muscle Res,2014,50:8-17.doi:10.1540/jsmr.50.8.
