饲用金霉素对犊牛生长性能和血液指标的影响
2018-06-29王永红韩兆玉
张 林, 王永红, 韩兆玉
(1.南京农业大学动物科技学院,江苏南京 210095; 2.驻马店华中正大有限公司,河南驻马店 463000)
金霉素(chlortetracycline,简称CTC)属于四环素类广谱抗生素,对葡萄球菌、肺炎球菌等革兰氏阳性球菌非常有效,在动物疾病防治方面发挥了重要作用。此外,CTC还具有促进动物体生长的特点,因此低剂量的饲料级金霉素被广泛应用于畜禽饲料添加剂。研究表明,饲料中持续添加低剂量金霉素对肉鸡具有显著的促生长作用[1],在肉仔鸡日粮中添加150 mg/kg CTC,能够显著地提高肉仔鸡的增质量速率和饲料转化效率,改善率分别为6.43%、5.66%[2]。在断奶仔猪日粮中添加一定量的金霉素可显著提高仔猪采食量和饲料转化率,增加日增质量,降低腹泻率[3-4],而在育肥期促进作用不明显[5]。目前,国内关于金霉素在鸡、猪饲养上的研究比较常见,而在牛、羊等反刍动物上的研究则鲜有报道。国外有研究表明,金霉素可通过改变机体的内分泌轴[6],进而影响动物生长。当肉牛的低蛋白日粮中添加350 mg/d CTC,可有效提高血浆中IGF-1的含量[7]。金霉素作为一种促生长添加剂大量应用在养殖中,长期使用必将影响畜牧业的可持续发展。本试验将探索不同金霉素含量的日粮对肉牛生长性能和免疫性能的影响,为合理高效使用金霉素提供科学依据。
1 材料与方法
1.1 试验分组与饲养管理
试验于2016年5月在江苏亿森牧业有限公司进行,选择年龄、膘情、体质量(147.94±4.59) kg相近,未使用过抗菌药的西门塔尔牛犊30头,随机分为对照组、试验Ⅰ和试验Ⅱ组,每组10头牛,供试30头公牛全部舍饲拴养,对照组:精料中不添加任何抗生素;试验Ⅰ组:每1 000 kg精料中添加 1.33 kg 喜特肥(200 mg/kg CTC);试验Ⅱ组:每1 000 kg精料中添加2.67 kg喜特肥(400 mg/kg CTC)。试验开始前7 d为预饲期,预饲期结束后正式开始试验,试验期为60 d。试验期每天06:00和17:00饲喂日粮,饲喂模式为精料+粗饲料,每天饲喂1.6 kg精料和3.5 kg花生秸,自由饮水,基础精料组成及营养水平见表1。本试验所使用金霉素的商品名为喜特肥(Citifac),纯度为15%,由驻马店华中正大有限公司提供。
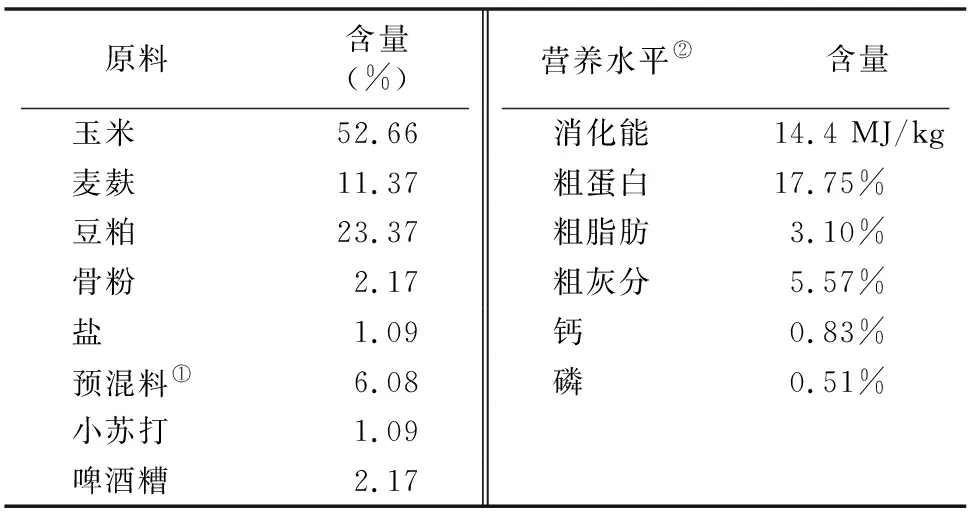
表1 精料组成及营养水平(干物质基础)
注:①1 kg预混料有效营养包括维生素A 3 100 IU、维生素D 850 IU、维生素E 30 IU、铁50.00 mg、铜10.00 mg、锌35.00 mg、锰60.00 mg、碘0.30 mg、钴0.12 mg、硒0.16 mg。②基础精料营养水平为计算值。
1.2 样本采集与测定
1.2.1 生长性能指标测定 试验开始前和结束后,每头肉牛于晨饲前分别空腹称体质量1次,计算平均日增质量(ADG);分别测量每头牛的体高、腰高、体长、胸围和胸深,并计算育肥指数、体长指数和胸围指数。育肥指数=体质量/体高×100%,体长指数=体斜长/体高×100%,胸围指数=胸围/体高×100%。试验期间,每天记录每头肉牛的采食量,计算料重比(F/G)。ADG=(末质量-初质量)/天数;F/G=平均日采食量/平均日增质量。
1.2.2 血液生化指标测定 试验开始前和结束后,肉牛于晨饲前由颈静脉采血10 mL,静置1~2 h后3 500 r/min离心 20 min,收集血清于-20 ℃保存,待测。
测定指标包括血清总蛋白、白蛋白、球蛋白含量(生化法);免疫球蛋白(IgG)、补体C3、补体C4(免疫比浊法)、溶菌酶活性(比浊法);血清超氧化物歧化酶活性(orgotein superoxide dismutase,SOD,WST-1法);丙二醛含量(MDA,TBA法)、谷胱甘肽过氧化物酶活性(GSH-Px,比色法),试剂盒均购自南京建成生物科技有限公司。
1.2.3 粪便中金霉素残留及大肠杆菌耐药性检测 试验结束后,对每头肉牛分别进行直肠粪样采集,将收集到的粪样放到灭菌塑料管中置于冰上带回实验室,用于后续试验研究。用于粪便中金霉素残留检测的粪样置于-80 ℃冷冻保存,并采用酶联免疫吸附反应(ELISA)方法对粪便中金霉素含量进行检测。用于大肠杆菌耐药性检测的新鲜粪样,迅速划麦康凯培养基,扩增大肠杆菌单菌落做金霉素MIC试验。
1.3 数据处理及统计分析
试验数据经Excel 2010初步整理后用SPSS 20.0进行统计分析。试验各组之间的差异分析采用单因子方差(one-way ANOVA)分析,多重比较采用最小显著差数法(LSD)。结果均用“平均值±标准差(x±s)”表示。
2 结果与分析
2.1 金霉素对肉牛体尺、体重的影响
由表2可知,在试验前,对照组、试验Ⅰ组和试验Ⅱ组的各项体尺指标均无显著差异(P>0.05)。试验后60 d,试验Ⅰ组的体高、腰高、体长和胸深均低于对照组,但差异不显著(P>0.05);胸围、育肥指数、体长指数和胸围指数均高于对照组,但差异不显著(P>0.05)。试验Ⅱ组的体高、胸围、胸深和胸围指数均低于对照组,但差异不显著(P>0.05);腰高、体长、育肥指数和体长指数均高于对照组,但差异不显著(P>0.05)。此外,试验后60 d试验Ⅱ组的体长显著高于试验Ⅰ组(P<0.05)。由表3可知,与对照组相比,试验后60 d时试验Ⅰ组和试验Ⅱ组的体质量分别增加7.67、6.50 kg,总增质量分别提高7.46、6.92 kg,平均日增质量分别提高118.33、111.67 g,料质量比分别降低1.82、1.19,但差异均不显著(P>0.05)。
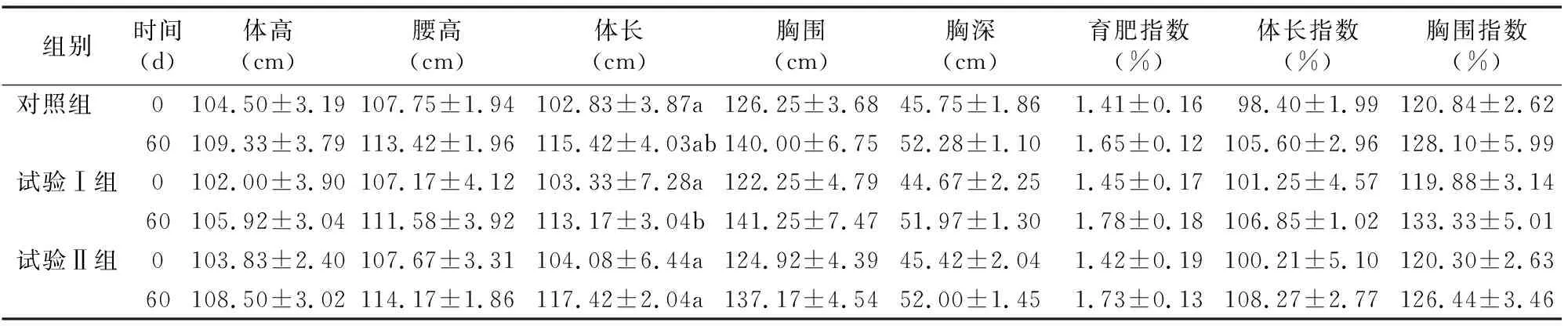
表2 金霉素对肉牛体尺的影响
注:同列数据后相同时间点不同小写字母表示差异显著(P<0.05);相同字母或无字母表示差异不显著。下表同。
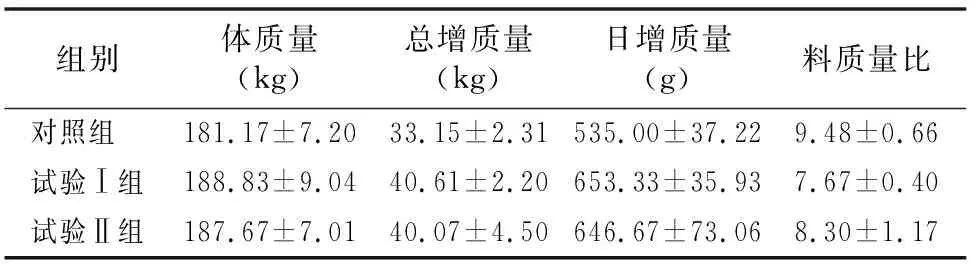
表3 金霉素对试验后60 d肉牛体质量的影响
2.2 金霉素对肉牛血液生化指标的影响
由表4可知,在试验前,对照组、试验Ⅰ组和试验Ⅱ组的血清总蛋白、白蛋白、球蛋白含量均无显著差异(P>0.05)。试验后60 d时,试验Ⅰ组和试验Ⅱ组的血清总蛋白、白蛋白和球蛋白含量均低于对照组,其中试验Ⅰ组的血清总蛋白、白蛋白和球蛋白含量显著降低(P<0.05)。由表5可知,在试验前,对照组、试验Ⅰ组和试验Ⅱ组的溶菌酶和补体C3、补体C4、IgG、GSH-Px、MDA含量均无显著差异(P>0.05)。试验后60 d,试验Ⅰ组和试验Ⅱ组的溶菌酶活性和补体C4、IgG、GSH-Px含量均高于对照组,其中试验Ⅱ组的溶菌酶活性和补体C4、GSH-Px含量显著高于对照组(P<0.05);试验Ⅱ组的SOD活性显著高于试验Ⅰ组和对照组(P<0.05);试验Ⅰ组的MDA含量显著高于对照组和试验Ⅱ组(P<0.05)。
2.3 粪便中金霉素的残留及对大肠杆菌耐药性的影响
由表6可知,试验后60 d,试验Ⅰ组和试验Ⅱ组中金霉素残留量分别为452.58、648.20 μg/kg,远低于添加量。试验Ⅰ组和试验Ⅱ组中金霉素对大肠杆菌最小抑菌浓度(MIC)均从6 μg/mL 提高到了32 μg/mL,耐药性显著增强(P<0.05)。
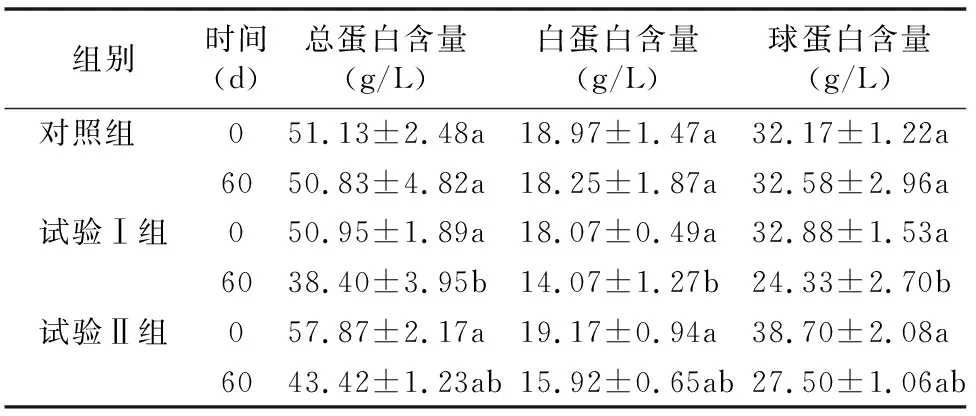
表4 金霉素对肉牛血清蛋白的影响
3 讨论与结论
3.1 金霉素对肉牛生长性能的影响
目前,有关金霉素促生长的机制并不清晰,有研究认为这可能与抗生素能够改善动物消化道微生物和肠道壁厚度有关[8]。Reeks等研究发现,CTC能够有效抑制巴斯德杆菌、曼氏杆菌、嗜血杆菌的有害细菌,利于动物生长[9]。Rumsey等研究表明,日粮中添加350 mg/d CTC会增加肉牛脂肪沉淀,提高能量利用率,但增质量效果不明显[10]。Reid等也发现,金霉素对12月龄奶牛的日增质量、饲料转化率以及体长无影响[11]。本试验结果表明,日粮中添加金霉素能够一定程度地提高肉牛的日增质量和饲料转化率,但效果不显著。这可能与饲喂时间有关,马玉龙等研究发现,金霉素的促生长效果随日龄的增加而减弱,对肉鸡饲料转化效率的影响也因日龄不同而有所不同[12]。
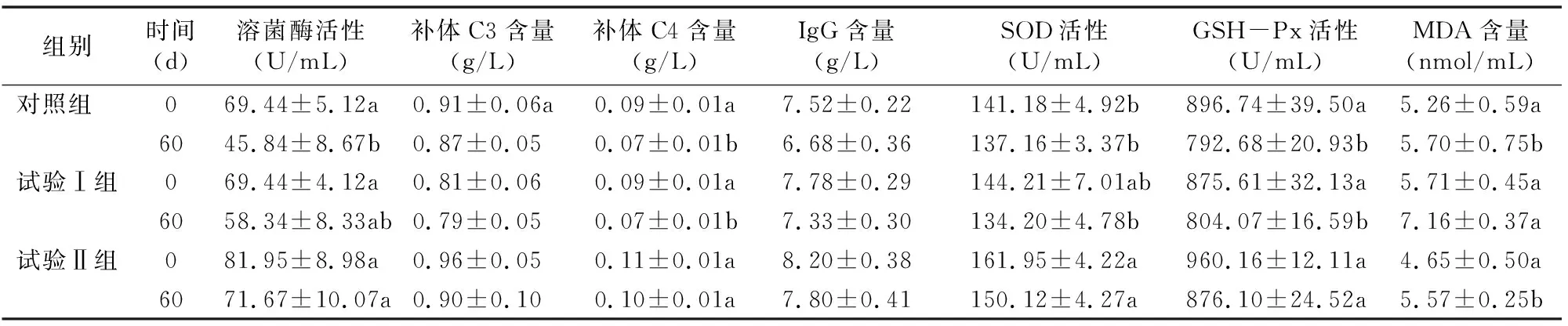
表5 金霉素对肉牛血清免疫指标和抗氧化指标的影响
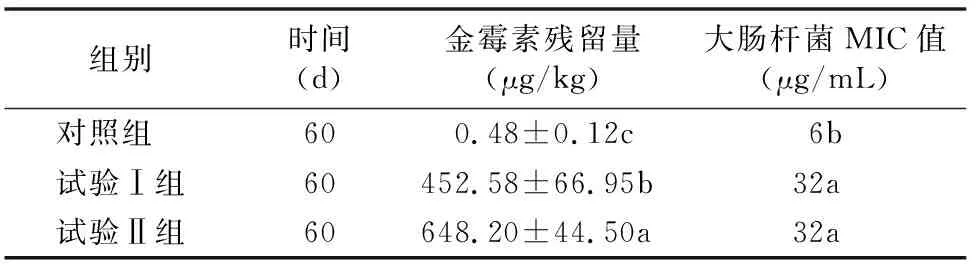
表6 粪便中金霉素的残留及对大肠杆菌耐药性的影响
3.2 金霉素对肉牛血清蛋白的影响
血液生化指标是机体正常生理功能和代谢过程的内在反映。血清蛋白主要由肝脏合成,当肝脏发生病变时会导致蛋白合成能力减弱[13],血清蛋白含量的变化往往伴随着体内稳态的改变和疾病的发生[14],本试验中添加金霉素组的血清总蛋白、白蛋白和球蛋白的含量均低于对照组,这可能是由于金霉素增加了肝脏的负担,使肝脏合成蛋白的能力进一步减弱。
3.3 金霉素对肉牛免疫功能的影响
溶菌酶是单核细胞分泌的非特异性免疫因子,具有活化吞噬细胞、呈递抗原、溶菌、增强机体抗感染能力的作用,是机体重要的非特异性免疫物质[15]。补体是机体非特异性免疫的重要组成部分,经活化后可协助特异性抗体吞噬病菌,参与机体免疫调节。在补体系统中C3含量最多,是主要激活途径中的中心环节;C4能够协助免疫球蛋白清除病原微生物[16-17]。IgG是动物血清中主要的抗体成分,约占血清免疫球蛋白的75%,能够特异性结合抗原,具有抗菌、抗病毒等功能,是衡量机体免疫功能的重要指标[18]。本试验结果显示,添加金霉素组的溶菌酶活性和补体C4、IgG含量均高于对照组,表明饲料中添加400 mg/kg CTC有提高肉牛免疫力的趋势,尤其是非特异性免疫功能。
3.4 金霉素对肉牛抗氧化能力的影响
正常生理状态下,机体自由基的产生和消除处于动态平衡[19],平衡一旦被打破,自由基的浓度升高将会导致脂质过氧化产生丙二醛(MDA),造成细胞损伤。SOD是一种含有金属元素的活性蛋白酶,能及时修复因自由基造成的损伤,是生物体内清除自由基的首要物质。GSH-Px是机体内一种重要的过氧化物分解酶,能还原有毒的过氧化物,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。在本试验中各组的SOD、GSH-Px活性均降低,MDA的含量增加,说明机体均发生了有害的过氧化反应。试验Ⅰ组的MDA含量显著高于对照组(P<0.05),而其SOD和GSH-Px活性与对照组差异不显著;试验Ⅱ组的MDA含量低于对照组,但差异不显著。添加400 mg/kg金霉素组的SOD和GSH-Px活性均显著高于对照组,且MDA含量低于对照组,说明机体在受到过氧化损伤时,能够更好地减弱不利损害。
3.5 粪便中金霉素的残留及对大肠杆菌耐药性的影响
金霉素作为饲料添加剂广泛应用在猪和肉鸡养殖生产中,甚至超过规定剂量。研究表明,抗生素进入动物体内并不能被完全吸收,25%~75%将会随粪便和尿液排出体外[20],并保持生物活性。长期使用金霉素饲料添加剂不仅有增加肠道微生物耐药性的危险,还可能会造成水体和土壤产生大量耐药菌,危害环境[21]。本试验结果显示,粪便中检测到的金霉素含量分别只有452.58、648.20 μg/kg,不足添加量的1%,本试验发现200、400 mg/kg CTC 对大肠杆菌最小抑菌浓度均从6 μg/mL提高到了32 μg/mL,显著提高了大肠杆菌的耐药性。
参考文献:
[1]佟建明,萨仁娜. 持续、低剂量金霉素对肉仔鸡肠道微生物、血氨、尿酸和生产性能的影响[J]. 畜牧兽医学报,2001,32(5):403-409.
[2]张日俊,佟建民,萨仁娜,等. 饲用金霉素对肉仔鸡免疫系统生长发育及免疫反应的研究[J]. 畜牧兽医学报,2000,31(3):216-223.
[3]陈旭东,胥传来,马秋刚,等. 金霉素、果寡糖和芽孢杆菌对断奶仔猪生产性能和血清学指标的影响[J]. 中国畜牧杂志,2005,41(6):25-27.
[4]卢建军,许梓荣. 日粮添加金霉素对断奶仔猪肠道核因子 NF-κB 活化的影响[J]. 畜牧兽医学报,2006,37(9):933-939.
[5]范 赛. 重金属与金霉素对无公害猪肉生产和环境的影响研究[D]. 重庆:西南大学,2008.
[6]Landagora F T,Rusoff L L,Harris B,et al. Effect of chlortetracycline on carcass yields including physical and chemical composition of dairy calves[J]. Journal of Animal Science,1957,16(3):654-661.
[7]McLeod K R,Baldwin R L,Rumsey T S,et al. Influence of subtherapeutic chlortetracycline and dietary protein on circulating concentration of insulin-like growth factor-1 in growing beef steers[J]. Journal of Animal & Veterinary Advances,2003,2(9):531-535.
[8]Visek W J. The mode of growth promotion by antibiotics[J]. Journal of Animal Science,1978,46(5):1447-1469.
[9]Reeks B Y,Champlin F R,Paulsen D B,et al. Effects of sub-minimum inhibitory concentration antibiotic levels and temperature on growth kinetics and outer membrane protein expression inMannheimiahaemolyticaandHaemophilussomnus[J]. Canadian Journal of Veterinary Research,2005,69(1):1-10.
[10]Rumsey T S,McLeod K,Elsasser T H,et al. Performance and carcass merit of growing beef steers with chlortetracycline-modified sensitivity to pituitary releasing hormones and fed two dietary protein levels[J]. Journal of Animal Science,2000,78(11):2765-2770.
[11]ReidE D,Erickson PS,HodgdonS,etal.Chlortetracycline
supplementation of yearling dairy heifers[J]. Journal of Animal Science,2006,84(9):2406-2409.
[12]马玉龙,许梓荣,刘波静. 金霉素对肉鸡肠道菌群、pH值、乳酸和挥发性脂肪酸浓度的影响[J]. 中国畜牧杂志,2004,40(8):27-29.
[13]杨保奎,刘信宝,沈益新,等. 不同青贮饲料对肉牛生长性能及血清生化指标的影响[J]. 畜牧与兽医,2016(11):5-9.
[14]Alberghina D,Giannetto C,Vazzana I,et al. Reference intervals for total protein concentration,serum protein fractions,and albumin/globulin ratios in clinically healthy dairy cows[J]. Journal of Veterinary Diagnostic Investigation,2011,23(1):111-114.
[15]宋巴达玛. 沙葱多糖对肉羊免疫机能和抗氧化作用的影响[D]. 呼和浩特:内蒙古农业大学,2010.
[16]范天宝. 复方黄芪对肉鸡免疫功能及抗氧化功能的影响[D]. 哈尔滨:东北农业大学,2013.
[17]王腾浩. 新型丁酸梭菌筛选及其对断奶仔猪生长性能和肠道功能影响的研究[D]. 杭州:浙江大学,2015.
[18]姜卫星,袁文军,李 伟,等. 中草药添加剂对育肥猪生长性能和免疫功能的影响[J]. 中国畜牧兽医,2011,38(5):15-19.
[19]Dröge W. Free radicals in the physiological control of cell function[J]. Physiological Reviews,2002,82(1):47-95.
[20]Donoho A L. Biochemical studies on the fate of monensin in animals and in the environment[J]. Journal of Animal Science,1984,58(6):1528-1539.
[21]Halling-Sørensen B,Sengeløv G,Tjørnelund J. Toxicity of tetracyclines and tetracycline degradation products to environmentally relevant bacteria,including selected tetracycline-resistant bacteria[J]. Archives of Environmental Contamination and Toxicology,2002,42(3):263-271.
