CT能谱成像对肺磨玻璃密度结节浸润前病变与微浸润腺癌的鉴别诊断价值
2018-06-28范恒鑫樊树峰张忠伟
范恒鑫 樊树峰 张忠伟
随着多层螺旋CT的普及和发展,肺磨玻璃密度结节(ground-glass nodule,GGN)的检出率不断增加。长期持续存在的GGN与肺腺癌的发生密切相关[1],GGN有无发生浸润以及浸润程度的不同与治疗方式的选择和预后密切相关[2]。CT能谱成像可将传统的X线混合能量图像分解成单能量图像,进行物质分离和定量测定[3],为病变的影像定量和鉴别提供新的方法和思路。其在肺内外病变的鉴别诊断和肿瘤治疗疗效评估中均有较好的应用,但在GGN CT能谱成像特征与病理的相关性研究中较少报道。本研究探索CT能谱成像参数定量分析对浸润前病变[包括非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原位腺癌(adenocarcinoma in situ,AIS)]和微浸润腺癌(minimally invasive adenocarcinoma,MIA)的鉴别诊断价值,现将结果报道如下。
1 对象和方法
1.1 对象 选取2016年2月至2017年12月经本院病理证实的GGN患者127例,男49例,女78例;年龄28~81(53±10)岁。其中 AAH+AIS 组 51 例,男 24 例,女27 例;年龄 31~71(53±8.8)岁。MIA 组 76 例,男 25 例,女 51 例;年龄 28~81(54±10.9)岁。纳入标准:(1)有完整的病理资料及CT能谱成像靶扫描检查结果;(2)无严重影响测量参数的疾病,如严重肺气肿。排除标准:(1)病灶最大径>3cm;(2)CT图像有较大的呼吸运动伪影或肋骨硬化伪影;(3)病灶最大平面可测量直径<2mm。本研究经医院伦理委员会批准和患者知情同意。
1.2 扫描方法 所有患者均采用美国GE公司Discovery 750HD CT扫描仪进行检查。扫描前行严格呼吸训练,先行常规CT胸部扫描,扫描范围从胸廓入口处至膈肌上方,对结节定位后行靶扫描,靶扫描采用能谱扫描模式(GSI)。GSI扫描参数:电压80和140kVp瞬时(0.5ms)切换,管电流550mA,机架旋转时间0.8s/周,螺距0.984:1,探测器宽度40mm,层厚、层间隔均0.625mm,矩阵 512×512,视野 20cm×20cm。
1.3 图像处理和数据收集 将CT能谱扫描原始数据传至ADW 4.5工作站,用GSI扫描软件分析处理。由2位具有10年以上肺部影像诊断工作经验的医师在不知道病理结果的情况下进行观察测量,多平面分析图像上避开肉眼可见血管、支气管及空泡影,选取肉眼可见的密度相对较高磨玻璃密度区域多点测量,以CT值测量稳定区域为感兴趣区,然后测量相应水基值及40、50、60、70 KeV 单能量图像的 CT 值(CT40KeV、CT50KeV、CT60KeV、CT70KeV),多平面测量结节最大径(Dmax),取2位测量者测量结果平均值。获取能谱曲线,计算能谱曲线斜率
1.4 统计学处理 采用SPSS 23.0统计软件。符合正态分布的计量资料以表示;不符合正态分布的计量资料以 M(P25,P75)表示,组间比较采用 Wilcoxon 符号秩和检验。计数资料组间比较采用χ2检验。采用ROC曲线评价参数诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者结节空泡征、胸膜凹陷差异分析 127例GGN中,出现空泡征者20例,其中AAH+AIS组6例,MIA组14例,两组比较差异无统计学意义(P>0.05);出现胸膜凹陷者23例,其中AAH+AIS组4例,MIA组19例,两组比较差异有统计学意义(P<0.05)。
2.2 两组患者定量参数分析 两组患者 Dmax、CT70KeV、水基值和λHU比较差异均有统计学意义(均P<0.05),见表1。Dmax分段统计显示,结节直径>1.0cm时AAH+AIS明显减少,结节最大径>1.50cm者均为MIA,见表2。
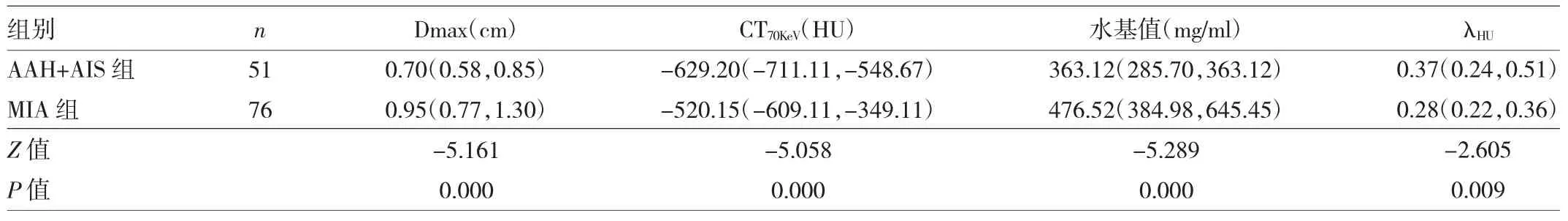
表1 两组患者定量参数分析
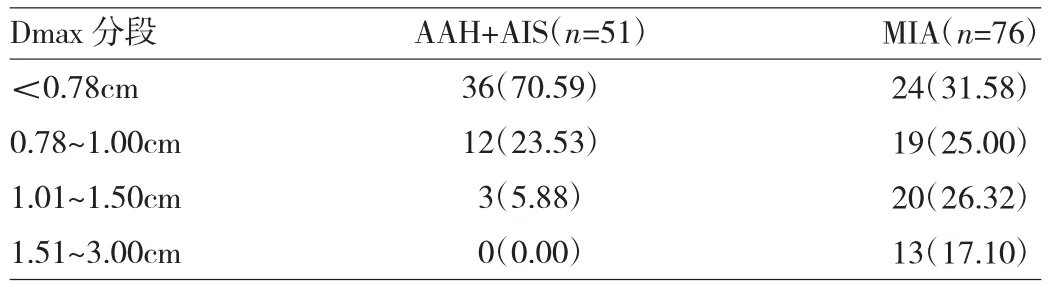
表2 Dmax分段分布情况[例(%)]
2.3 ROC曲线分析 Dmax诊断最佳临界值为0.780cm,AUC为0.771,灵敏度为0.711,特异度为0.725。CT70KeV诊断最佳临界值为-560.035HU,AUC为0.765,灵敏度为0.680,特异度为0.720。水基值诊断最佳临界值为388.847mg/ml,AUC 为 0.777,灵敏度为 0.750,特异度0.667。λHU对AAH+AIS和MIA的诊断效能不佳,见图1。
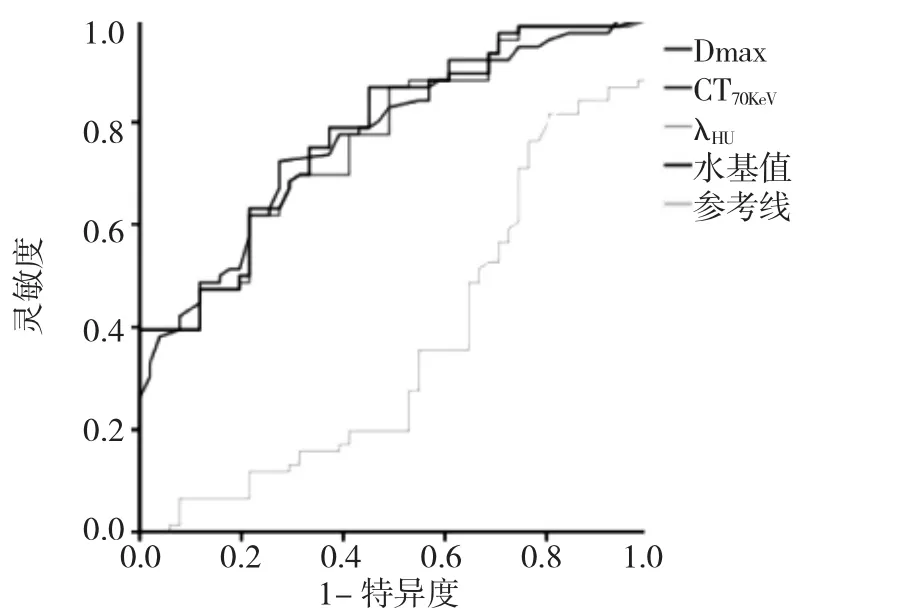
图1 AAH+AIS组与MIA组Dmax、CT70KeV、水基值和λHU的 ROC曲线分析
3 讨论
本研究纳入的GGN中胸膜凹陷仅在AIS和MIA中出现,AAH中无一例出现胸膜凹陷。胸膜凹陷主要由病灶内间质纤维组织收缩引起,因此AIS和MIA中可出现胸膜凹陷,而在缺乏间质纤维组织增生的病变(如 AAH)则较少见[4]。
空泡征为扩张的细支气管或残留的过度充气的肺泡。本研究中两组空泡出现率比较差异无统计学意义,这与既往部分研究结果相符[5-6],可见空泡征的出现尚不能作为浸润前后病变的鉴别诊断依据。
结节大小是评价GGN有无发生浸润的一个重要指标。本研究显示MIA组Dmax大于AAH+AIS组,诊断最佳临界值0.780cm,AUC为0.771,灵敏度为0.711,特异度为0.725。与既往研究报道的GGN浸润前后Dmax临界值0.75~1.20cm相符合[6-8]。本组GGN中Dmax>1cm时AAH+AIS所占比例明显减少,>1.5cm者均为MIA。
通常X线能量越低,穿透能力越低,图像的组织对比度增加,低的单能量图像较混合能量或高能量图像更能反映不同密度组织病变的差异[9]。研究显示70KeV能量水平图像对比度较高,噪声较低,肺内肿块性质及病变类型的诊断效能更优[10]。本研究AAH+AIS组和MIA组CT70KeV差异有统计学意义,诊断最佳临界值-560.035HU,AUC为0.765,灵敏度为0.680,特异度为0.720。Mao等[11]对15例GGN进行CT与病理对照研究发现,GGN中肿瘤成分每增加10%,平均CT值就增加约100HU。本研究CT70KeV值在两组病变中的诊断效能与既往常规CT值诊断效能相仿,提示单能量CT值有望为GGN浸润程度的鉴别提供有价值的精准诊断信息。
不同能量X线束穿过物质后形成的CT值衰减曲线称为能谱曲线,不同结构和病理组织类型对应特征性X线衰减曲线[10]。本研究中两组λHU比较差异有统计学意义且AAH+AIS组大于MIA组,推测AAH+AIS组组织病理学仅为肿瘤细胞单纯贴壁生长密度较均匀,与病灶内微小血管的密度差异较大,MIA组中浸润成分细胞密度较单纯贴壁者增加,与结节内微小血管差异减小,感兴趣区内组织密度趋向均匀,因而λHU较AAH+AIS组更较接近0,但诊断效能不佳,有待联合MIA与浸润性腺癌病变的大量样本进一步研究。
人体从软组织到骨骼都含有水,水是和人体物质组成最相近的一种物质,因此本研究选择常规的碘-水基物质为研究对象,相对准确、客观地反映病变特点[11]。本研究中MIA组较AAH+AIS组水基值高,差异有统计学意义,诊断最佳临界值388.847mg/ml,AUC为0.777,灵敏度为0.750,特异度0.667。推测随着肿瘤浸润程度的增加,结节内肿瘤细胞密度逐渐增加,水基值逐渐增加。
综上所述,CT能谱成像参数定量分析在GGN浸润前后病变的精准诊断中有潜在的临床应用价值,有望为GGN的术前定量CT诊断提供新方法。但本研究尚存在一定的不足:(1)样本量相对较少,需要在未来的研究中进一步扩大样本验证本研究结果;(2)本研究为单中心研究且受时间限制,患者的入组不可避免存在一定的偏倚;(3)缺少与表现为GGN的良性病变的横向对照来进一步验证本研究的可靠性。
[1]Tamura M,Shimizu Y,Yamamoto T,et al.Predictive value of one-dimensional mean computed tomography value of groundglass opacity on high-resolution images for the possibility of future change[J].J Thorac Oncol,2014,9(4):469-472.doi:10.1097/JTO.0000000000000117.
[2]王群,蒋伟,奚俊杰.肺部多发磨玻璃影的外科治疗[J].中国肺癌杂志,2016,19(6):355-358.doi:10.3779/j.issn.1009-3419.2016.06.11.
[3]张晓鹏.探索的精神与乐趣-CT能谱成像临床应用研究中的思考[J].中华放射学杂志,2011,45(8):709-712.doi:10.3760/cma.j.issn.1005-1201.2011.08.001.
[4]蔡楚逸,顾浩,何广友,等.MSCT对伴周围磨玻璃影的空腔型肺癌的诊断价值[J].实用放射学杂志,2018,34(2):203-206.doi:10.3969/j.issn.1002-1671.2018.02.10.
[5]潘江峰,邝平定,应明亮,等.肺部纯磨玻璃结节浸润性肺腺癌与浸润前病变的高分辨靶扫描CT鉴别诊断[J].浙江医学,2016,38(11):826-828,832.
[6]Ding H,ShiJ,Zhou X,et al.Value of CTcharacteristics in predicting invasiveness of adenocarcinoma presented as pulmonary ground-glass nodules[J].Thoracic&Cardiovascular Surgeon,2017,65(2):136-142.doi:10.1055/s-0036-1587592.
[7]Li Q,Fan L,Cao ET,et al.Quantitative CT analysis of pulmonary pure ground-glass nodule predicts histological invasiveness[J].European Journal of Radiology,2017,89:67-71.doi:10.1016/j.ejrad.2017.01.024.
[8]Si MJ,Tao XF,Du GY,et al.Thin-section computed tomography-histopathologic comparisons of pulmonary focal interstitial fibrosis,atypical adenomatoushyperplasia,adenocarcinoma in situ,and minimally invasive adenocarcinoma with pure ground-glass opacity[J].European Journal of Radiology,2016,85(10):170-177.doi:10.1016/j.ejrad.2016.07.012.
[9]Hou WS,Wu HW,Yin Y,et al.Differentiation of lung cancers from inflammatory masses with dual-energy spectral CT imaging[J].Academic Radiology,2015,22(3):337-344.doi:10.1016/j.acra.2014.10.004.
[10]侯唯姝,殷焱,程杰军,等.能谱CT成像在鉴别周围型肺癌和肺炎性肿块中的价值[J].中华放射学杂志,2014,48(10):832-835.doi:10.3760/cma.j.issn.1005-1201.2014.10.010.
[11]Mao H,Labh K,Han F,et al.Diagnosis of the invasiveness of lung adenocarcinoma manifesting as ground glass opacities on high‐resolution computed tomography[J].Thoracic Cancer,2016,7(1):129-135.doi:10.1111/1759-7714.12269.
