分化型甲状腺癌术后TSH抑制治疗对骨密度的影响
2018-06-28邱海江方孙阳罗钧刚吴志明夏恒
邱海江 方孙阳 罗钧刚 吴志明 夏恒
分化型甲状腺癌(differentiated thyroid carcinoma,DTC)是最常见的内分泌恶性肿瘤,手术切除后采用促甲状腺激素(thyroid stimulating hormone,TSH)抑制治疗已成为常规治疗手段,即根据DTC的复发危险度分层[1]给予超过生理剂量的左甲状腺素,通过负反馈作用抑制TSH的生成,从而减少患者的远期复发风险。TSH抑制治疗可以引起患者骨质代谢的改变,但是否会影响DTC 患者的骨密度(bone mineral density,BMD),近年来国内外有许多研究,其结论尚存在争议。本研究从TSH抑制程度和抑制时间对DTC术后患者的BMD进行了分析,为设立合理的个体化术后管理目标提供临床依据,现将结果报道如下。
1 对象和方法
1.1 对象 选取2012年1月至2013年12月在本院治疗的DTC患者170例。其中男32例,年龄25~72(45.3±3.2)岁;根据DTC的复发危险度分层(下同)分为低危组7例,中、高危组25例。女138例,绝经前患者92 例,年龄 23~51(43.5±5.2)岁;低危组 20 例,中、高危组72例。绝经后患者46例,年龄49~78(55.7±4.5)岁;低危组11例,中、高危组35例。纳入标准:(1)根据《甲状腺结节和分化型甲状腺癌诊治指南》[1]提示的手术方式实施甲状腺切除手术;(2)病理证实为 DTC;(3)根据DTC的复发危险度分层,口服左甲状腺素钠片抑制治疗;(4)术后甲状旁腺功能正常;(5)营养状况良好;(6)无引起BMD减低的疾病史及药物史;(7)患者知情同意并通过医院伦理委员会审批。排除标准:(1)出现对侧或远处转移行再次手术者;(2)因心血管系统不良反应而不能耐受左甲状腺素抑制治疗者;(3)治疗随访期间失访者;(4)自行加服补钙剂者;(5)治疗随访期间发现其他影响骨代射疾病者;(6)不配合定期复查甲状腺功能或检测BMD者;(7)术前已存在骨质疏松者;(8)治疗期间出现绝经者。
1.2 方法 根据DTC患者的复发危险度分层,设立TSH抑制治疗的个体化目标。低危组患者TSH控制在0.1~0.5mU/L,中、高危组患者TSH<0.1mU/L。术后每4周检测血清TSH,当TSH达标后,术后1年内每2个月检测甲状腺功能、术后2年内每3个月检测甲状腺功能、术后3年内每6个月检测甲状腺功能。另分别于术前、术后 1、2、3 年测定股骨颈、髋关节及正位 L2、L4BMD,单位为g/cm2,采用双能X射线骨密度仪(美国GE公司,型号:Prodigy)。治疗期间动态复查患者甲状腺球蛋白、甲状腺及颈部淋巴结B超及肺部CT,同时观察患者TSH抑制治疗的不良反应,根据DTC患者的复发危险度和TSH抑制治疗的不良反应风险及时调整抑制目标。
1.3 统计学处理 采用SPSS 19.0统计软件。计量资料以表示,组间比较采用两独立样本t检验,组内比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 男性DTC患者不同时间点各检测部位BMD比较低危组术后1、2、3年各检测部位BMD与术前比较差异均无统计学意义(均P>0.05);中、高危组术后1、2年各检测部位BMD及术后3年L2、L4BMD与术前比较差异均无统计学意义(均P>0.05),但术后3年股骨颈、髋关节BMD与术前比较差异均有统计学意义(均P<0.05)。术后3年,低危组和中、高危组各相对应检测部位BMD比较差异均无统计学意义(均P>0.05),见表1。
2.2 绝经前女性DTC患者不同时间点各检测部位BMD比较 低危组和中、高危组术后1、2年各检测部位BMD及术后3年L2、L4BMD与术前比较差异均无统计学意义(均P>0.05),但两组术后3年股骨颈、髋关节BMD与术前比较差异均有统计学意义(均P<0.05)。术后3年,中、高危组股骨颈BMD较低危组明显减少,差异有统计学意义(P<0.05);而两组髋关节、L2、L4BMD比较差异均无统计学意义(均P>0.05),见表2。

表1 男性DTC患者不同时间点各检测部位BMD比较(g/cm2)
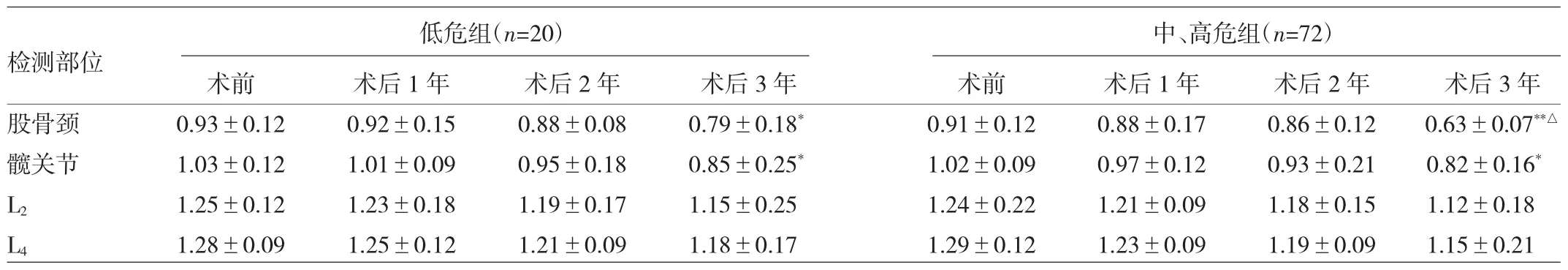
表2 绝经前女性DTC患者不同时间点各检测部位BMD比较(g/cm2)
2.3 绝经后女性DTC患者不同时间点各检测部位BMD比较 低危组术后1、2年各检测部位BMD与术前比较差异均无统计学意义(均P>0.05),术后3年各检测部位BMD较术前明显减少,差异均有统计学意义(均P<0.05)。中、高危组术后1年各检测部位BMD及术后2年L2、L4BMD与术前比较差异均无统计学意义(均P>0.05),但术后2年股骨颈、髋关节BMD及术后3年各检测部位BMD较术前明显减少,差异均有统计学意义(均P<0.05)。术后3年,中、高危组股骨颈、髋关节BMD较低危组明显减少,差异均有统计学意义(均P<0.05);而两组L2、L4BMD比较差异均无统计学意义(均P >0.05),见表 3。

表3 绝经后女性DTC患者不同时间点各检测部位BMD比较(g/cm2)
3 讨论
DTC是最常见的甲状腺恶性肿瘤,甲状腺切除、131I治疗和长期TSH抑制治疗是目前DTC的主要治疗手段。TSH主要通过作用于促甲状腺激素受体(thyroid stimulating hormone receptor,TSHR),形成配体-受体复合物,激活TSHR与G蛋白偶联,激活细胞内环磷酸腺苷(cAMP)信号通路,从而刺激癌细胞的生长[2]。Mazzaferri等[3]对1 528例DTC患者进行研究,发现初治后40年内复发率约为35%,其中2/3发生在初治后10年内。因此,DTC患者在术后10年内给予TSH抑制治疗是避免肿瘤复发和转移,降低病死率的重要措施。Mazzaferri等[3]研究显示TSH抑制治疗可使肿瘤直径≥1.5cm的DTC患者术后复发率显著降低,最高降幅达18%。Mc Griff等[4]研究发现TSH抑制治疗使DTC患者复发和死亡风险下降27%,显著提高了DTC患者的总体生存率。Jonklaas等[5]研究11个治疗中心共同参与的登记资料显示,TSH抑制治疗显著延长了DTC患者的总体生存时间。
尽管TSH抑制治疗的作用已得到公认,但长期TSH抑制治疗可导致机体内环境发生改变,打破成骨细胞和破骨细胞的动态平衡,干扰骨代谢过程,使部分患者BMD受到影响。Abe等[6]研究发现,成骨细胞与破骨细胞均可表达TSHR,TSH对BMD的影响通过TSHR介导,TSHR减少可导致骨质疏松症的发生。相反,TSHR的过度表达可抑制破骨细胞的生成。同时,Abe等[6]研究发现TSH可以通过破骨细胞分化因子(RANKL)的JNK/C-jun和NF-κB信号通路抑制破骨细胞的形成和存活,TSH抑制治疗后,对破骨细胞的形成和存活抑制作用减弱,从而影响BMD。Yamoah等[7]研究证实TNF-α与BMD呈负相关。TSH通过促使高迁移率蛋白1(HMGB1)及高迁移率蛋白2(HMGB2)与TNF-α基因启动因子结合来抑制TNF-α的生成。
Reverter等[8]研究显示TSH抑制治疗不会对男性患者的BMD造成明显的影响。本研究显示低危组患者TSH抑制治疗后不同时间点各检测部位BMD无改变,不会对男性患者的BMD产生影响。中、高危组TSH抑制治疗后1、2年,各检测部位BMD无改变,术后3年L2、L4BMD无改变,股骨颈、髋关节BMD检测示BMD减少,提示随着TSH抑制程度和抑制时间的不同,对机体不同部位的BMD的影响存在一定的差异,对股骨颈、髋关节影响较大。这是由于股骨颈及髋关节处以皮质骨为主,腰椎以松质骨为主,皮质骨中破骨细胞较松质骨活跃,受甲状腺激素影响更明显[9]。因入组男性患者相对较少,本研究未对入组患者进行年龄段分层次研究,有待样本量的增加作进一步统计分析。
TSH抑制治疗对绝经前女性DTC患者BMD的影响存在争议。Wang等[10]研究表明绝经前女性行TSH抑制治疗平均6.5年后,出现术后骨质疏松的风险增加了4倍。而另外一项研究发现,绝经前女性行TSH抑制治疗平均 5.6年后,脊椎、股骨颈Ward三角处的BMD未见差异[11]。其他横向研究也并未发现TSH抑制治疗对绝经前女性患者的BMD造成明显影响[12]。本研究显示不同水平的TSH抑制,不会减少L2、L4的BMD,但在3年后能减少股骨颈、髋关节的BMD,尤其是中、高危患者,TSH抑制治疗对股骨颈BMD影响较低危组更显著。本研究提示TSH水平与时间存在交互作用,推测接受越长时间的TSH抑制治疗,绝经前女性DTC患者股骨颈、髋关节的BMD下降情况会越明显,尤其对于中、高危患者,随访过程中要密切关注风险,定期监测患者的BMD,并采取合适的干预措施。
Baqi等[13]研究表明TSH抑制治疗对绝经后女性BMD影响较为明显。一方面,绝经后女性运动能力下降,骨骼的重建速率下降;另一方面,性激素的变化,尤其是雌激素分泌减少,垂体分泌的卵泡刺激素(folliclestimulating hormone,FSH)会代偿性增加,改变了骨代谢的平衡。Sowers等[14]对237例绝经后女性进行研究,发现FSH通过与破骨细胞的卵泡刺激素受体结合直接促进其生长及活动,进而促进骨吸收。同时,FSH还会释放破骨细胞生长因子 IL-1β、TNF-α,间接促进破骨细胞的生长,降低BMD。本研究显示TSH抑制治疗对绝经后女性影响较绝经前女性明显增加,无论TSH抑制水平高低,其骨量丢失情况远比绝经前女性明显,第2年就出现BMD减少,尤其对股骨颈、髋关节的影响更明显。对于绝经后女性,在TSH抑制治疗的同时应接受抗骨质疏松的初级预防,保证钙离子摄入。
DTC患者大多预后良好,随着TSH抑制水平与时间的交互作用,对BMD的远期影响不容忽视。DTC患者术后TSH抑制时间越长,TSH抑制水平越低,BMD减少越明显。TSH抑制治疗对股骨颈、髋关节BMD的影响较腰椎BMD的影响更加明显。
[1]中华医学会内分泌学分会,中华医学会外科学分会.甲状腺结节和分化型甲状腺癌诊治指南[J].中国肿瘤临床,2012,39(17):1249-1272.doi:10.3969/j.issn.1000-8179.2012.17.003.
[2]Bassett JH,Williams GR.Critical role of the hypothalamic-pituitary-thyroid axis in bone[J].Bone,2008,43(3):418-426.doi:10.1016/j.bone.2008.05.007.
[3]Mazzaferri EL,Kloos RT.Current approaches to primarytherapy for papillary and follicular thyroid cancer[J].Clin EndocrinolMetab,2001,86(4):1447-1463.doi:10.1210/jc.86.4.1447.
[4]Mc Griff NJ,Csako G,Gourgiotis L,et al.Effects of thyroidhormone suppression therapy on adverse clinicaloutcomesin thyroid cancer[J].Ann Med,2002,34(7-8):554-564.doi:10.1080/0785389 02321117760.
[5]Jonklaas J,Sarlis NJ,Litofsky D,et al.Outcomes of patients with differentiated thyroid carcinoma following initial therapy[J].Thyroid,2006,16(12):1229-1242.doi:10.1089/thy.2006.16.1229.
[6]Abe E,Marians RC,Yu W,et al.TSH is a negative regulator of skeletal remodeling[J].Cell,2003,115(2):151-162.doi:10.1016/S0092-8674(03)00771-2.
[7]Yamoah K,Brebene A,Baliram R,et al.High-mobility group box proteinsmodulate tumor necrosis factor-alpha expression in osteoclastogenesis via a novel deoxyribonucleic acid sequence[J].Mol Endocrinol,2008,22(5):1141-1153.doi:10.1210/me.2007-0460.
[8]Reverter JL,Colome E,Holgado S,et al.Bone mineraldensity and bone fracture in male patients receivinglong-termsuppressive levothyroxine treatment for differentiated thyroid carcinoma[J].Endocrine,2010,37(3):467-472.doi:10.1007/s12020-010-9339-z.
[9]Mosekilde L,Eriksen EF,Charles P.Effects of thyroid hormoneson bone and mineralmetabolism[J].Endocrinol Metab ClinNorth Am,1990,19(1):35-63.
[10]Wang LY,Smith AW,Palmer FL,et al.Thyrotropin suppression increasesthe risk of osteoporosis without decreasing recurrence in ATA low-and intermediate-risk patients with differentiated thyroid carcinoma[J].Thyroid,2015,25(3):300-307.doi:10.1089/thy.2014.0287.
[11]Jodar E,Begona LM,Garcia L,et al.Bone changes in pre-and postmenopausal women with thyroid canceron levothyroxine therapy:evolution of axial and appendicular bone mass[J].Osteoporos Int,1998,8(4):311-316.doi:10.1007/s001980050069.
[12]Chen CH,Chen JF,Yang BY,et al.Bone mineraldensity in women receiving thyroxinesuppressive therapy for differentiated thyroid carcinoma[J].Formos Med Assoc,2004,103(6):442-447.
[13]Baqi L,Payer J,Killinger Z,et al.The level of TSH appeared favoura-ble in maintaing bone mineral density in postmenopausal women[J].Endocr Regul,2010,44:9-15.doi:10.4149/endo_2010_01_9.
[14]Sowers MR,Greendale GA,Bondarenko I,et al.Endogenoushormones and bone turnover markers in pre-and perimenopausalwomen:SWAN[J].Osteoporos Int,2003,14(3):191-197.doi:10.1007/s00198-002-1329-4.
