黄腐酸及人参皂苷Rg1对蛋白磷酸酯酶2A影响的初步研究
2018-06-26张彩凤刘志帆邓晨华刘翠仙
张彩凤 刘志帆 宋 珍 袁 雯 李 林 邓晨华 刘翠仙
1 太原师范学院化学系 太原 030619
2 山西省腐植酸工程技术研究中心 太原 030619
3 太原师范学院物理系 太原 030619
腐植酸广泛应用于人类生活中,不仅在农业方面发挥举足轻重的作用,也是中华医药的“绿色宝藏”,对发展腐植酸医药健康产业具有重大意义[1]。腐植酸有很多种类,是一种多孔性的亲水胶体,稳定性强,具有良好的杀菌效果,可以减少机体内毒素,加速细胞消肿和消炎。腐植酸含有多种可溶于水、酸、碱、乙醇和丙酮的反应性官能团,能够激活凝血酶,促进细胞凝血,使其有效治疗外伤出血。
黄腐酸是腐植酸中活性较高的成分,能促进动物营养的吸收。当无机盐与黄腐酸接触时,在水介质中以离子形式存在,具有生物活性[2]。因此,当无机盐通过黄腐酸和光合作用的自然化学过程转化为有机体的一部分时,它们对人类和动物都是安全的。许多研究表明,黄腐酸被人体吸收之后,在养分转化方面具有一定的促进作用,例如黄腐酸能激活消化酶;同时,黄腐酸可以降低自由基的氧化能力;也有研究表明,黄腐酸可以缓解氧气不足,呼吸不畅,刺激肌细胞活性增加[3]。
三七是四十种大宗药材品种之一,在国内外应用广泛,具有“止血活血”效用[4]。人参皂苷Rg1是三七中40多种皂苷单体之一,在神经系统中有显著作用,主要体现在对智力的影响,通过改善记忆功能和认知障碍,诱导神经细胞兴奋,舒缓其凋亡能力。人参皂苷Rg1在抗肿瘤、抗老化、抗疲劳和抗抑郁等方面表现其药理活性[5]。大量数据还表明,人参皂苷Rg1对治疗动物中枢神经系统疾病有作用,可影响皮质、海马、纹状体、下丘脑等脑区[6~9]。人参皂苷Rg1还可以增加蛋白磷酸酯酶2A(Protein phosphatase2A,PP2A)的活性。据曾育琦等[10]人报道,广泛存在于人体内的PP2A活性的增强可以减少tau蛋白的过度磷酸化,以防治阿尔茨海默病(Alzheimer disease)。黄腐酸可能像PP2A一样,是一种刺激动物体内酶活性的生物刺激素。
我们提出两个假设,第一:黄腐酸可以与PP2A相互作用,第二:黄腐酸能对人参皂苷Rg1和PP2A的复合物发生作用。为了验证这两种假设,借助Discovery Studio 4.5软件平台从微观角度出发,将黄腐酸、人参皂苷Rg1和PP2A进行对接模拟和动力学模拟,通过分子对接(Molecular Docking)、溶剂化(Molecular Dynamics)、结合能计算模拟(Calculate Binding Energy)分析和探讨黄腐酸促进PP2A形成的机制,并进一步验证黄腐酸对人参皂苷Rg1和PP2A复合物的作用机制。
1 材料与方法
1.1 实验材料
黄腐酸3D图和人参皂苷Rg1 3D图都源自小分子结构数据库(PubChem),PP2A的3D模型则源自蛋白质结构数据库(PDB)。选大鼠体内PP2A来近似代替所有动物体内蛋白质结构验证假设。
1.2 材料的优化处理
首先将从小分子结构数据库(PubChem)中下载的黄腐酸分子和人参皂苷Rg1分子进行优化处理,通过在Small Molecules中优化(Full Minimization),使其得到能量最小化结果。进行Prepare or Filter Ligands面板中的Prepare Ligands操作,使其找到配体分子的全部同分异构体,完成配体分子对接(Molecular Docking)前的准备。
对于从蛋白质结构数据库(PDB)中下载的PP2A,首先除去蛋白质原有的配体,腾出其空腔位置,并除去其中的水分子,使其更易于观察。然后找到macromolecules下的Prepare Protein面板,点击Prepare Protein,使系统自动补全蛋白残基结构并做加氢处理,使其易于形成氢键,最后通过点击Ligands Groups下的From Current Selection选项,软件将自动锁定PP2A的活性作用位点(该部分与配体结合的可能性最大,一般为蛋白质的空腔部分),为进一步的分子对接做好准备。
1.3 实验方法
1.3.1 实验所用软件
美国Accery公司自主研发的Discovery Studio 4.5是计算机分子模拟软件。它对生命科学领域的研究具有重要作用,为科学家提供易用的蛋白质模拟、药物的设计与优化工具。通过高质量的图形界面,经过多年验证和集成环境的科学算法,Discovery Studio将实验数据的保存和管理与专业标准的建模和仿真工具相结合,为研究队伍的合作与信息共享提供平台[11]。Discovery Studio的主要模拟功能包括:(1)生物大分子,蛋白进化分析、蛋白质三维结构的预测与模拟、膜蛋白结构的预测与模拟、抗体结构的预测与模拟等;(2)计算化学,分子力学计算和分子动力学模拟、拉伸分子动力学模拟、量子力学/分子力学(QM/MM)计算等;(3)基于目标结构的药物设计,基于靶标结构的化合物虚拟筛选、全新药物设计、药靶作用机制解释、分子对接、基于片段的药物设计与改造等;(4)基于配体的药物设计,完全基于配体的药效团设计、基于配体-受体复合物的药效团设计、化合物数据库的构建和筛选、药效团数据库的构建与保存、基于药效团数据库的反向找靶等。基于上述模拟功能,Discovery Studio 4.5的应用主要覆盖了医学、化学和生物学,具有很大的应用前景。
1.3.2 分子对接
分子对接是一种利用受体特征和配体与药物分子相互作用的设计方法。基于配体和受体之间的“锁-钥原理”(lock and key principle),模拟配体与受体的相互作用。配体与受体之间的相互作用是分子识别的过程,主要包括静电相互作用、氢键作用等。通过计算binding energy能预测二者之间的结合自由能,Ligand Interaction能预测结合方式,并且可以进行药物的虚拟筛选。
将分子对接方法分为LibDOCK(基于热区匹配的刚性分子对接)、LigandFit(基于几何形状匹配的半柔性分子对接)、CDOCKER(基于能量最低原则的分子对接)、Flexibledock(全柔性受体-配体对接)。
1.3.3 小分子与蛋白质对接
在实验研究中,小分子与大分子的对接方式应用CDOCKER对接方法,是基于CHARMm的对接程序,采用soft-core potentials以及optional grid representation将配体分子与受体活性作用位点进行对接,采用高温动力学、模拟退火的方法进行优化处理。此技术可以精确预测蛋白-配体相互作用关系[12,13]。研究所用的小分子为黄腐酸、人参皂苷Rg1,大分子为PP2A。打开已经优化处理的配体和受体,运用CDOCKERD对接技术即可完成分子对接,在Report中即可显示对接后信息。
1.3.4 分子动力学模拟
分子动力学(Molecular Dynamics,DS)是分子模拟中常用的方法之一,分析复合物等多种分子在不同环境和状态下的热力学及动力学特性,能够动态研究配体的结合过程,预测受体-配体结合自由能。
分别将黄腐酸-PP2A和人参皂苷Rg1-PP2A加入溶剂环境中,protocol中找到溶剂(solvent),并点击打开面板,设置好相关的参数,数分钟得到加入溶剂体系图,设置束缚体系,设置Dynamics文件夹下Standard Dynamics Cascade流程,运行得到温度图和能量图。
1.3.5 相关能量计算
在分子窗口打开配体、受体或者已对接完成的复合物,在工具栏中展开Receptor-Ligand Interactions选项,点击Calculate Binding Energy,即可计算结合自由能。
在对接结果表格视图中显示Cdocker Interaction Energy,此数值代表对接效果可靠与否。
1.4 数据处理
运行完成后,在Report中显示对接信息,点击View Result,即可查看分子视图,点击view interaction面板下的ligand interaction,显示配体和受体之间的作用,在分子窗口中选中某一条虚线,在DS界面的左下方就会显示该键合作用类型及距离等相关信息,距离的单位为埃(
也可点击show 2D diagram全部显示结合键的类型,分析结果并进行处理。
2 结果与讨论
2.1 黄腐酸-PP2A的复合物和人参皂苷Rg1-PP2A的复合物及其动力学模拟结果
从小分子数据库得到黄腐酸分子结构(图1为黄腐酸分子结构2D图,图2为黄腐酸分子结构3D图)。从图中发现,黄腐酸含有羟基、羰基和羧基含氧官能团等多种活性官能团,这些官能团使黄腐酸易于形成氢键。图3为黄腐酸的氢键作用图示,粉红部分有羟基存在,能够给出氢;绿色部分有羰基和含氧环,能接受氢。

图1 黄腐酸分子结构(2D)Fig.1 The molecular structure of fulvic acid (2D)
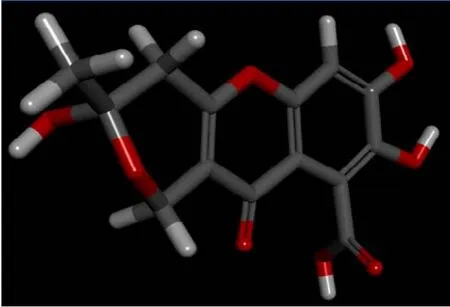
图2 黄腐酸分子结构(3D)Fig.2 The molecular structure of fulvic acid (3D)
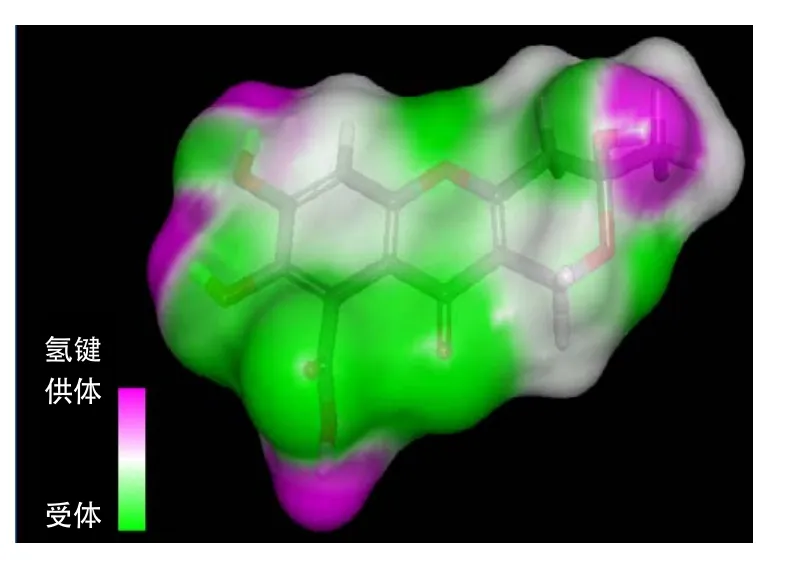
图3 黄腐酸分子中形成氢键作用区域Fig.3 The area of fulvic acid which can form hydrogen bonds
图4为人参皂苷Rg1分子结构2D图,图5为人参皂苷Rg1分子结构3D图,均从小分子结构数据库得到。分子结构表明人参皂苷Rg1含有羟基、分子内氢键、含氧环,使得人参皂苷Rg1很容易与某些物质形成氢键。图6为人参皂苷Rg1的氢键作用图示。
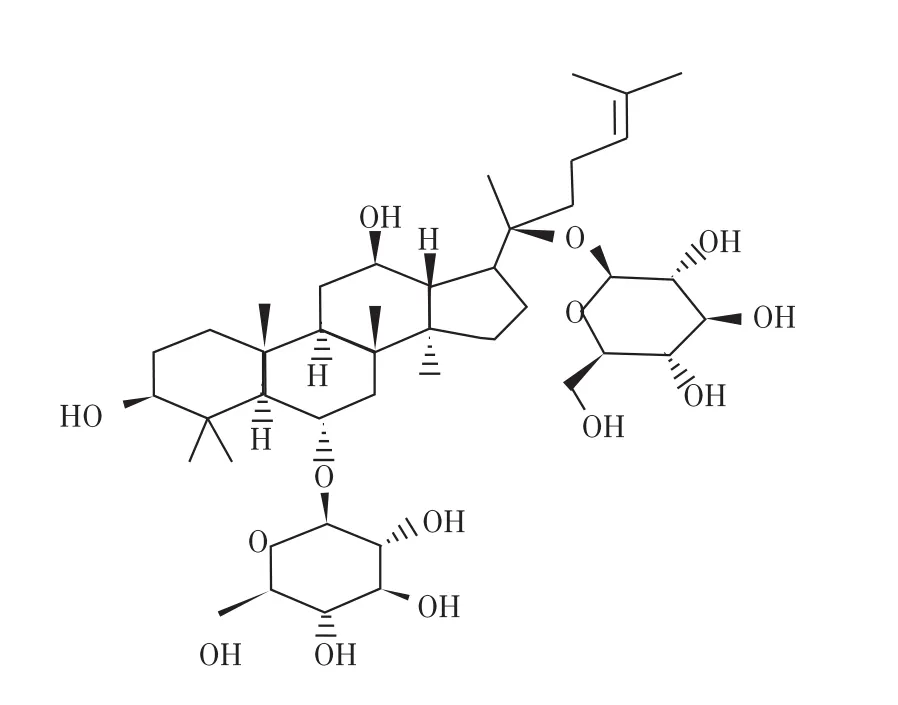
图4 人参皂苷Rg1分子结构(2D)Fig.4 The molecular structure of ginsenoside Rg1 (2D)

图5 人参皂苷Rg1分子结构(3D)Fig.5 The molecular structure of ginsenoside Rg1 (3D)

图6 人参皂苷Rg1分子中形成氢键作用区域Fig.6 The area of ginsenoside Rg1 which can form hydrogen bonds
图7为从蛋白质结构数据库PDB中得到的磷酸酯酶2A(PP2A),图8为通过优化后的PP2A非活性构象图,图9为PP2A活性位点图,红色区域代表最大可能的结合位点。
图10为人参皂苷Rg1和PP2A通过CDOCKER对接技术的结果,结合能为-98.8523 kcal/mol。图11显示黄腐酸和PP2A通过CDOCKER对接技术的结果,结合能为-13.9682 kcal/mol。
图12为人参皂苷Rg1与PP2A对接的氢键区域图。图13为人参皂苷Rg1与PP2A对接之后的键合作用图。可以看出,PP2A的B链上207位组氨酸、113位天冬氨酸和C链上的300位缬氨酸、301位苏氨酸与人参皂苷Rg1分子形成氢键;B链上110位辅氨酸、206位谷氨酸则形成碳氢键;A链上257位色氨酸、B链上99位脯氨酸则形成π-烷基键;B链上104位苏氨酸和人参皂苷Rg1形成一对受体。此图表明人参皂苷Rg1与PP2A的键合作用与人参皂苷Rg1中的氢键、羟基和环上的氧有一定的关系。由此可以推断出,黄腐酸和人参皂苷Rg1分别与任一生物大分子进行对接或者与其他的有机物发生反应,关键在于所含的官能团。
图14为黄腐酸与PP2A对接的氢键区域图。图15为黄腐酸与PP2A对接之后的键合作用图。可以看出,PP2A的B链上99位脯氨酸和162位天冬氨酸与黄腐酸形成碳氢键;B链上100位丝氨酸、200位精氨酸与黄腐酸形成氢键;207位组氨酸则与黄腐酸形成π-π键;A链上258位精氨酸与黄腐酸之间存在静电作用。此图也表明黄腐酸与PP2A的键合作用与黄腐酸中羟基、羰基和环上的氧具有一定的关系。
图16和图17分别为人参皂苷Rg1与PP2A复合物、黄腐酸与PP2A复合物添加溶剂环境的图示,以达到模拟人体环境的目的。

图7 PP2A 3D构象Fig.7 The 3D conformation of PP2A

图8 优化后的PP2A的非活性构象Fig.8 The nonactive conformation of optimized PP2A
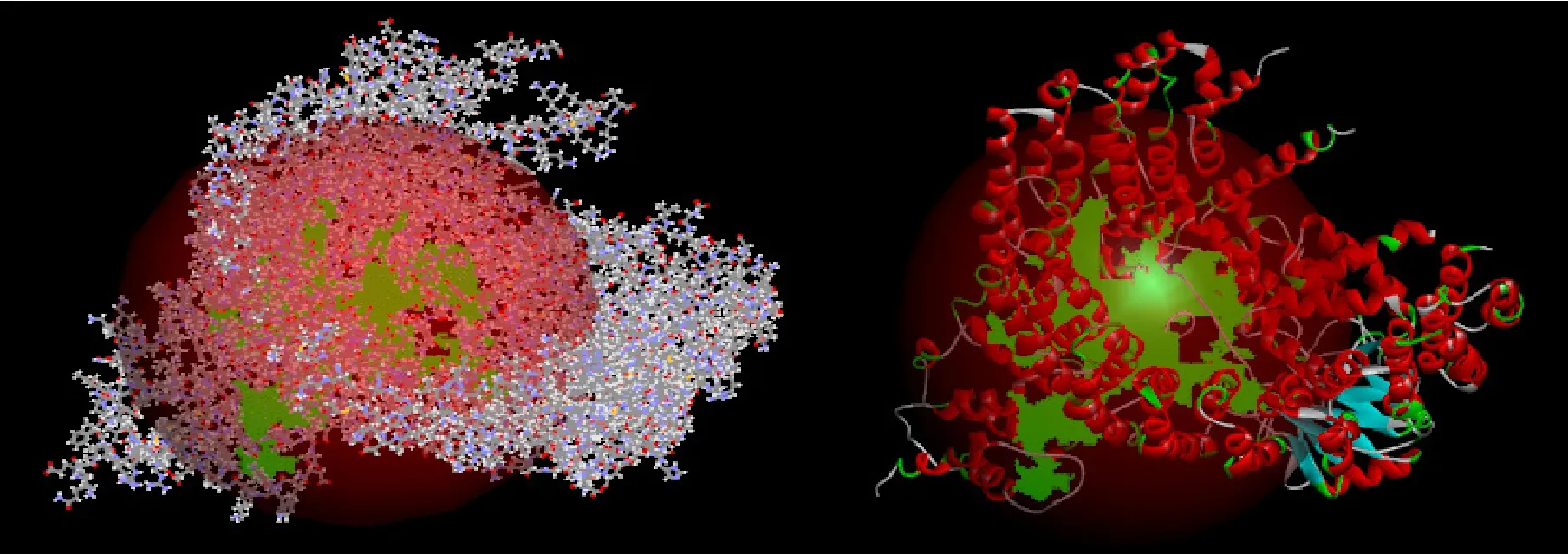
图9 PP2A的活性位点Fig.9 The active site of PP2A

图10 人参皂苷Rg1和PP2A对接结果Fig.10 The docking results of ginsenoside Rg1 and PP2A
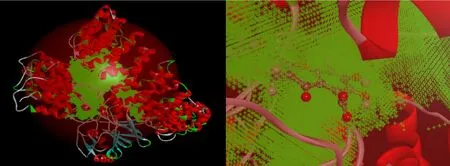
图11 黄腐酸和PP2A对接结果Fig.11 The docking results of fulvic acid and PP2A
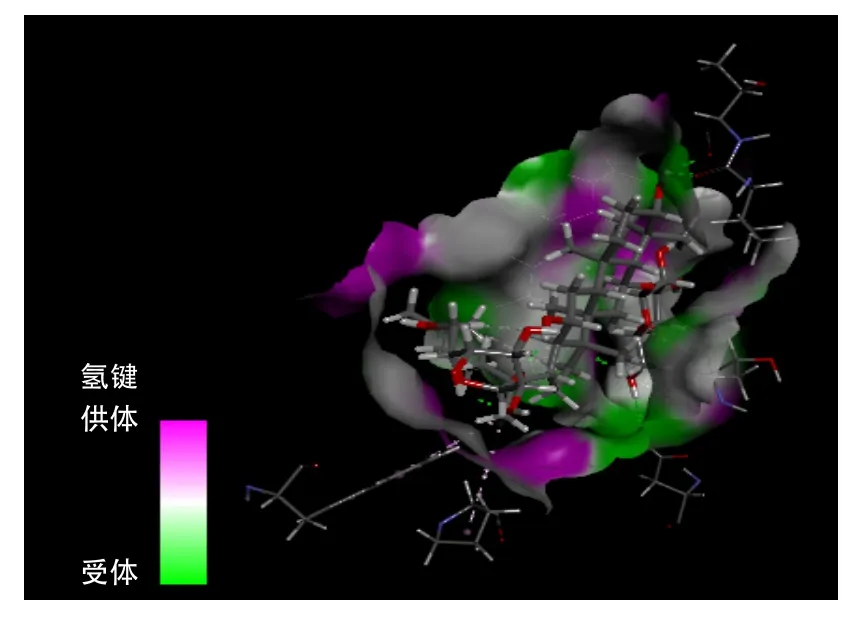
图12 人参皂苷Rg1与PP2A对接的氢键区域图Fig.12 Hydrogen bond map of ginsenoside Rg1-PP2A compound
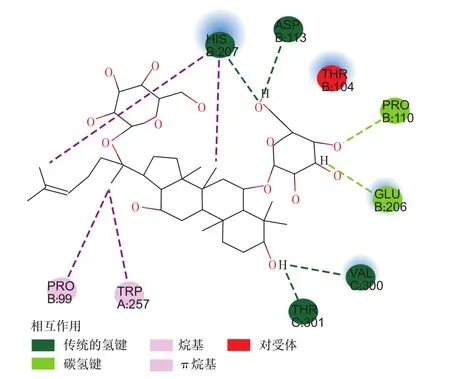
图13 人参皂苷Rg1与PP2A对接后的键合作用Fig.13 Bonding interaction of ginsenoside Rg1-PP2A compound
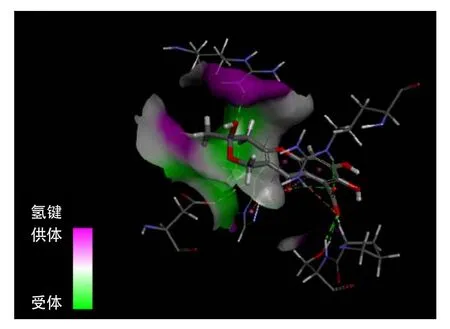
图14 黄腐酸与PP2A对接的氢键区域图Fig.14 Hydrogen bond map of fulvic acid-PP2A compound

图15 黄腐酸与PP2A对接后的键合作用Fig.15 Bonding interaction of fulvic acid-PP2A compound

图16 人参皂苷Rg1与PP2A复合物添加溶剂时的结果Fig.16 The result of addition solvention in ginsenoside Rg1-PP2A compound

图17 黄腐酸与PP2A复合物添加溶剂时的结果Fig.17 The result of addition solvention in fulvic-PP2A compound

图18 人参皂苷Rg1-PP2A复合物的动力学模拟Fig.18 Dynamics simulation of the ginsenoside Rg1-PP2A compound
图18显示人参皂苷Rg1-PP2A对接后进一步动力学模拟后的结果,由图可知在22 ps出现能量最低构象,结合能力更强。通过计算,结合能为-98.8523 kcal/mol。对照图13,人参皂苷Rg1与PP2A结合有氢键作用、静电作用和碳氢键作用等,使结合更稳定,同样促进PP2A的生成。图19为黄腐酸-PP2A对接后进一步动力学模拟后的结果。从中可知随着温度的增加,体系的总能量呈下降的趋势,在18 ps最低能量,构象有效,能够有效地反应真实情况。通过计算,结合能为-13.9682 kcal/mol。对照图15,对于PP2A,黄腐酸与之结合有氢键作用,静电作用和碳氢键作用等,刺激了PP2A的生物活性。通过结合能的计算,对接后人参皂苷Rg1-PP2A能量变化与黄腐酸-PP2A的相近,因此,间接推测黄腐酸也可作用于PP2A,并产生与人参皂苷Rg1相同的效果,以防治阿尔茨海默病。
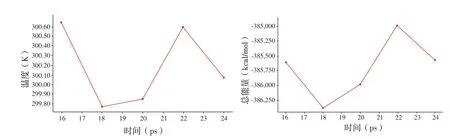
图19 黄腐酸-PP2A复合物的动力学模拟Fig.19 Dynamics simulation of the fulvic acid-PP2A compound
2.2 小分子-大分子复合物和结果分析
图20显示黄腐酸与人参皂苷Rg1-PP2A复合物的对接结果。图21和图22分别为对接的氢键区域图和对接后的键合作用图。通过软件计算可知:对接后的结合能为-107.3415 kcal/mol,对接前的结合能为-98.8523 kcal/mol,可以表明,对接后的结合能下降了。因此可以推断黄腐酸可以促进PP2A与人参皂苷Rg1的结合,从而可能防治阿尔茨海默病。
综上可知:预示黄腐酸能够促进PP2A的形成;黄腐酸也可能作用于人参皂苷Rg1和PP2A形成的复合物,提高人参皂苷Rg1与PP2A的作用能力,因为反应朝能量变低的方向进行,从而提高药理效果。

图20 黄腐酸与人参皂苷Rg1-PP2A复合物对接结果Fig.20 The docking results of fulvic acid and ginsenoside Rg1-PP2A complex

图21 黄腐酸与人参皂苷Rg1-PP2A复合物进行对接的氢键区域图Fig.21 Hydrogen bond map of the fulvic acids combined with ginsenoside Rg1-PP2A compound

图22 黄腐酸与人参皂苷Rg1-PP2A复合物进行对接后的键合作用Fig.22 Bonding interaction of the fulvic acid combined with ginsenoside Rg1-PP2A compound
3 结论
大量实验结果显示:黄腐酸能够作为一种生物刺激素作用于动物,能够促进生长过程中养分的转化。三七中的人参皂苷Rg1可以增加PP2A活性,减少tau蛋白过度磷酸化,实现防治阿尔茨海默病的预防和治疗。计算模拟结果表明:人参皂苷Rg1可促进PP2A的产生,黄腐酸也有可能促进PP2A的产生,而且黄腐酸还可能作用于人参皂苷Rg1与PP2A的复合物,促进人参皂苷Rg1和PP2A的结合,提高药理活性。
[ 1 ]周霞萍,张义超,张世万. 腐植酸医用研究新进展[J].腐植酸,2011,(3):5~9.
[ 2 ]黄良才. 腐植酸护肤品的开发[J]. 腐植酸,2001,(2):24~44.
[ 3 ]Wang Q, Yang Y, Zhu M Q. Structral transformation of birnessite by fulvic acid under anoxic conditions[J].Environmental Science & Technology, 2018, 52(4):1844~1853.
[ 4 ]蒲清荣,税丕先. 三七药理作用研究概述[J]. 现代医药卫生,2007,(24):3704~3705
[ 5 ]高妍,薛薇,李敏,等. 人参皂苷Rg1的中枢药理作用及多靶点机制研究进展[J]. 中国临床药理学与治疗学,2016,21(1):22~35.
[ 6 ]彭小松,陈小春,黄俊山,等. 人参皂苷Rg1对Aβ25-35诱导大鼠海马神经元tau蛋白异常磷酸化的影响[J]. 中国药理学通报,2005,21(3):4~7.
[ 7 ]刘超,张雪宁,刘东,等. 异丙酚、人参皂苷Rg-1、蛋白磷酸酯酶-2A和氯化锂对大鼠电休克后学习记忆及海马内谷氨酸含量的影响[J]. 中国医学科学院学报,2014,(3):234~240.
[ 8 ]曲忠森,赵永波,王兴彬,等. 轻度认知障碍及阿尔茨海默病患者外周血淋巴细胞中蛋白磷酸酯酶-2A的改变[J]. 中华神经科杂志,2007,40(10):652~654.
[ 9 ]朱粹青,曹小定. 蛋白磷酸酯酶-1和-2A抑制剂对NG108-15细胞tau蛋白磷酸化的影响[J]. 细胞生物学杂志,2002,24(2):115~117.
[ 10 ]曾育琦,陈晓春,黄春,等. 人参皂苷Rg1通过调节GSK3β/PP2A活性减轻皮层神经元tau蛋白过度磷酸化[J]. 解剖学报,2007,38(6):665~670.
[ 11 ]唐赟,李卫华,盛亚运. 计算机分子模拟一2013年诺贝尔化学奖简介[J]. 自然杂志,2013,35(6):408~415.
[ 12 ]江莉,万华根,彭群生. 基于CHARMM力场的蛋白质分子场计算及触觉感知[J]. 计算机辅助设计与图形学学报,2009,21(7):886~892.
[ 13 ]Campbellwh. Nitrate reductase structure function and regulation bridging the gap between biochemistry and physiology[J]. Annual Review of Plant Biology, 1999,50(50): 277~303.
