新辅助化疗对乳腺癌患者ER、PR、HER-2及Ki67表达的影响
2018-06-25王光辉唐亚楠王虎霞于田雨
王光辉,唐亚楠,陈 楠,王虎霞,秦 倩,于田雨,盛 薇
(1. 西安交通大学第一附属医院普外科,陕西西安 710061;2. 西安交通大学第一附属医院乳腺中心,陕西西安 710061;3. 陕西省肿瘤医院乳腺中心,陕西西安 710061)
乳腺癌是女性最常见的恶性肿瘤之一,发病率呈逐年增长的趋势,目前已居女性群体恶性肿瘤发病率首位[1]。新辅助化疗(neoadjuvant chemotherapy, NAC)不仅用于局部晚期的乳腺癌患者,同样广泛适用于可手术的乳腺癌患者。NAC和术后辅助化疗同样有效,两者在总生存率与无瘤生存率方面没有明显的统计学差异,更重要的是,NAC可以预测化疗药物在体内的敏感性,为后续治疗提供依据。尽管NAC在乳腺癌的治疗方面有许多优势,但并不是对所有的乳腺癌患者均有效,在如何选择高效的化疗药物、制订个体化方案以及预测治疗效果等方面仍然不够成熟,需要进一步的研究[1-2]。本研究通过分析NAC前后4种乳腺癌分子标志物(ER、PR、HER-2及Ki67)的表达改变,探讨NAC对ER、PR、HER-2以及Ki67表达的影响,从而为乳腺癌患者制定精准个体化治疗方案提供依据。
1 材料与方法
1.1材料收集西安交通大学第一附属医院2013年1月1日至2015年12月31日期间所收入的经芯针穿刺确诊的初治女性乳腺癌患者165例。所有病例均行芯针穿刺活检,且活检前所有患者均未行包括放化疗在内的特殊治疗。活检采用美国巴德公司的自动活检枪以及16G的穿刺活检针(MN324),穿刺前行或不行超声定位,每个肿瘤分3个方向取材2~6条圆柱状标本。手术标本离体后,100 mL/L甲醛溶液固定24~72 h,石蜡包埋,并制作4 μm厚连续切片。依据是否于术前行NAC分为NAC组和对照组,其中纳入NAC组患者62例,年龄28~73岁,中位年龄49岁;纳入对照组患者103例,年龄27~86岁,中位年龄50岁。所有患者临床分期参照NCCN指南2015版制定。
1.2免疫组化染色(SP法) 标本切片经二甲苯脱蜡,标准梯度乙醇至水化,高温高压进行抗原修复,H2O2室温孵育20 min,正常山羊血清封闭30 min,滴加相应一抗(稀释比1∶1 000)4 ℃孵育过夜,PBS冲洗后滴加DACO二抗,DAB液显色,蒸馏水冲洗,经明矾苏木素复染,逐级脱水封固后采用光学显微镜进行观察。本研究所用的ER、PR、HER-2、Ki67一抗,以及二抗和SP试剂盒均购自北京中杉金桥公司。
1.3NAC方案62例采用含蒽环类或紫杉类为基础的化疗方案,其中45例行TE或TA方案,21 d为1个化疗周期;9例行TCH方案,21 d为1个化疗周期;6例行TEC或TAC方案,21 d为1个化疗周期。共治疗2~6个周期不等。2例因治疗过程中行FISH检测明确HER-2过表达而更改化疗方案;1例先行CEF化疗2周期,后调整为TCH方案化疗4周期;另外1例患者先行TE方案化疗2周期,后调整为TCH化疗4周期。
1.4NAC效果评估NAC组患者通过临床触诊、乳腺超声、钼靶X线摄片以及乳腺磁共振随访肿物大小,同一患者均以同一种方法测量肿物大小以便对比,近期疗效评价均要维持4周以上确认。以实体瘤反应评价标准1.0(response evaluation criteria in solid tumors, RECIST)为标准评估NAC的疗效。分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)、疾病进展(progressive disease, PD)。CR+PR为总有效率RR(response rate)。NAC组62例患者中,有4例患者经过NAC达到病理完全缓解(PCR),术后病理提示未见癌细胞浸润,因此对其余58例患者进行ER、PR、HER-2、Ki67检测。
1.5NAC组及对照组乳腺癌患者手术治疗NAC组患者在新辅助化疗结束后2~3周内接受手术治疗,对照组患者均在芯针穿刺确诊乳腺癌1周内接受手术治疗。腋窝触诊阳性或穿刺确诊存在淋巴结转移者直接行腋窝淋巴结清扫。腋窝触诊阴性患者行前哨淋巴结活检,明确腋窝情况,无转移只行乳腺单切或保乳术,若前哨淋巴结存在转移,则行腋窝淋巴结清扫。
1.6统计学分析实验数据由SPSS 22.0统计分析软件处理。计数资料比较使用χ2检验或Pearson相关性分析。P<0.05认为差异有统计学意义。
2 结 果
2.1NAC组与对照组病理特点及分子亚型的对比NAC组与对照组ER、PR、HER-2、Ki67表达以及组织学分级情况见表1,分子亚型对比见图1。
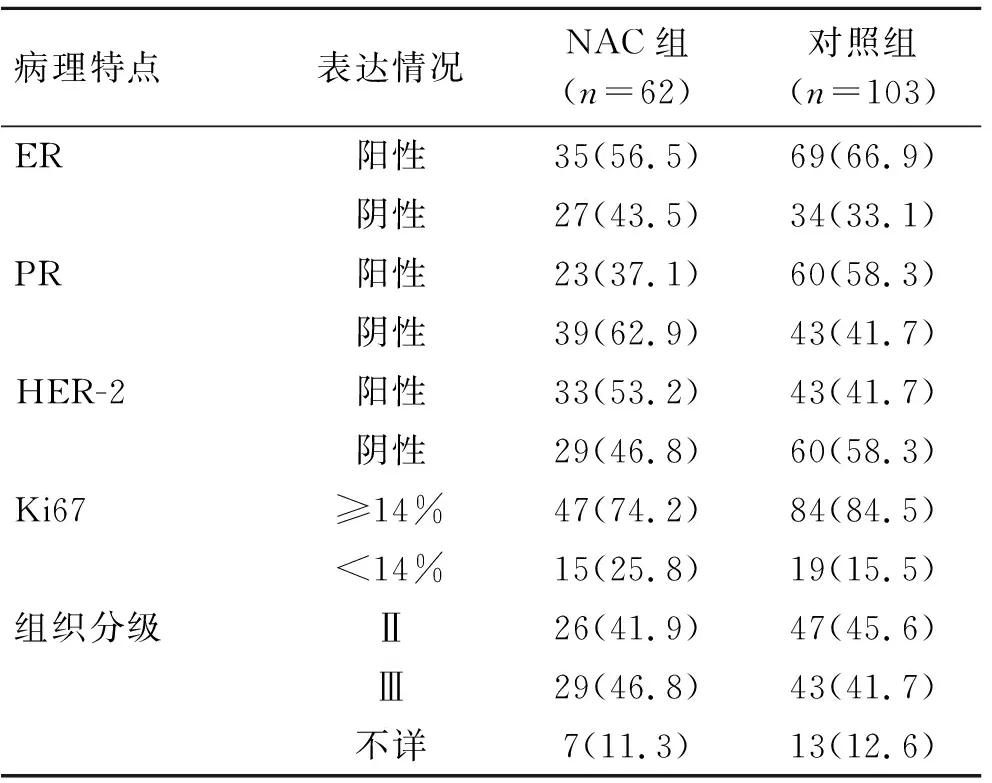
表1 NAC组与对照组病理学特点的对比Tab.1 Pathological characteristics in NAC group and control group [n(%)]
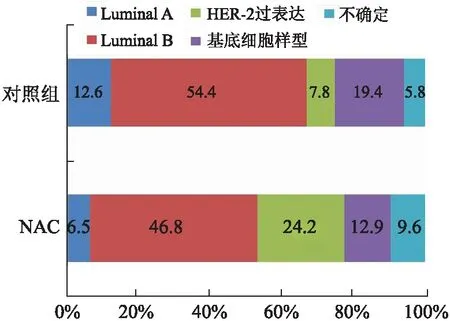
图1 NAC组和对照组分子亚型分布Fig.1 Distribution of molecular subtypes in NAC group and control group
2.2NAC对ER、PR、HER-2、Ki67表达的影响与对照组相比,NAC组58例乳腺癌患者中,ER、PR表达的差异无统计学意义(P=0.378、P=0.227);而HER-2、Ki67表达的差异有统计学意义(P=0.026、P=0.006,表2)。
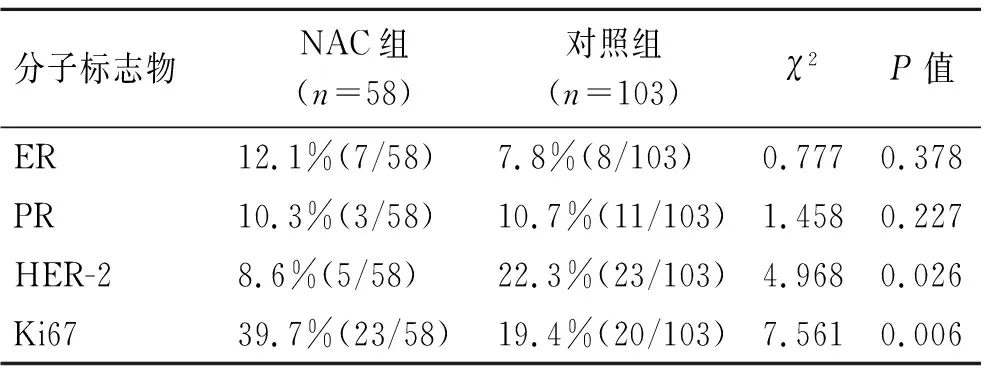
表2 NAC组与对照组ER、PR、HER-2、Ki67表达情况Tab.2 Comparison of the changes of ER, PR, HER-2 and Ki67 expression status in NAC group and control group
2.3NAC后Ki67表达变化与化疗疗效的相关性NAC前后Ki67表达变化显著,因此我们进一步探讨Ki67的表达对NAC疗效的预测价值。结果表明,NAC组中Ki67高表达患者与低表达患者在NAC疗效方面的差异有统计学意义(P=0.038,表3)。因此,NAC前Ki67高表达状态以及NAC后Ki67增生指数的下降往往预示着更好的化疗效果。Pearson相关分析提示,NAC治疗后Ki67表达状态的下降与化疗效果呈明显的正相关(r=0.732,P=0.016,图2)。

表3 Ki67表达状态与NAC疗效的相关性Tab.3 Relationship between Ki67 expression status and NAC efficacy
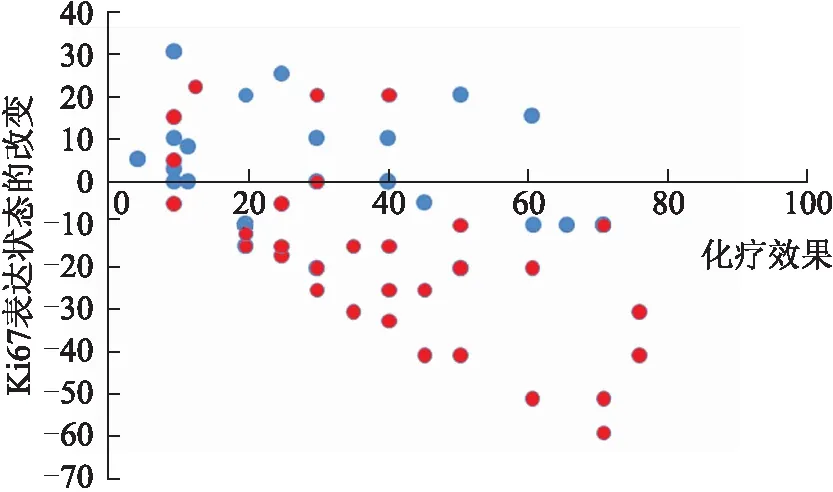
图2 NAC治疗后Ki67表达变化与化疗效果的相关性Fig.2 Relationship between the change of Ki67 expression status after NAC and NAC efficacy
3 讨 论
乳腺癌是女性中最常见的恶性肿瘤,其发生、发展受多个基因调控,其中某些基因在乳腺癌的诊疗以及预后评价等方面具有重要意义。在乳腺癌相关的分子生物标记物中,ER、PR、HER-2以及Ki67是公认与乳腺癌关系最为密切的基因,其表达情况对患者治疗方案的选择以及预后评估至关重要。在本研究中,通过比较接受NAC患者的乳腺癌标本中ER、PR、HER-2及Ki67表达状态的变化,我们发现NAC对ER和PR的表达影响较小,而对Ki67影响显著。同时,NAC前Ki67的表达水平能够作为预测化疗疗效的指标,对于制定乳腺癌临床治疗方案具有一定参考价值。
ER、PR的表达状态不仅可以用来指导内分泌治疗的选择,而且是评估乳腺癌预后的重要指标。因此,关于NAC是否会改变ER、PR的表达状态一直备受关注,而且在不同的研究中出现了不同的结果。蒋奕等[3]收集80例行NAC的乳腺癌化疗前后病理标本,用免疫组化SP法检测其ER、PR的表达情况,结果发现NAC前后ER、PR的表达状态无明显差异(P>0.05)。车潇良等[4]发现53例乳腺癌患者中分别有9(18%)、11(22%)例出现NAC前后ER、PR的表达发生完全相反地改变,差异无统计学意义(P>0.05),提示NAC不会影响乳腺癌患者ER、PR的表达。然而,也有部分学者发现NAC能够影响ER和PR表达的改变。YANG等[5]报道,NAC能显著改变乳腺癌患者ER和PR的状态,与非化疗组相比,该差异具有统计学意义(P均<0.05)。GAHLAUT等[6]发现NAC可以明显增加ER的表达水平。FRASSOLDATI等[7]发现NAC可以明显降低ER的表达水平。也有研究认为NAC可以使ER、PR的表达状态呈现出由阴转阳的趋势,原因是NAC优先消灭了ER和/或PR阴性的肿瘤细胞。本研究发现,NAC组的乳腺癌患者术前与术后标本ER、PR表达状态的改变率分别为12.1%(7/58)、10.3%(6/58),而对照组中ER、PR表达状态改变率分别为7.8%(8/103)、10.7%(11/103),两组ER、PR表达状态的改变率无明显差异(P>0.05)。考虑到本研究纳入的样本量较少,对于NAC是否影响ER和PR表达,还需要多中心大样本研究进一步证实。
HER-2是判断乳腺癌预后的重要指标,HER-2过表达的肿瘤恶性程度高、侵袭性强、预后差。HER-2的过表达已经成为公认预测以蒽环类为基础的辅助化疗疗效的指标,以蒽环类为基础的化疗可以改善HER-2过表达乳腺癌患者的无瘤生存率和总生存率[8]。许多研究发现,NAC前后HER-2的表达状态表现不一致。GENNARI等[9]发现NAC后HER-2表达水平有明显的上升趋势,而YOSHIDA等[10]的研究结果则与之相反;YANG等[5]的研究发现,NAC后患者HER-2表达状态有明显改变,但这种改变无明显趋向性。本研究发现NAC组的乳腺癌患者术前与术后标本HER-2表达状态的改变率为8.6%(5/58),而未行NAC的对照组中术前和术后标本中HER-2表达状态改变率为22.3%(23/103),且该差异有统计学意义(P<0.05)。
Ki67是与细胞有丝分裂密切相关的核抗原,在细胞有丝分裂G0期以外的各期均可检测到Ki67的表达。Ki67可以反映肿瘤的增殖活性,国内外学者发现,Ki67与乳腺发生、转移等密切相关,而且Ki67高表达的患者预后欠佳[11]。关于NAC是否会影响Ki67的表达状态仍然备受争议。TANAKA等[12]的研究发现NAC可使Ki67表达阳性率降低,而且可以明显降低Ki67的表达水平。但有些研究却认为Ki67的表达状态在NAC前后无显著改变[13]。本研究发现,NAC组与对照组的乳腺癌患者术前与术后标本Ki67表达状态的改变率分别为39.7%(23/58)、19.4%(20/103),NAC组Ki67的改变率明显高于对照组,且具有统计学差异(P<0.05)。上述结果支持NAC能够影响乳腺癌组织中Ki67表达水平的观点。目前,有许多研究对Ki67能否作为NAC疗效预测指标进行探讨。有研究认为相较于Ki67阴性的患者,Ki67阳性的乳腺癌患者对NAC更敏感[14-15]。而刘新杰等[16]却认为Ki67的表达状态与NAC疗效无明显相关性。我们认为Ki67的表达状态可作为预测NAC疗效的重要指标,本研究提示化疗药物可能是通过抑制Ki67的表达来抑制恶性肿瘤的生长。
综上所述,ER、PR的表达情况与新辅助化疗疗效无明显相关性。赫赛汀不能使HER-2过表达的乳腺癌患者行NAC时受益。化疗前Ki67高表达状态以及化疗后Ki67增生指数的下降往往预示着更好的化疗效果,由此可推断NAC可能是通过抑制Ki67使肿瘤缩小,Ki67可成为预测NAC疗效的独立指标。本研究在一定程度上可以为今后的临床研究提供一种新思路。
参考文献:
[1] KAUFMANN M, VON MINCKWITZ G, SMITH R, et al. International expert panel on the use of primary (preoperative) systemic treatment of operable breast cancer: Review and recommendations[J]. J Clin Oncol, 2003, 21(13):2600-2608.
[2] MAURI D, PAVLIDIS N, IOANNIDIS JP. Neoadjuvant versus adjuvant systemic treatment in breast cancer: A meta-analysis[J]. J Natl Cancer Inst, 2005, 97(3):188-194.
[3] 蒋奕,叶新青,黄俊淇,等. 乳腺癌新辅助化疗前后分子标记物变化及其与疗效的关系[J]. 广西医科大学学报, 2015, 32(2):211-215.
[4] 车潇良,蔡媛,冯建丽,等. 乳腺癌新辅助化疗疗效及与激素受体相关性的临床观察[J]. 现代肿瘤医学, 2012, 20(2):304-306.
[5] YANG YF, LIAO YY, LI LQ, et al. Changes in ER, PR and HER2 receptors status after neoadjuvantchemotherapy in breast cancer[J]. Pathol Res Pract, 2013, 209(12):797-802.
[6] GAHLAUT R, BENNETT A, FATAYER H, et al. Effect of neoadjuvant chemotherapy on breast cancer phenotype, ER/PR and HER2 expression-Implications for the practising oncologist[J]. Eur J Cancer, 2016, 60:40-48.
[7] FRASSOLDATI A, ADAMI F, BANZLI C, et al. Changes of biological features in breast cancer cellsdetermined by primary chemotherapy[J]. Breast Cancer Res Treat, 1997, 44(3):185-192.
[8] TRIFUNOVIC J, MEMISEVIC N, NIKOLIN B, et al. Modulatory effect of neoadjuvant chemotherapy on the prognosis of patients with breast cancer[J]. J Buon, 2017, 22(2):638-643.
[9] GENNARI A, SORMANI MP, PRONZATO P, et al. HER2 status and efficacy of adjuvant anthracyclines in early breast cancer: A pooledanalysis of randomizedtrials[J]. J Natl Cancer Inst, 2008, 100(1):14-20.
[10] YOSHIDA A, HAYASHI N, SUZUKI K, et al. Change in HER2 status after neoadjuvant chemotherapy and the prognostic impact in patients with primary breast cancer[J]. J Surg Oncol, 2017, 116(8):1021-1028.
[11] RASMY A, ABOZEED W, ELSAMANY S, et al. Correlation of preoperative Ki67 and serum CA15.3 levels with outcome in early breast cancers: A multi-institutional study[J]. Asian Pac J Cancer Prev, 2016, 17(7):3595-3600.
[12] TANAKA K, TOKUNAGA E, YAMASHITA N, et al. The relationship between the expression of FOXA1 and GATA3 and the efficacy of neoadjuvantendocrine therapy[J]. Breast Cancer, 2017, 24(3):384-392.
[13] PETRIC M, MARTINEZ S, ACEVEDO F, et al. Correlation between Ki67 and histological grade in breast cancer patients treated with preoperative chemotherapy[J]. Asian Pac J Cancer Prev, 2014, 15(23):10277-10280.
[14] 余海云,李文萍,郜红艺,等. 新辅助化疗疗效与乳腺癌Ki67, P53表达的关系[J]. 中华乳腺病杂志(电子版), 201l, 5(3):19-24.
[15] 巩福玉,王本忠. Ki67在乳腺癌新辅助化疗中的疗效评价和预测价值[J]. 中华内分泌外科杂志, 2014, 8(2):117-120.
[16] 刘新杰,罗民,麦惠清,等. 乳腺癌Ki-67, p53, CerbB-2, ER及PR的表达预测新辅助化疗效果的研究[J]. 中国普通外科杂志, 2010, 19(11):1246-1249.
