连翘根际高效解有机磷细菌的筛选鉴定及促生长特性研究
2018-06-25张鹏飞张桂萍李秀芳任嘉红
吴 伟 张鹏飞 张桂萍 李秀芳 任嘉红
(1. 山西师范大学生命科学学院,山西 临汾 041000;2. 长治学院生物科学与技术系,山西 长治 046011)
连翘 (Forsythiasuspensa) 隶属木樨科连翘属,是我国华北地区常见的抗旱和观赏植物,具有良好的经济发展前景;另外连翘具清热解毒、消肿散结等功效,已被我国药典收藏并作为常用传统中药之一[1]。连翘在种植过程存在大量施用化肥的情况,这不仅提高了生产成本,还容易造成土壤板结、土壤功能退化以及微生态失调等问题,阻碍了土壤的可持续利用,而且化学肥料的大量使用也为以连翘作为原材料的药品安全带来了巨大隐患[2]。因此,有必要探寻其他更为安全可持续的微生物菌剂以部分替代化肥,实现连翘品质和产量优化生产并促进我国连翘种植业发展。
植物根际促生菌 (PGPR) 是一类能够定殖于植物根部系统并能直接或间接促进植物生长发育的有益微生物,目前已报道的促生菌主要有解磷菌、固氮菌、解钾菌等[3]。其中解磷菌可以将土壤中植物难以吸收利用的磷转化为可吸收利用的形态,根据分解底物的不同又可将解磷菌分为溶无机磷微生物 (PSB) 和解有机磷微生物 (OPB)[3]。解磷菌不仅在活化土壤养分,提高土壤中磷含量和促进植物生长发育等方面起着重要作用,而且还可以通过产生诱导植物生长的生长激素、赤霉素和1-氨基环丙烷-1-羧酸 (ACC) 脱氨酶等活性物质来间接促进植物生长发育[4]。如黄静等[5]从油菜 (Oryzasativa) 根际土壤分离出的解磷细菌均具有产吲哚乙酸和嗜铁素的能力;谭石勇等[6]从苎麻(Boehmerianivea)根际土壤筛选出的4株解磷细菌具有产IAA、嗜铁素和固氮能力,且均能促进苎麻种子的萌发和植株的生长。目前有研究报道在丹参 (Salviamiltiorrhiza)、当归 (Angelicasinensis) 和地黄 (Rehmanniaglutinosa)[7-8]等药用植物根际分离获得很多PGPR菌株,对其解磷、固氮、解钾、产生生长激素和抑病机理等方面进行了有益的探索。但是目前对于连翘的研究多集中在其药用成分包括连翘苷和连翘脂苷等方面,而对其根际PGPR的研究却鲜有报道。
本研究以长治地区的连翘根际土壤为研究对象,拟通过分离筛选出具有多种促生性能的解有机磷细菌 (OPB),为药用植物连翘专用微生物肥料的研制和生产提供菌种资源,并为植物-促生菌互作的深入研究提供参考。
1 材料与方法
1.1 材料来源
1.1.1土样采集
选择山西省长治市连翘分布区 (35°68′93.53″ N,113°44′89.9″ E) 作为采样区,共5个采样点。每个点随机选取3株长势较好的连翘,去掉地表枯枝落叶层,用无菌小铲挖取0~15 cm处的连翘根际土壤装入塑料袋中,低温通风保存带回实验室放于4 ℃冰箱中,随即进行细菌的分离。
1.1.2培养基
LB (Luria Bertani) 培养基[9],蒙金娜有机磷固体培养基[10],King′s B培养基[11],CAS培养基[12],TSB、DF和ADF培养基[13],Ashby无氮培养基[14]。
1.2 菌株的分离与筛选
采用稀释涂布平板法进行解有机磷细菌的分离。分别取浓度为10-3、10-4和10-5的土壤稀释液均匀涂布于蒙金娜有机磷固体培养基平板中,各稀释度设3个重复,置于28 ℃下培养3~4 d。待菌体长出后挑取生长量大、菌落四周含透明圈的菌株,纯化3次以上至获得纯培养,挑取单菌落至斜面培养基培养2~3 d后,4 ℃条件下保存,备用。
1.3 测定方法
1.3.1解磷活性的测定
定性测定:将分离获得的纯菌株分别点接种于蒙金娜固体培养基上,30 ℃培养7 d,根据解磷圈直径 (D) 与菌落直径 (d) 比值大小初步确定其解磷能力。
定量测定:将待测菌株接种于LB液体培养基中,30 ℃ 180 r/min培养24 h,10 000 r/min离心1 min后去上清液,用无菌水重悬菌体沉淀。实验组取1 mL菌悬液接种于50 mL蒙金娜液体培养基中,对照组在蒙金娜液体培养基中接种1 mL灭菌菌悬液,每个处理设3个重复,同时于30 ℃ 180 r/min条件下培养1~7 d。从第1天开始,每天定时取上述菌悬液经4 ℃ 10 000 r/min离心10 min,取上清,使用钼锑抗比色法[15]测定上清液中可溶性磷含量。待测菌株解磷量即为实验组和对照组可溶性磷含量的差值。
1.3.2菌株其他促生特性测定
1) 产IAA能力测定。Salkowski法测定菌株生长素分泌能力[16]。定性检测:以加入比色液后室温静置15 min颜色变化为判断依据,确定菌株是否具有分泌IAA的能力。定量检测:菌悬液离心后所得的上清液加二倍体积的比色液,室温暗处显色30 min后,于530 nm处测定OD值,参照生长素标准曲线计算出待测菌株的生长素产生量。
2) 产嗜铁素能力测定。待测菌株点接种于CAS培养基上,28 ℃培养2~3 d,如菌株周边有黄绿色晕圈产生就可以证明该菌株具产嗜铁素能力[12]。
3) 产NH3能力测定。待测菌株接种到10 mL 10 g/L蛋白胨溶液试管,28 ℃ 200 r/min培养2~3 d,每管加0.5 mL Nessler′s试剂,若出现黄褐色沉淀则证明该菌株为产NH3阳性反应[17]。
4) 产HCN能力测定。待测菌株划线于含4.4 g/L甘氨酸的LB固体培养基上,同时在培养基上平铺浸有2%的Na2CO3和0.5%的2, 4, 6-三硝基苯酚溶液的滤纸并密封,28 ℃培养4 d,若滤纸由橘黄色变为红色则证明有HCN产生[17]。
5) ACC脱氨酶活性定性测定。将待测菌株接入50 mL Ashby无氮液体培养基中,30 ℃ 200 r/min振荡培养24 h;吸取100 μL 菌悬液接种至50 mL DF培养基同条件下培养24 h;按2%接种量转接入50 mL ADF培养基中继续培养48 h。能以ACC为唯一氮源生长的菌株为ACC脱氨酶阳性菌株[13]。
6) 固氮能力测定。定性检测:待测菌株划线于Ashby无氮固体培养基,28 ℃培养2~3 d,若菌株能正常生长,则说明该菌株具有固氮能力[14]。定量检测:将待测菌株接种于含有5 mL无氮培养基的顶空瓶中,在30 ℃恒温条件下密封培养24 h后,用无菌注射器抽取2 mL气体,再注入等体积乙炔,继续培养3 d后,抽取0.5 mL气体进入气相色谱仪分析乙烯含量,即为固氮酶活性 (C2H4, μL)=还原乙烯量 (C2H4, μL)/d。
1.3.3菌株的鉴定
按照 《常见细菌系统鉴定手册》 对菌株的形态特征与生理生化进行分析[18],每个处理设3个重复;利用GenⅢ Microstation鉴定系统进行Biolog鉴定;16S rDNA序列分析:提取细菌的基因组DNA后,采用细菌16S rDNA的通用引物 (正向引物27F:AGAGTTTGATCCTGGCTCAG;反向引物1512R:ACGGCTACCTTGTTACGACT) 对筛选菌株的基因组DNA进行PCR扩增。PCR反应条件为:94 ℃ 2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1.5 min,共30个循环;72 ℃ 7 min。PCR产物经1%琼脂糖凝胶电泳分离后送到Invitrogen公司测序。将得到的基因序列分别登陆EzTaxon server (http://www.EzTaxon.org)和NCBI进行BLAST,选取数据库中有代表性的菌株16S rDNA,采用Bioedit软件的Multiple Sequence Alignment程序进行分析,并利用软件MEGA构建系统发育树 (Bootstrap=1 000)。
1.4 数据处理
采用Excel 2003进行数据整理及制图,应用SPSS16.0进行数据分析。
2 结果与分析
2.1 菌株的分离筛选
利用蒙金娜选择培养基从长治市5个采样点的连翘根际土壤中共分离出16株不同形态特征的解磷菌,其中挑取9株生长速度快,在培养基上具有较大解磷圈的菌株 (表1),部分菌株产生的解磷圈见图1。各菌株D/d值在1.01~1.38之间,D/d值最大的菌株为LQYJ6 (1.38),其余依次为LQYJ1 > LQYJ9 > LQYJ3 > LQYJ4 > LQYJ5 > LQYJ2 > LQYJ8 > LQYJ7。通过定量测定所分离菌株解磷量发现供试的9株菌解磷量在1.07~52.45 mg/L之间,各菌株解磷能力差异显著 (P< 0.05),其中解磷量最大的菌株是LQYJ6 (52.45 mg/L),其余依次为LQYJ1 > LQYJ9 > LQYJ3 > LQYJ4 > LQYJ5 > LQYJ7 > LQYJ2,解磷量最小的菌株是LQYJ8 (1.07 mg/L)。
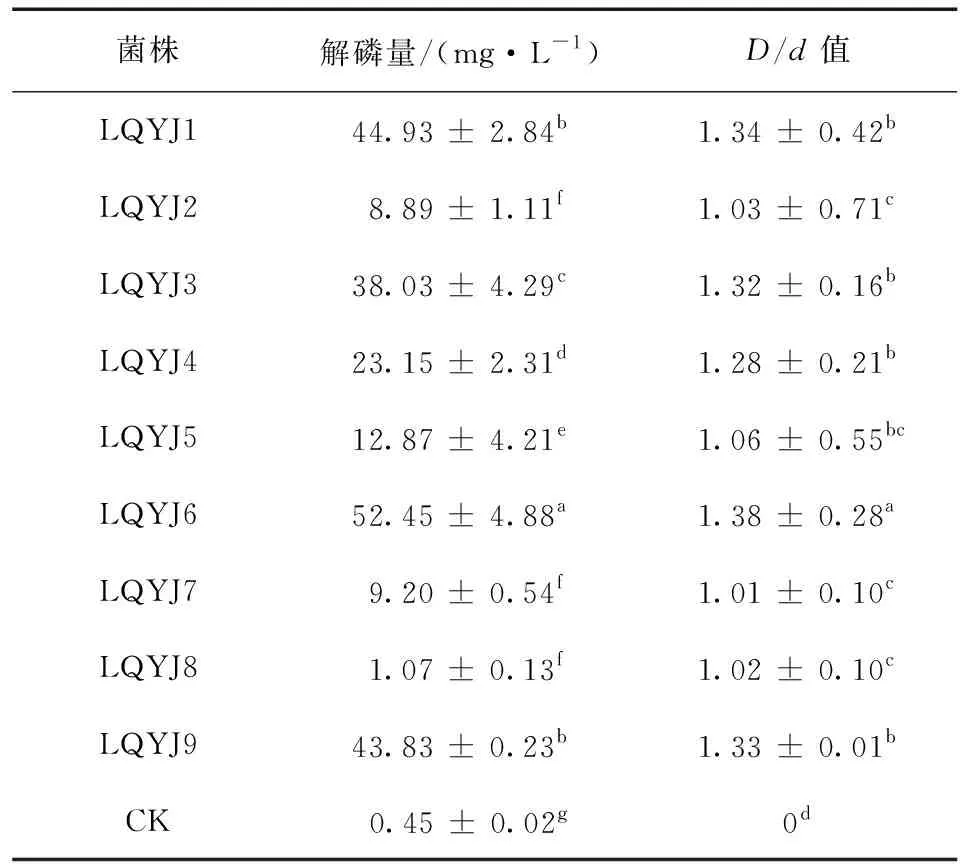
表1 菌株解有机磷能力测定Table1 Organic phosphate-mineralizing ability of strains
注:同列数据后不同字母表示对照与处理间在0.05水平存在显著性差异。
2.2 菌株的其他促生长特性
对筛选获得的9株解有机磷细菌产IAA、产HCN、产NH3、分泌嗜铁素、固氮以及是否具有产ACC脱氨酶活性等多种促生长特性进行测定,结果见表2。这9株菌均具有产IAA和嗜铁素的能力,但不同菌株产IAA能力有所不同,含量在6.71~0.17 μg/mL之间,其中产IAA能力最强的菌株为LQYJ6 (6.71 μg/mL),最弱的菌株是LQYJ2 (0.17 μg/mL);部分菌株在CAS平板上产嗜铁素圈的能力见图2。

图1部分代表菌株产生的解磷圈
Fig.1 Organic phosphate-mineralizing zone produced by some representative strains

表2 菌株其他促生能力测定Table 2 Other growth promoting characteristics of strains
注:同列数据后不同字母表示对照与处理间在0.05水平存在显著性差异;“+”代表不同菌株促生能力等级,反之为“-”。
图2部分菌株产嗜铁素能力测定
Fig.2 The ability to secret siderophore of some strains
菌株LQYJ3和LQYJ8具有产NH3能力;菌株LQYJ3和LQYJ4具有产HCN能力;菌株LQYJ2和LQYJ5具有固氮能力;固氮酶活性分别为0.13 μL/d和0.15 μL/d;另外,除了LQYJ1、LQYJ2、LQYJ3、LQYJ4、LQYJ5和LQYJ9菌株外,其余3个菌株均具有ACC脱氨酶活性。综合9株解有机磷细菌的不同解磷能力,可以看出除了菌株LQYJ1以外,这9株解磷细菌分别具有2种或2种以上的促生特性,例如菌株LQYJ6同时具有解有机磷、产IAA和ACC脱氨酶活性;菌株LQYJ3同时具有解有机磷、产NH3和产HCN能力;菌株LQYJ5具有解有机磷、固氮和产IAA能力;以及菌株LQYJ8具有解有机磷、ACC脱氨酶活性和产NH3能力。因此,可以根据不同需求将上述促生菌制成微生物菌剂应用到连翘的种植产业中。以上结果表明,从连翘根际分离到9株解磷细菌具有多种促生长特性,这为将来利用菌株促进植物的生长提供参考依据。
2.3 菌株的鉴定
2.3.1形态与生理生化特征
从连翘根际筛选出的9株解有机磷细菌的形态、生理生化特征见表3~4。由表3~4可以看出,除了菌株LQYJ8为革兰氏阳性 (G+) 菌、产芽孢外,其余菌株均为革兰氏阴性 (G-) 菌、不产芽孢。除了菌株LQYJ5为兼性厌氧菌外,其余菌株均为好氧菌。菌株LQYJ8菌落边缘呈锯齿状且菌体干燥,具芽孢,可初步鉴定其属于芽孢杆菌属,菌株LQYJ1、LQYJ3、LQYJ4、LQYJ6和LQYJ7的形态和生理生化特征总体相近。

表3 解有机磷细菌的形态特征Table 3 Morphology characteristics of organic phosphate-mineralizing strains

表4 解有机磷细菌的生理生化特征Table 4 Physiological and biochemical features of organic phosphate-mineralizing strains
注:“+”表示反应呈阳性,反之则表示为“-”。
2.3.2Biolog鉴定
9株高效解磷细菌在Biolog鉴定板培养16~24 h时的度数相似值 (SIM) 均大于0.50,符合Biolog系统理想结果要求。菌株LQYJ1、LQYJ3、LQYJ4、LQYJ6和LQYJ7均鉴定为嗜麦芽寡养单胞菌 (S.ma-ltophilia),菌株LQYJ9为嗜根寡养单胞菌 (S.rhiz-ophila),菌株LQYJ2为荧光假单胞菌 (P.fluoresce-ns),LQYJ8为蜡状芽孢杆菌 (B.cereus),LQYJ5为密歇根克雷伯菌 (K.michiganensis)。
2.3.316S rDNA分子鉴定
分别以9株解磷菌株基因组DNA为模板,利用细菌16S rDNA基因通用引物进行PCR扩增,扩增出的1.5 Kb左右长度的DNA片段 (图3) 经测序后提交到GenBank注册获取登录号,分别为MG213728、MG213729、MG213730、MG213731、MG213732、MG213733、MG213734、MG213735和MG525171。将9株菌株与相近属种模式菌株的16S rDNA基因序列构建系统发育树 (图4),分析表明菌株LQYJ1、LQYJ3、LQYJ4、LQYJ6和LQYJ7均与嗜麦芽寡养单胞菌 (S.maltophilia)的亲缘关系较近,菌株LQYJ9、LQYJ2、LQYJ8 和LQYJ5分别与S.rhizophila、P.fluorescens、B.cereus和K.mic-higanensis聚在一起。结合9株菌的形态特征、生理生化特性、Biolog鉴定以及系统发育学分析结果,分别将菌株LQYJ1、LQYJ3、LQYJ4、LQYJ6和LQYJ7鉴定为为嗜麦芽寡养单胞菌 (S.maltophilia),菌株LQYJ9为嗜根寡养单胞菌 (S.rhizophila),菌株LQYJ2为荧光假单胞菌 (P.fluorescens),LQYJ8为蜡状芽孢杆菌 (B.cereus),LQYJ5为密歇根克雷伯菌 (K.michiganensis)。研究结果表明,连翘根际土壤解有机磷细菌具有较丰富的种属多样性。

1~9分别代表菌株LQYJ1-LQYJ9。
图3解有机磷细菌16SrDNA的PCR产物电泳结果
Fig.3 Result of garose gel electrophoresis of 16S rDNA gene PCR product of organic phosphate-mineralizing strains

括号内为登录号;分支上数字为树形可信度;比例尺显示水平线长度。
图4解有机磷细菌的16SrDNA基因的系统发育树
Fig.4 Phylogenetic tree based on 16S rDNA gene sequences of organic phosphate-mineralizing strains
3 结论与讨论
解磷细菌作为一类能将土壤中难溶性磷酸盐转化为能直接被农作物吸收利用的可溶性磷的有益微生物已引起广泛重视,但是对药用植物的研究却相对较少。目前,国内外对解磷细菌的研究大多集中于解无机磷细菌[19]。如马骢毓等[20]从黄芪 (Astragalusmembranaceus) 根际土壤分离获得具有应用潜力的解磷菌株7株;任嘉红等[21]从南方红豆杉 (Taxuschinensisvar.mairei) 根际共分离出4株对南方红豆杉苗期的生长有明显促进作用的高效溶无机磷细菌。林贵兵等[22]在丹参根际土壤中分离到有机磷分解菌;晋婷婷等[23]从南方红豆杉根际分离到一株嗜麦芽寡养单胞菌 (Stenotrophomonas
maltophilia),并证明具有高效解有机磷和显著促进南方红豆杉苗木生长的能力。本从连翘根际土壤中分离筛选到9株具多种促生长特性的解有机磷细菌,分别鉴定为嗜麦芽寡养单胞菌、嗜根寡养单胞菌 (S.rhizophila)、荧光假单胞菌 (Pseudomonasfluorescens)、蜡状芽孢杆菌 (Bacilluscereus) 和密歇根克雷伯菌 (Klebsiellamichiganensis),其中解有机磷能力较强的菌株嗜麦芽寡养单胞菌、嗜根寡养单胞菌目前还未见报道,这为药用植物连翘微生物肥料的开发提供了优良的菌种资源,对于连翘人工繁殖和野生资源保护具有重要意义。
本研究从连翘根际筛选到的9株解有机磷细菌,解磷量分别在52.05~1.07 mg/L之间,其中4株解有机磷细菌的解磷量在30.00 mg/L以上。而王琛等[24]对九龙江口海水和沉积物中分离得到的10株解有机磷细菌进行解磷能力测定发现,菌株XMYP7的解磷量最大,为0.030 5 mg/L;伍善东等[25]从油菜 (Brassicanapus) 根际土壤筛选得到的4株解有机磷细菌,解磷量在8.59~28.34 mg/L;白变霞等[26]从南方红豆杉 (Taxuschinensisvar.mairei) 根际土壤分离得到的解有机磷菌株CLY07的解磷量为26.62 mg/L。总的来说,与目前已报道的解有机磷细菌的解磷能力相比,本试验筛选的菌株LQYJ6、LQYJ1、LQYJ9和LQYJ3解有机磷能力较强,具有一定的应用潜力。另外,项目组还尝试过连翘根际溶无机磷菌株的分离筛选,但均未成功获得。分析其原因可能是受土壤质地、类型的影响,也有可能是与连翘根部产生的次生代谢产物对根际的微生物种群有一定影响,限制了具有溶无机磷能力微生物的生长,具体原因有待于进一步研究。
不少研究者报道解磷细菌还可通过产生生长素和嗜铁素等调节植物生长的物质来促进植物生长发育,且具有多种促生长特性 (如产嗜铁素、产生长素、产NH3、产HCN和具ACC脱氨酶活性等) 对植物的促生效应更显著[27]。如孟丽媛等[28]从水稻根际土壤筛选出的同时具产嗜铁素、吲哚乙酸 (IAA)、解磷能力和ACC脱氨酶活性的菌株均在不同程度上对水稻幼苗的初生根数、次生根数、茎干质量和根干质量等具促生作用。Glick等证明同时含ACC脱氨酶活性和产IAA能力的促生菌株可以刺激宿主植物生长发育[29]。Dimkpa等证明接种同时含ACC脱氨酶活性和产嗜铁素能力的菌株对宿主植物的促生作用优于单接种且抗逆能力增强[30]。本研究从连翘根际土壤筛选出了9株具有多种促生特性的高效解磷细菌,其中菌株LQYJ6、LQYJ3、LQYJ5和LQYJ8具有3种以上的促生特性,应具有一定的田间应用潜力,但鉴于不同菌株促生机理的复杂性仍需要进一步深入研究。
[1] 肖培根. 新编中药志: 第2卷[M]. 北京: 化学工业出版社, 2002.
[2] 裴旭花. 探究山西省长治市连翘种植经济发展模式的构建[J]. 农业技术与装备, 2017(4): 34-36.
[3] Furnkranz M, Muller H, Berg G. Characterization of plant growth promoting bacteria from crops in Bolivia[J]. Journal of Plant Diseases and Protection, 2009, 116: 149-155.
[4] Roderigue H, Fraga R. Phosphate solubilizing bacteria and their role in plant growth promotion[J]. Biotechnology Advances, 1999, 17(4/5): 319-339.
[5] 黄静, 盛下放, 何琳燕. 具溶磷能力的植物内生促生细菌的分离筛选及其生物多样性[J]. 微生物学报, 2010, 50(6): 710-716.
[6] 谭石勇, 易永健, 汪洪鹰, 等. 苎麻促生菌的筛选、鉴定及其促生效应[J]. 微生物学通报, 2015, 42(3): 525-533.
[7] 江曙, 段金廒, 严辉, 等. 当归根际微生物种群结构与生态分布的研究[J]. 中国中药杂志, 2009, 34(12): 1483-1488.
[8] 陈慧, 郝慧荣, 熊君, 等. 地黄连作对根际微生物区系及土壤酶活性的影响[J]. 应用生态学报, 2007, 18(12): 2755-2759.
[9] 李凤霞, 张德罡, 姚拓. 高寒地区燕麦根际高效PGPR菌培养条件研究[J]. 甘肃农业大学学报, 2004, 39(3): 316-320.
[10] 陈俊, 陆俊馄, 康丽华, 等. 红树林溶磷菌的初步鉴定、溶磷能力测定及其优化培养[J]. 微生物学通报, 2009, 36(81): 1198-1188.
[11] Nautiyal C S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. FEMS Microbiology Letters,1999,170(1):265-270.
[12] Schwyn B, Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56.
[13] Glick B R, Jacobson C B, Schwarze M M K, et al. 1-A-minocyclopropane-1-carboxylic acid deaminase mutants of the plant growth promoting rhizobacteriumPseudomonasputidaGR12-2 do not stimulate canola root elongation [J]. Conadian Journal of Microbiology, 1994, 40: 911-915.
[14] 孙建光, 胡海燕, 刘君, 等. 农田环境中固氮菌的促生潜能与分布特点[J]. 中国农业科学, 2012, 45(8): 1532-1544.
[15] Watanabe F S, Olaen S R. Test of an ascorbic acid method for determining phosphorus in water and NaHCO3extracts from soil[J]. Soil Science Society of America Journal, 1965, 29(6): 667-678.
[16] Clikmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied Environmental Microbiology, 1995, 61(2): 793-796.
[17] 康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌的筛选及鉴定[J]. 微生物学报, 2010, 50(7): 853-861.
[18] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 349-384.
[19] Oteino N, Lally R D, Kiwanuka S, et al. Plant growth promotion induced by phosphate solubilizing endophyticPseudomonasisolates[J]. Frontiers in Microbiology, 2015, 6: 745.
[20] 马骢毓, 张英, 马文彬, 等. 黄芪根际促生菌 (PGPR) 筛选与特性研究[J]. 草业学报, 2017, 26(1): 149-159.
[21] 任嘉红, 刘辉, 吴晓蕙, 等. 南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果[J]. 微生物学报, 2012, 52(3): 295-303.
[22] 林贵兵, 万德光, 王瑞婷, 等. 丹参栽培对土壤微生物区系组成特征的影响[J]. 华西药学杂志, 2010, 25(4): 438-443.
[23] 晋婷婷, 任嘉红, 刘瑞祥. 南方红豆杉根际解有机磷细菌的鉴定及其解磷特性和促生作用的研究[J]. 西北植物学报, 2016, 36(9): 1819-1827.
[24] 王琛, 田欣欣, 曲凌云. 九龙江口解有机磷细菌的解磷特性[J]. 海洋环境科学, 2013, 32(5): 736-740.
[25] 伍善东, 刘清术, 付祖姣, 等. 解有机磷拮抗细菌的筛选及其解磷特性和拮抗作用[J]. 江苏农业学报, 2017, 33(4): 843-847.
[26] 白变霞, 陈艳彬, 任嘉红. 蜡状芽孢杆菌CLY07菌株的解有机磷特性研究[J]. 西南林业大学学报, 2016, 36(4): 75-81.
[27] Zia-ul-Hassan S, Khokhar I, Rajpar, et al. ACC-deaminase, phosphate-solubilizingPseudomonasfluorescensincrease phosphorus and decrease cadmium concentration to enhance wheat yield[J]. Journal of Basic & Applied Sciences, 2016, 12: 314-319.
[28] 孟丽媛, 李冰, 孙乐妮, 等. 水稻根际促生细菌促生生理活性评价[J]. 中国土壤与肥料, 2014(1): 90-94.
[29] Glick B R, Todorovic B, Czamy J, et al. Promotion of plant growth by bacterial ACC deaminase[J]. Critical Reviews Plant Sciences, 2007, 26(5/6): 227-242.
[30] Dimkpa C, Weinan T, Asch F. Plant-rhizobacteria interactions alleviate abiotic stress conditions[J]. Plant Cell & Environment, 2009, 32(12): 1682-1694.
