七氟烷预处理对缺血再灌注损伤大鼠神经功能及血清TNF-α、IL-10、IL-1β水平的影响
2018-06-25郑洪洪徐志新
王 涛 郑洪洪 徐志新
(海南医学院第二附属医院麻醉科,海南 海口 570311)
脑缺血可导致氧和葡萄糖运输障碍,造成局部组织能量代谢障碍,出现缺血性损伤,而在再灌注恢复血液后,其缺血性损伤会进一步加重,这种现象称为脑缺血再灌注损伤〔1,2〕。脑缺血再灌注损伤是一个复杂的过程,在脑组织缺血缺氧的基础上,血液灌注后可产生氧化作用,生成活性氧簇及活性氮簇,进而损伤脑细胞,破坏细胞能量代谢;同时,脑缺血再灌注还可导致白细胞积聚、炎性损伤、细胞内Ca2+超载、兴奋性氨基酸释放,这些病理变化都可以对脑组织产生很大的影响,其中影响最大的就是脑水肿和神经元损伤〔3,4〕。脑缺血再灌注后对中枢神经系统造成的损伤通常是由能量代谢障碍引起的,而受损的神经元可在细胞间传递炎症信号,放大炎症反应,引起单核细胞、中性粒细胞大量聚集,引发继发性损伤。由此可见,在脑缺血再灌注损伤中炎症性损伤是重要的组成部分〔5,6〕。七氟烷为含氟的吸入麻醉药,其最小肺泡浓度(MAC)稳定,具有起效快、苏醒快等特点,且组织溶解性和在体内的代谢程度均较低,不增加脑血流量〔7〕。相关研究显示〔8〕,七氟烷预处理对中枢神经系统损伤具有一定的保护作用,然而关于七氟烷预处理对脑缺血再灌注引起的中枢神经系统损伤的相关报道目前较少。本研究旨在探讨七氟烷预处理对缺血再灌注损伤大鼠神经功能及血清肿瘤坏死因子(TNF)-α、白细胞介素(IL)-10、IL-1β水平的影响。
1 材料与方法
1.1实验动物 选取无特定病原体的Wistar雄性大鼠36只,体重180~200 g,平均(190.11±6.58)g,室温保持20℃~25℃,湿度50%~65%,每天给予12 h光照时间,保持室内通风,避免噪声,自由饮食、活动。实验大鼠购于北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001。适应性喂养1 w后采用随机数字表法分为对照组(10只)、模型对照组(13只)和七氟烷组(13只)。
1.2实验方法 对照组和模型对照组大鼠吸入100%纯氧,60 min后进行后续处理。七氟烷组吸入七氟烷,浓度配比为2.5%七氟烷+97.5%氧气,保持自主呼吸60 min后采用纯氧洗脱15 min,然后进行建模处理。建模方法〔9〕:采用烤灯维持大鼠体温,使其体温在建模过程中保持在37℃~38℃,采用10%水合氯醛350 mg/kg进行麻醉,腹腔注射。大鼠仰卧位固定,常规消毒后于大鼠颈部正中作一切口,钝性分离各层组织,暴露右侧颈总动脉,分离右侧颈总动脉及颈外动脉,避免损伤迷走神经和气管,于颈内、颈总动脉处用动脉夹夹闭,颈外动脉近心端及远心端结扎,中间剪开切口,将颈外动脉游离端拉至与颈内动脉成一条直线,将尼龙线由颈外动脉插入,推入约18 mm,当感受到阻力时停止推入。夹闭血管缺血2 h后将尼龙线拔出,再灌注恢复血液流通。对照组大鼠仅进行术前麻醉和血管分离术,不结扎及插入尼龙线。建模后密切关注模型对照组和七氟烷组大鼠,采用Bederson评分评估建模情况,舍去行为完全正常的大鼠,同时舍去手术时出血较多、症状很重或死亡的大鼠(这部分大鼠可能会出现出血性脑损伤),经评估后模型对照组和七氟烷组均有10只大鼠符合标准。
1.3大鼠神经功能检测 再灌注24 h后,采用Garcia评分量表评估大鼠的神经功能,该量表主要从自主活动、提尾悬空时四肢活动对称情况、提尾至桌面边缘时前肢伸展情况、攀爬和抓持铁笼的能力、身体感觉反应、两侧胡须触觉反射情况这6个方面进行考察,每个方面均根据情况给予0~3分,总分为18分,分数越低说明神经功能受损越严重。该步骤由同一名不清楚分组情况的实验员完成,以更加客观地进行评判。
1.4血清TNF-α、IL-10、IL-1β水平检测 大鼠再灌注24 h时采集股动脉血3 ml,3 000 r/min离心10 min,提取上层血清。采用酶联免疫吸附法(ELISA)测定血清TNF-α、IL-10、IL-1β水平,试剂盒均购于上海酶联生物科技有限公司。采用96孔板,设立标准孔,于每孔中分别加入稀释好的标准品稀释液50 μl,设立空白孔和待测样品孔,均加入样品稀释液40 μl、待测样品10 μl,晃动混匀,封膜室温孵育30 min,倒掉液体,甩干,洗涤缓冲液清洗,甩干,除空白孔外,每孔加入对应的酶标试剂50 μl,封膜室温孵育30 min,倒掉液体,甩干,洗涤缓冲液清洗,甩干,每孔均加入A、B显色剂50 μl,晃动混匀,室温避光孵育15 min,每孔加入终止液50 μl。采用酶标仪(BIO-RAD 680,美国)检测各孔位的光密度值,波长450 nm,以空白对照组校零。
1.5脑梗死面积比较 完成上述实验后断头处死所有大鼠,迅速取出脑组织置于-20℃保存,10 min后取出,切除小脑、低位脑干、嗅球等部位,然后进行连续冠状切片,将切片置于2%TTC溶液中,37℃避光孵育30 min,TTC染色后正常脑组织区域为红色,脑梗死区域为白色,拍照后用图像分析系统软件计算脑梗死面积百分比。
1.6统计学方法 采用SPSS19.0软件,计量资料多组间比较采用单因素方差分析,两两比较采用t检验。
2 结 果
2.1三组大鼠的神经功能比较 三组大鼠的神经功能评分整体比较差异有统计学意义(F=611.164,P=0.000),七氟烷组(12.20±1.12)和模型对照组(7.10±0.53)大鼠神经功能评分明显低于对照组(18.00±0.00),七氟烷组大鼠神经功能评分明显高于模型对照组(P<0.05)。
2.2三组血清TNF-α、IL-10、IL-1β水平比较 三组血清TNF-α、IL-10、IL-1β水平整体比较差异有统计学意义(P<0.05),七氟烷组和模型对照组血清TNF-α、IL-1β水平明显高于对照组,IL-10水平明显低于对照组(P<0.05);七氟烷组血清TNF-α、IL-1β水平明显低于模型对照组,IL-10水平明显高于模型对照组(P<0.05)。见表1。
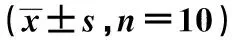
表1 三组血清TNF-α、IL-10、IL-1β水平比较
与对照组比较:1)P<0.05;与模型对照组比较:2)P<0.05
2.3三组大鼠脑梗死面积百分比比较 三组大鼠的脑梗死面积百分比整体比较差异有统计学意义(F=12 269.165,P=0.000),七氟烷组〔(10.14±0.22)%〕和模型对照组〔(16.21±0.34)%〕脑梗死面积百分比明显高于对照组〔(0.00±0.00)%〕,七氟烷组大鼠脑梗死面积百分比明显低于模型对照组(P<0.05)。
3 讨 论
脑组织贮氧量低,但耗氧量占全身总耗氧量的20%左右,因此,脑组织对缺血、缺氧非常敏感,长时间的缺血可导致脑组织出现不可逆损伤,尽快恢复正常的血液流通是治疗脑缺血的基础。然而,脑缺血再灌注可进一步对脑组织造成伤害,增加脑缺血患者的治疗难度。因此,探究脑缺血再灌注损伤的防治方案具有重要的临床意义〔10〕。目前临床上常用的缺血再灌注损伤的防治方案主要包括缺血预处理、缺血后处理、亚低温疗法、阻止细胞内Ca2+超载、减少自由基生成、抗炎症反应、吸入性麻醉剂等〔11〕。吸入性麻醉剂具有安全可靠、易于控制等特点,是临床全麻手术常用的麻醉方式。相关研究发现〔12〕,吸入性麻醉剂可减轻脑、肾脏、肝脏、心脏等由缺血再灌注引起的损伤。七氟烷是一种吸入性麻醉药,相关研究结果显示〔13〕,七氟烷可降低脑缺血再灌注模型大鼠血清中的炎症因子水平,减轻炎症反应,进而起到脑保护作用。
脑缺血发生后活性氧簇及活性氮簇含量增加,二者可相互作用形成过氧亚硝酸盐,进而对神经元造成损伤。同时,脑缺血再灌注后的细胞内Ca2+超载、氧化应激反应、能量代谢障碍等可促进线粒体通透性转换孔过度开放,导致线粒体基质渗透压明显上升,出现线粒体肿胀、外膜破裂,细胞色素C进入细胞质,激活细胞凋亡相关因子Caspase-3,导致神经元细胞凋亡〔14〕。本次研究提示脑缺血再灌注可对神经功能造成损伤,而七氟烷预处理可降低这种损伤,起到保护大鼠神经功能的作用。TNF-α和IL-1β是常见的炎症因子,在脑缺血再灌注损伤中起到重要作用。发生脑缺血再灌注后中性粒细胞聚集、浸润,与血管周围的巨噬细胞产生TNF-α、IL-1β等多种炎性因子,发生炎症反应,损伤脑组织〔15〕。IL-10是天然免疫过程中的重要调节因子,可抑制巨噬细胞产生TNF-α、IL-1β等多种炎性因子,进而降低炎症反应〔16〕。在本次研究中,建立脑缺血再灌注模型后大鼠血清中TNF-α、IL-1β水平增加、IL-10水平降低,而七氟烷预处理可缓解这种趋势,降低炎症反应。本研究结果还显示,七氟烷预处理可减少脑缺血再灌注模型大鼠的脑梗死面积,能对脑起到保护作用。七氟烷预处理能抑制血管扩张,降低代谢程度,进而延缓氧和葡萄糖的使用速度,减轻脑缺血引起的乳酸堆积,并且能抑制自由基合成和脂质过氧化反应,减轻氧化性损伤〔17〕。另外,余琼等〔18〕研究显示,七氟烷预处理可抑制血管细胞黏附分子(VCAM)-1、细胞间黏附分子(ICAM)-1、基质金属蛋白酶(MMP)-2和MMP-9上调,而上述四种指标均含有核转录因子-κb 反应元件。已有研究证明〔19〕,核转录因子-κb 拮抗剂可缓解脑缺血再灌注损伤。因此,可以推测,七氟烷抑制VCAM-1、ICAM-1、MMP-2、MMP-9表达也是其改善脑缺血再灌注损伤的机制之一。
综上所述,七氟烷预处理可有效改善缺血再灌注损伤大鼠神经功能,并可降低血清TNF-α、IL-10、IL-1β水平,减轻脑缺血再灌注后的脑梗死面积,对脑组织有一定的保护作用。
4 参考文献
1Wang T,Duan S,Wang H,etal.Neurological function following cerebral ischemia/reperfusion is improved by the Ruyi Zhenbao pill in a rats〔J〕.Biomed Rep,2016;4(2):161-6.
2刘永臣,刘景彬,温 敏,等.七氟醚预处理对缺血再灌注损伤大鼠的神经保护作用及机制研究〔J〕.现代生物医学进展,2016;16(29):5630-2.
3杨 帅,李绪东,钟 镝,等.脑缺血再灌注损伤机制的研究进展〔J〕.神经疾病与精神卫生,2015;15(6):620-4.
4Fang X,Li Y,Qiao J,etal.Neuroprotective effect of total flavonoids from Ilex pubescens against focal cerebral ischemia/reperfusion injury in rats〔J〕.Mol Med Rep,2017;16(5):7439-49.
5Park JH,Park Ok,Cho JH,etal.Anti-inflammatory effect of tanshinone I in neuroprotection against cerebral ischemia-reperfusion injury in the gerbil hippocampus〔J〕.Neurochem Res,2014;39(7):1300-12.
6李 冠,夏 振.姜黄素对大鼠脑缺血再灌注损伤炎症反应和血脑屏障通透性的作用研究〔J〕.现代中西医结合杂志,2015;24(8):814-6.
7吴周全,崔苏扬,李 立,等.七氟醚预处理对心肺转流后患者脑损伤的影响〔J〕.临床麻醉学杂志,2013;29(5):439-42.
8Li XQ,Cao XZ,Wang J,etal.Sevoflurane preconditioning ameliorates neuronal deficits by inhibiting microglial MMP-9 expression after spinal cord ischemia/reperfusion in rats〔J〕.Mol Brain,2014;7(1):1-14.
9陈卫伟,杨留才,潘施文,等.线栓法制备SD大鼠局灶性脑缺血再灌注损伤模型〔J〕.中国组织工程研究与临床康复,2011;15(50):9377-80.
10王富明,徐 虹,孙 华,等.脑缺血再灌注损伤治疗的实验研究进展〔J〕.医学研究杂志,2015;44(2):12-5.
11Deng B,Gou X,Chen H,etal.Targeted delivery of neurogenin-2 protein in the treatment for cerebral ischemia-reperfusion injury〔J〕.Biomaterials,2013;34(34):8786-97.
12战 珑,韩建阁.吸入性麻醉药和静脉麻醉药及其副作用研究新进展〔J〕.实用临床医药杂志,2015;19(13):200-2.
13陈红生,曹 苏.七氟醚后处理对大鼠脑缺血-再灌注后炎症因子水平的影响〔J〕.江苏医药,2016;42(15):1641-3.
14Zhang X,Yan H,Yuan Y,etal.Cerebral ischemia-reperfusion-induced autophagy protects against neuronal injury by mitochondrial clearance〔J〕.Autophagy,2013;9(9):1321-33.
15赵 培,朱金墙,梁钰彬,等.肿瘤坏死因子-α在脑缺血再灌注炎症损伤中的作用〔J〕.中国老年学杂志,2017;37(14):3628-30.
16吕 翠,刘 倩,曾现伟.IL-10基因修饰的BMSCs对大鼠脑缺血再灌注损伤炎性因子及神经细胞凋亡的影响〔J〕.中国修复重建外科杂志,2017;31(2):240-5.
17庞 勇.七氟醚预处理对缺血再灌注损伤大鼠的神经保护作用及机制研究〔J〕.现代预防医学,2015;42(21):3959-61.
18余 琼,梁伟民.七氟醚预处理对脑缺血再灌注损伤后含核转录因子κB反应元件相关蛋白的影响〔J〕.中国临床神经科学,2013;21(5):504-12.
19秦文熠,荣晓凤,陶 涛,等.核转录因子-κB拮抗剂对大鼠海马CA1区局灶性脑缺血再灌注损伤的影响〔J〕.中华神经科杂志,2016;49(1):45-53.
