盐酸土霉素可溶性粉在肉鸡组织中的残留消除研究
2018-06-23邱瑾丽李红娇张崇威
邱瑾丽,李红娇,张崇威
(1.郑州福源动物药业有限公司,郑州 450001;2.河南省兽药饲料监察所,郑州 450008)
盐酸土霉素为四环素类广谱抗生素,对革兰氏阳性菌和阴性菌均有抑制作用,且具有促进生长的作用,因此,在临床上常用于治疗猪、鸡敏感大肠杆菌、沙门氏菌、巴氏杆菌及支原体引起的感染性疾病[1]。我国农业部对四环素类抗生素在可食性动物组织中的最高残留限量规定为:肌肉100 μg/kg,肝脏300 μg/kg[2],美国食品药品监督管理局规定动物肌肉中四环素类药物总量为200 μg/kg[3]。国内外对土霉素的残留分析方法的研究较多,目前主要使用的有微生物检测法,固相萃取-高效液相色谱法,液相色谱-串联质谱法和放射免疫法[4-7]等。本试验采用的是国家标准规定动物源性食品中四环素类兽药残留量的检测方法[8]。虽然国内外很多研究报道了土霉素在肉鸡肌肉和肝脏中的残留消除规律,确定了土霉素的休药期,但主要研究针对土霉素预混剂和拌料的给药途径。在实际养殖过程中,可溶性粉剂由于饮水给药的便利和药物更易均匀分布,使用范围更广泛。关于盐酸土霉素可溶性粉对肉鸡饮水给药后,在肌肉、肝脏和鸡胗的残留消除规律研究尚未见报道。本试验通过对盐酸土霉素可溶性粉在肉鸡体内残留消除的研究,计算土霉素在不同组织中的休药时间,以期为安全用药和正确执行休药期提供科学依据。
1 材料与方法
1.1 供试试剂 土霉素对照品,批号:130305,中国食品药品检定研究院;盐酸土霉素可溶性粉,规格:50%,生产批号:201605003,郑州福源动物药业有限公司苏可乐;甲醇,乙腈为色谱纯;乙二胺四乙酸二钠为分析纯,超纯水,所需溶液配制见GB/T 21317[8]。
1.2 主要仪器 Acquit UPLC-Xevo TQ-S质谱联用仪,美国Waters 公司;3K-30台式高速冷冻离心机,Sigma公司;R215 Professional旋转蒸发仪,瑞士Buchi公司;IKAMS3.Basic圆周振荡器,广州仪科实验室技术有限公司;ALC-2100.2,赛多利斯科学仪器(北京)有限公司;VX-Ⅲ多管涡旋振荡器,北京踏锦科技有限公司;TTL-DC Ⅱ氮气吹干仪,北京同泰联科技发展有限公司;TD系列固相萃取柱,TD-TPS-00603,天津市天兴达科技有限公司。
1.3 方法
1.3.1 试验动物 三组肉鸡,购自山西省阳城县浩博养殖有限公司,随机分为对照组26日龄,10000只;常规剂量组25日龄,16300只;加大剂量组32日龄,12000只。饲喂不添加任何抗菌药物的全价饲料,自由采食饮水。试验前后各组饲养条件相同。
1.3.2 给药与样品采集 常规剂量组以250 mg/L,加大剂量组333 mg/L集中饮水给药5 d,空白对照组不给药。停药后4 h、3 d、5 d、6 d、7 d、8 d、9 d、10 d分别随机宰杀24只,采集肌肉、肝脏和鸡胗,于-20 ℃保存。
1.3.3 色谱条件 色谱柱:Waters Acquity UPLCTM BEH C18(1.7 μm,2.1×50 mm);柱温30 ℃;流动相A:乙腈,B:0.1%甲酸溶液;进样量5 μL;梯度洗脱程序见表1。

表1 色谱梯度洗脱程序Tab 1 Procedure of gradient elution
1为即时变化,6为线性变化
1.3.4 质谱条件 电喷雾离子源;正离子扫描;多反应监测MRM;离子源温度150 ℃;脱溶剂气容量800 L/h;锥孔电压25 V;锥孔气流速150 L/h;毛细管电压3.3 kV;定性、定量离子对及对应的锥孔电压和碰撞能量见表2。

表2 定性、定量离子及对应的锥孔电压和碰撞能量Tab 2 Qualitative and quantitative ion pair,the corresponding cone volt and collision enerey
1.3.5 标准曲线 精密吸取100 μg/L的土霉素标准中间液0.02、0.05、0.08、0.10、0.20 mL,分别加空白基质0.98、0.95、0.92、0.90、0.80 mL,混匀,制成2、5、8、10、20 μg/L的系列基质标准溶液,依次上机,以土霉素的质量浓度为横坐标,定量离子的色谱峰面积为纵坐标,绘制标准曲线。
1.3.6 样品前处理 称取(2±0.02)g肌肉、肝脏、鸡胗已匀浆样品,置50 mL离心管中,加入15 mL缓冲液,漩涡振荡20 min,14000 r/min低温离心5 min,取上清液进行样品净化。HLB固相萃取小柱用3mL甲醇、3mL水活化。然后分别取上述肌肉、肝脏、鸡胗待净化的上清液注入该萃取小柱中,分别依次用超纯水3 mL、5%甲醇水溶液3 mL淋洗,弃去淋洗液,再用3 mL甲醇洗脱,洗脱液60 ℃水浴中氮气仪吹干,残渣用1 mL 30%甲醇溶液复溶,充分混匀,残渣溶液过0.22 μm针头式过滤器后,滤液供液相色谱-串联质谱法检测。
1.3.7 检测限和定量限 取空白鸡肉、鸡肝和鸡胗试样组织,添加适量的土霉素标准溶液,经处理上机。
1.3.8 灵敏度和准确度 分别取空白鸡肉、鸡肝、鸡胗组织,添加5、10、20 μg/kg的土霉素标准物进行回收率实验,每个浓度做5个平行样品。
2 结果与分析
2.1 线性关系 土霉素在2~20 μg/L浓度范围内
呈现良好的线性关系,其曲线方程为:y=3256x+379.6,相关系数R为0.9995。标准溶液图谱如图1。

图1 10 μg/mL基质工作液的特征色谱图Fig 1 Chromatchromatogram of 10 μg/mL standard solution
2.2 检测限和定量限 根据特征质量色谱峰的信噪比S/N>3为检测限,S/N>10为定量下限,得肌肉、肝脏和鸡胗组织中土霉素的检测限为5 μg/kg,定量下限为10 μg/kg。
2.3 灵敏度和准确度 土霉素在5、10、20 μg/kg 3个添加水平上,其平均回收率、相对标准偏差见表3。土霉素的回收率在79.1%~93.6%之间,相对标准偏差均小于10%。图2为空白鸡肉的土霉素特征离子质量色谱图,图3为空白鸡肉中添加25 μg/kg的土霉素特征离子质量色谱图。

表3 土霉素回收率及相对标准偏差试验Tab 3 Test of recovery rate and relative standard deviation of Oxytetracycline

图2 空白鸡肉的土霉素特征离子质量色谱图Fig 2 The characteristic ion quality chromatogram of oxytetracycline in blank chicken
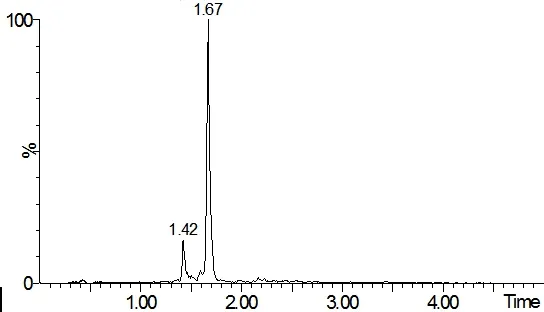
图3 空白鸡肉中添加25 μg/kg土霉素的特征色谱图Fig 3 Chromatogram of oxytetracycline(25 μg/kg) in blank chicken
2.4 肉鸡组织中土霉素残留消除 空白对照组饲养情况和采样时间点与试验组一致,在组织中均未检出土霉素残留,表明试验动物在试验期间未受到其他来源药物的影响。表4、表5结果显示,肉鸡分别按250 mg/L和333 mg/L剂量集中饮水给药50%盐酸土霉素可溶性粉,连续5 d。土霉素在停药0 d的鸡胗部位浓度最高,其次为肝脏,肌肉组织中药物浓度最低。在停药后第5天,两组别的肌肉和肝脏中的药物残留量已低于MRL,分别为44.81 μg/kg和157.56 μg/kg。对于鸡胗,我国尚未规定其最高残留限量。试验结果表明,停药4 h时,鸡胗中药物残留浓度最高,但其消除速度很快;停药5d时,已接近肌肉中的药物残留量,其消除规律与肌肉和肝脏相似。经统计分析,两种给药剂量组在肌肉、肝脏和鸡胗中土霉素残留量的差异不显著(P>0.05)。
2.5 休药期 采用WTl.4软件计算休药期,确保有95%的可信限使99%的残留低于MRL,两试验组在肉鸡不同组织中的休药期见表6。
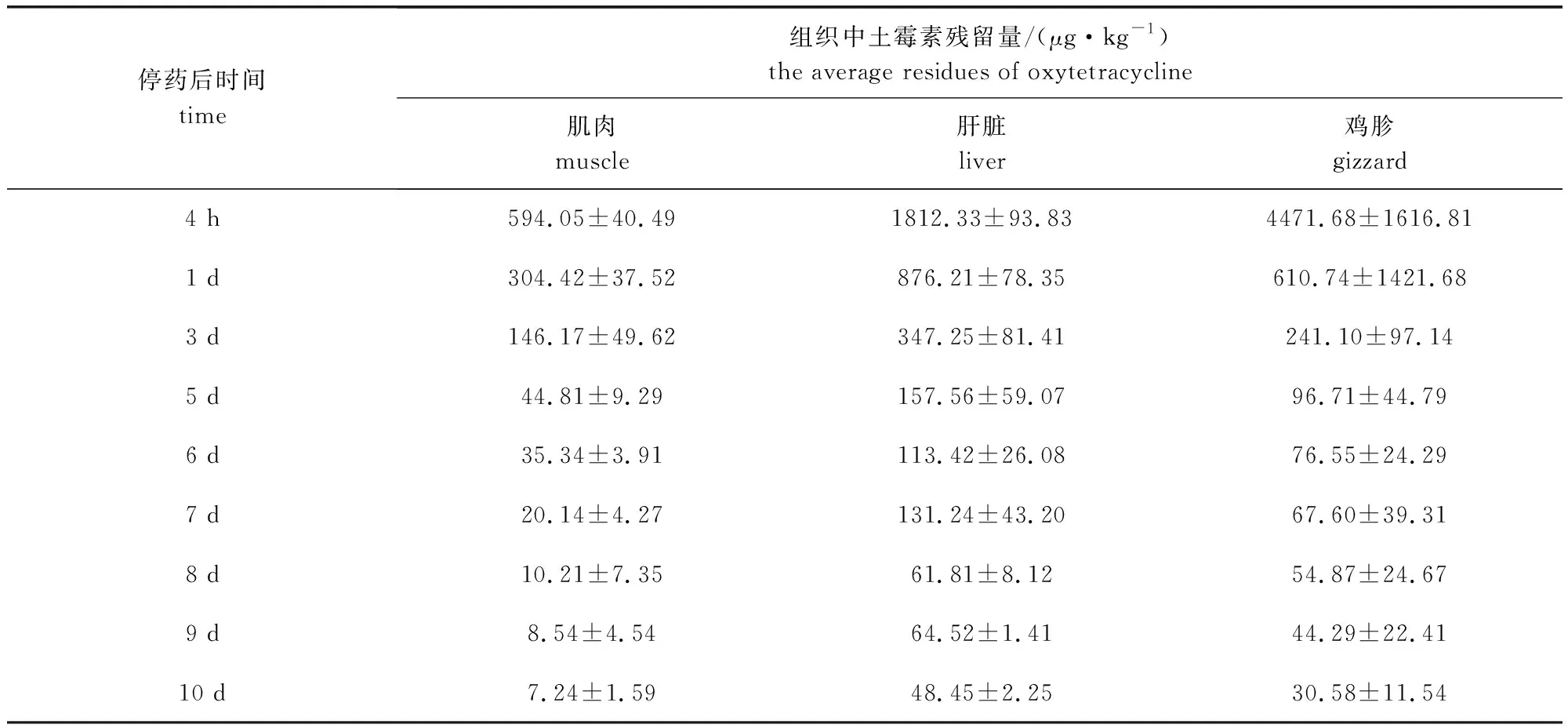
表4 250 mg/L剂量组肉鸡组织中土霉素残留量平均值Tab 4 The average residues of 250 mg/L oxytetracycline in broiler tissues

表5 333 mg/L剂量组肉鸡组织中土霉素残留量平均值Tab 5 The average residues of 333 mg/L oxytetracycline in broiler tissues

表6 土霉素在肉鸡组织中的休药期Tab 6 The withdrawal of oxytetracycline in broiler tissues
结果显示,250 mg/L给药浓度在肉鸡组织中的休药期分别为肌肉4.65 d,肝脏6.17 d,333 mg/L给药浓度的休药期分别为5.71 d,7.85 d,其中肝脏休药时间最长。为了确保消费者健康安全,在实际养殖环境中,50%盐酸土霉素可溶性粉按250 mg/L和333 mg/L给药浓度,建议在肉鸡的休药期分别为7、8 d。
3 讨论与小结
在兽药组织残留消除规律研究中,药物的剂型、生产工艺、动物本身的差异对组织中药物残留浓度都有影响。表4、表5结果表明,两个剂量组肌肉、肝脏中土霉素残留量在停药后5 d均低于国家规定的MRL,本试验结果与刘世磊等报道[9]相似。鸡胗作为消化器官,在停药4 h,药物残留量最大,且药物在该部位消除迅速,停药5 d药物残留量低于肝脏,这是因为肝脏是土霉素的主要代谢器官。
表6结果表明,经WTl.4软件计算,250 mg/L剂量组肌肉的休药期符合说明书中休药期5 d的规定,但是,250 mg/L剂量组肝脏和333 mg/L剂量组肌肉和肝脏的休药期结果与说明书规定不一致,虽然停药后5 d,两组动物的肌肉和肝脏中的药物残留都已低于MRL,但本试验数据采用WT1.4软件处理,在统计学上考虑了各种药物由于剂型或处方的不同以及动物本身的差异,使计算得到的休药期数据与国家规定的不一致。而其他文献报道是根据残留浓度低于MRL的停药时间点来确定休药期[1]。因此,为确保动物性食品更高的安全性,在上述两种方法饮水给药50%盐酸土霉素可溶性粉后,根据使用剂量建议休药期分别为7、8 d。对于本研究中与说明书规定休药期不一致的情况,可能是休药期计算方式或动物之间差异造成。现今消费者对于鸡胗的食用量加大,但是我国对鸡胗这个可食性组织的残留限量未做出规定,因此本试验的研究为制定鸡胗组织合理休药期提供了一定的科学依据。
参考文献:
[1] 杨 柳. 土霉素预混剂在鸡的休药期验证及鸭标签外用休药期研究[D]. 武汉: 华中农业大学国家兽药残留基准实验室(HZAU)/农业部食品安全评价重点开放实验室, 2008.
Yang L,Validation of Oxytetracyeline Premix Withdrawal Period in broiler chieken and Estimate of Withdrawal Period After Extralabel Use of Oxytetracycline Premix to Duek[D].Wuhan:National Refercnee Laboratory of Veterinary Drug Residues(HZAU)/MOA Key Laboratory of Food Safety Evaluation,Huazhong Agrieultural University,2008.
[2] 中华人民共和国农业部公告第235号. 动物性食品中兽药最高残留限量[S].
Announcement No.235 of the Ministry of Agriculture, Maximum Residue Limit of Veterinary Drugs in Animal Food[S].
[3] U. S. Code of Federal Regulations. U.S. Government Printing Office, Washington DC [S].
[4] 邢 进, 冯育芳, 岳秉飞, 等. 微生物法检测实验动物血清中的抗生素残留[J]. 中国比较医学杂志, 2013, 23(4): 57-60.
Xing J ,Feng Y F,Yue B F ,etal.Antibiotic Residue Monitoring in Laboratory Animal Serum by Microbial Inhibition Test[J]. Chinese Journal of Comparetive Medicine,2013,23(4):57-60.
[5] 陈小燕, 牛玉玲, 朱 敏, 等. 固相萃取-高效液相色谱法测定牛奶中四环素类抗生素[J]. 中国抗生素杂志, 2017, 42(2): 129-233.
Chen X Y,Niu Y L,Zhu M,etal.Determination of Tetracycline Antibiotics in Milk by Solid Phase Extraction Combined with High Performance Liquid Chromatography[J].Chinese Journal of Antibiotics,2014,42(2):129-233.
[6] 张 勋, 吴连鹏, 李 玲, 等. 液相色谱-串联质谱法测定进出口多种食用活动物体液及肉中四环素类药物残留量[J]. 化学试剂, 2016, 38(12): 1178-1182.
Zhang X,Wu L P,Li L,etal. Determination of Four Tetracyclines from Body Fluid and Meat of Various Import and Export Edible Living Animals by Liquid Chromatography-Tandem Mass Spectrometry[J]. Chemical Reagents,2016,38(12):1178-1182.
[7] 苏明明, 王 翛, 王晓薇, 等. 放射免疫法快速检测牛血清中四环素类药物[J]. 食品安全质量检测学报, 2016, (2): 629-633.
Su M M,Wang X,Wang X Wetal. Detection of Tetracycline in Bovine Serum With Radioimmunoassay Method[J]. Journal of Food Safety and Quality, 2016, (2): 629-633.
[8] GB/T 21317-2007. 动物源性食品中四环素类兽药残留量检测方法 液相色谱-质谱/质谱法与高效液相色谱仪[S].
GB/T 21317-2007 Determination of Tetracyclines Residues in Food of Animal Origin - LC-MS/MS Method and HPLC Method[S].
[9] 刘世磊, 李松彪, 李兆周,等. 土霉素在肉鸡体内的消除代谢及对肌肉品质的影响[J]. 畜牧与饲料科学, 2012, 33(5/6):8-10.
Liu S L,Li S B,Li Z Zetal. Elimination Metabolism of Oxytetracycline in Broilers and Its Influence on Muscle Quality[J]. Animal Husbandry and Feed Science, 2012, 33(5/6):8-10.
