塔拉多糖的脱色工艺化研究
2018-06-23李占君刘运伟张忠林张志环杨逢建
李占君 刘运伟 张忠林 张志环 马 珂 杨逢建
(1.黑龙江省伊春林业科学院,伊春 153000; 2.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
塔拉(CaesalpiniaspinosaKuntze)又名刺云实,是豆科(Leguminosae sp.)植物中的一种,在我国国内塔拉作为单宁、多糖类植物资源多数是以进口的形式从南美洲引种栽培[1~3]。塔拉具有重大经济效益、生态效益和社会效益的珍贵经济林木[4]。在饱满状况下正常的塔拉豆荚中塔拉果壳含量约占种子总质量的65%,种仁中富含大量的乳葡萄糖甘露聚糖多糖,其含量约为34%,在自然界中塔拉籽中的植物多糖是以大分子物质的形式得以存在[5~6]。现阶段研究得知塔拉多糖具有无毒可食性,在食品、保健、医药、纺织、造纸、工业冶金等诸多领域得以广泛性应用,具有非常重要的意义[7~10]。虽然现阶段工业化制备塔拉多糖工艺水平较高,但塔拉多糖的品质往往也会因为工艺操作过程中色素杂质的残留而受到较大程度的影响。本实验主要针对塔拉多糖脱色工艺予以展开研究与讨论,采用单因素实验和正交实验相结合的方法对塔拉多糖的脱色化工艺进行分析与优化,并取得了较好的脱色结果,为塔拉多糖的脱色工艺性研究提供现了现实可靠的理论性依据,也对塔拉的工业化加工生产具有重要的指导性意义。
1 材料与方法
1.1 试剂与仪器
1.1.1 材料与试剂
材料:塔拉多糖粉末,购于云南中科院分院。
试剂:活性炭颗粒、活性炭粉末、过氧化氢,所用试剂由天津市科密欧化学试剂有限公司。
1.1.2 仪器
BS124S型电子天平(北京SartoriouS仪器系统有限公司)、电热恒温水浴锅(天津泰斯特仪器有限公司)、3K-30超速离心机(美国SIGMA公司)。
1.2 实验方法
塔拉多糖脱色处理过程中的脱色剂主要包括:活性炭颗粒、活性炭粉末以及过氧化氢。脱色过程中,以多糖脱色率和多糖最终保留率为主要考察指标,通过对比这两项指标得出最佳脱色实验过程中所涉及到的各项参数配比,并对脱色剂用量、脱色时间、脱色温度、脱色次数进行3因素选择,为正交优化实验做好前期准备,通过多次、重复性正交实验以探究塔拉多糖脱色过程中最佳工艺参数[11~14]。
1.2.1 材料的处理
蒸馏水为实验过程中的反应溶剂,并将脱蛋白处理过的塔拉多糖粉末溶于其中,以获得所需浓度的多糖性水溶液(1 mg·mL-1),并以40 mL浓度为30%的过氧化氢水溶液为母液稀释定容为100 mL留以备用。
1.2.2 脱色实验
取50 mL具塞离心管3支,将所制备的多糖性水溶液分别置于这3支离心管中,每支5 mL,分别添加活性炭颗粒和活性炭粉末各0.3 g,制备所得的过氧化氢水溶液30 mL,45℃恒温水浴90 min,水浴完成后,5 000 r·min-1、10 min离心处理,使其固液分离。对离心后的3支上清溶液450和490 nm两处的处吸光值予以测定,加以空白对照,最终计算得出各脱色率、多糖保有率[15]。
1.2.3 脱色实验结果
以活性炭颗粒、活性炭粉末以及过氧化氢这3种物质为脱色剂对塔拉多糖性水溶液进行脱色处理(图1)。

图1 塔拉多糖脱色实验结果Fig.1 Tara polysaccharide decolorization experiment results
对图1分析可知,3种脱色剂在对塔拉多糖性水溶液处理的过程中,活性炭颗粒对多糖脱色的效果最佳、最为合理,根据该实验的结果,以活性炭颗粒为最佳脱色剂,并在单因素实验的基础上,结合其它3个影响显著因素为研究对象进行下一步的正交优化实验。
1.2.4 活性炭颗粒脱色实验
准确量取5 mL,1 mg·mL塔拉多糖溶液于50 mL具塞离心管中,并将脱色过程中的药品剂量、时间、温度以及次数予以设定,进行单因素实验;实验完毕后对多糖溶液进行450和490 nm两处吸光值予以测定,最终通过精确计算得出各脱色率、多糖保留率[16]。
1.2.5 正交优化
在单因素实验的基础上,对该组实验因素进行研究与分析,以脱色剂用量、脱色时间、脱色温度、脱色次数为优化研究对象进行正交实验;并对最终测定数据结果进行横向对比分析[17]。目的是为了使得整体实验过程中选择出的塔拉多糖脱色工艺参数配比的最佳合理化(表1)。
表1L9(34)正交实验各因素水平表
Table1L9(34)Tableoffactorsandlevelsoforthogonalexperiment

因素Factors水平Level-101A-脱色剂用量Decoloring agent dosage(g)0.200.400.60B-脱色时间Decolorization time(min)456075C-脱色温度Decolorization temperature(℃)455565D-脱色次数Decolorization times123
2 结果与讨论
2.1 脱色剂用量的影响
在塔拉多糖脱色实验操作过程中,多糖脱色率、保留率所受到脱色剂用量的影响程度,在一定程度上也会受到脱色所用时间、温度以及次数之间综合性作用的制约。实验操作过程中各项参数为:脱色用时45 min,温度45℃、次数1次,用以研究和分析脱色剂量对多糖脱色率及保留率的影响。

图2 脱色剂用量单因素实验Fig.2 Single factor experiment of decoloring agent dosage
对图2分析可知,0.6 g是药剂影响投放量的一个临界值,当脱色剂用量少于0.6 g时,多糖脱色率会随着脱色剂的增加而得到相应的提升且提升幅度较大,而塔拉多糖的保留率会因脱色剂的增加而得到相应水平的降低,并且多糖保留率降低幅度较大,这是由于反应混合溶液中脱色剂量对该种情况下溶液中的多糖脱色率和保留率的影响能力处于非饱和状态。当脱色剂用量达到0.6 g时,表现为塔拉多糖的脱色率提升达到最高水平,此时多糖脱色率和保有率的降低水平处也开始趋于水平走势;当脱色剂用量大于0.6 g时,塔拉多糖的脱色率和保留率二者并未因脱色剂的增加而发生明显性改变,甚至继续趋于平缓走势,此时主要是由于反应混合溶液中脱色剂对该种情况下塔拉溶液中的多糖脱色率和保留率的影响能力逐渐趋于极限状态,因此变化程度不为明显。综合考虑多糖保留率和脱色率二者之间关系,将正交优化实验过程中所涉及的脱色剂用量定为0.2~0.6 g。
2.2 脱色时间的影响
在塔拉多糖脱色实验操作过程中,多糖脱色率、保留率所受到脱色时间的影响程度,在一定程度上也会受到脱色剂用量、脱色温度以及脱色次数之间综合性作用的制约。实验操作过程中各项参数为: 脱色剂用量0.4 g、脱色温度45℃、脱色次数1次,用以研究和分析脱色时间对多糖脱色率及保留率的影响。
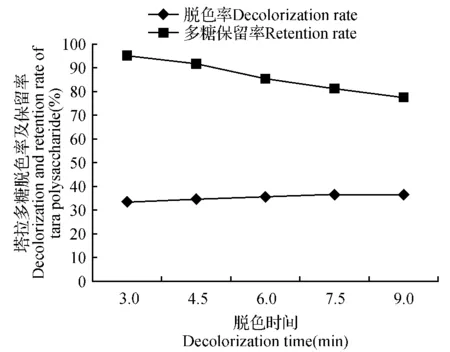
图3 脱色时间单因素实验Fig.3 Decolorization time single factor experiment
对图3分析可知,多糖脱色率及多糖保留率与脱色时间有着较为密切的联系,当脱色时间不足75 min时,塔拉多糖脱色率与脱色时间二者之间是呈现出一定程度的正相关性,且提升幅度较为明显;此时多糖保留率会因脱色时间的增加而发生大幅度的降低,这是由于反应混合溶液中脱色剂会随着脱色时间的延长而对该种情况下溶液中的多糖脱色率和保留率的影响能力得到加强。当脱色时间达到75 min时,塔拉多糖脱色率会因脱色时间的增加而发生较小幅度的提升;而多糖保留率处于较低水平;当脱色时间大于75 min时,塔拉多糖的脱色率和保留率二者并未因脱色时间的增加而发生明显性改变,是由于随着脱色时间的延长,脱色剂对多糖混合溶液的作用效果逐渐趋于完全,因此变化程度不为明显。综合考虑多糖保留率和脱色率二者之间关系,将正交优化实验过程中所涉及的脱色时间区间定为:45~75 min。
2.3 脱色温度的影响
在塔拉多糖脱色实验操作过程中,多糖脱色率、保留率所受到脱色温度的影响程度,在一定程度上也会受到脱色剂用量、脱色时间、脱色次数之间综合性作用的制约。操作过程中各项参数为: 脱色剂用量0.4 g、脱色时间45 min、脱色次数1次,用以研究和分析脱色温度对多糖脱色率及保留率的影响。
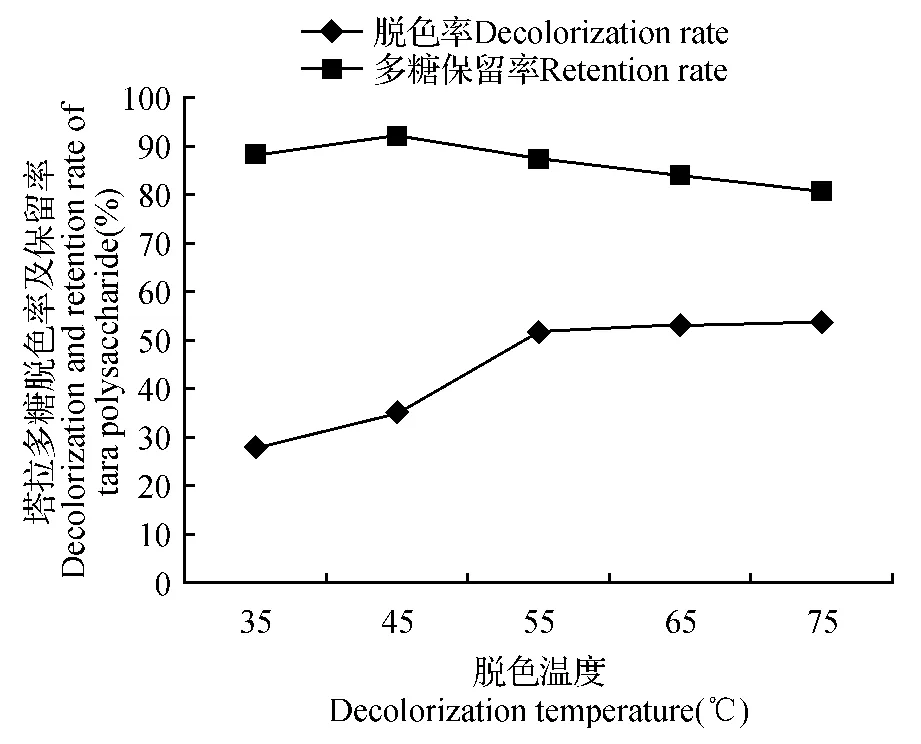
图4 脱色温度单因素实验Fig.4 Decolorization temperature single factor experiment
当脱色温度处于45~55℃时,多糖脱色率会随着脱色温度的升高而得到相应的提升且提升幅度较大;此时塔拉多糖的保留率也会因脱温度的升高而得到相应水平的降低,且降低幅度较为明显,这是由于反应混合溶液中脱色剂会因反应混合溶液温度的升高,使得分子之间运动加剧,进而对该种情况下溶液中的多糖脱色率和保留率的影响能力得到加强。当脱色温度达到55℃时,表现为塔拉多糖的脱色率提升幅度和多糖保有率降低水平二者均开始逐渐变缓;当脱色温度高于55℃时,塔拉多糖的脱色率和保留率二者并未因脱色温度的升高而发生明显性改变,这是由于随着脱色温度的升高,脱色剂脱色能力的提升已接近最高限度,因此脱色剂对多糖混合溶液的作用效果不为明显。综合考虑多糖保留率和脱色率二者之间关系,将正交优化实验过程中所涉及的脱色温度区间定为:45~65℃。
2.4 脱色次数的影响
在塔拉多糖脱色实验操作过程中,多糖脱色率、保保留率所受到脱色次数的影响程度,在一定程度上也会受到脱色剂用量、脱色时间、脱色温度之间综合性作用的制约。实验操作过程中各项参数为: 脱色剂用量0.4 g、脱色时间45 min、脱色温度45℃,用以研究和分析脱色次数对多糖脱色率及保留率的影响。

图5 脱色次数单因素实验Fig.5 Decolorization time factor experiment
对图5分析可知,多糖脱色率、多糖保留率与脱色次数有着较为密切的联系,一定范围内多糖脱色率会因脱色次数的增加而得到一定幅度的提升,相应塔拉多糖保留率会因脱色次数的增加而发生明显性的下降,当脱色次数达到3次时多糖脱色率和保留率基本变化开始变得不为明显且保持较为恒定,这是由于反应混合溶液中脱色剂会随着脱色次数的增加而对该种情况下溶液中的多糖脱色率和保留率的影响能力得到加强,并因脱色次数的增加相应脱色作用效果逐渐趋于完全。综合考虑多糖保留率和脱色率二者之间关系,将正交优化实验过程中所涉及的脱色次数定为:3次。
2.5 正交优化
在进行正交优化的过程中,分别以A-脱色剂用量、B-脱色时间、C-脱色温度、D-脱色次数4因素的水平予以展开,实验优化结果如表2所示。
对塔拉多糖脱色实验进行正交优化后,通过对表1~2中的方差和均值分析可知,在塔拉多糖脱色反应过程中,各影响因素对多糖脱色率所造成的影响程度依次为:D-脱色次数>C-脱色温度>A-脱色剂用量>B-脱色时间;而各影响因素对多糖保留率所造成的影响程度依次为:A-脱色剂用量>B-脱色时间>D-脱色次数>C-脱色温度。
通过对实验进行正交优化,经方差分析可知,实验最终结果中脱色次数与多糖保留率二者之间存在一定程度的联系,且具有一定的极显著性影响(P<0.01)而温度对多糖的保留率也具有显著性影响(P<0.05)。通过对塔拉多糖脱色率、保留率综合分析研究得出:塔拉多糖脱色工艺的最佳工艺参数配置为:A2、B2、C3、D1,具体参数为脱色剂用量0.6 g,脱色所用时间45 min、脱色所需温度45℃、脱色要求次数3次,最佳实验结果脱色率可达到50.55%,此时多糖保留率为92.92%。

表2 正交实验设计与结果
2.6 验证性实验
将正交优化所得实验结果与四个单因素实验进行综合对比分析,以及将正交优化所得塔拉多糖脱色最佳工艺条件及多糖保留的最优条件进行方差检验分析,得出具体实际工艺优化参数为:脱色剂用量0.6 g、脱色时间45 min、脱色温度45℃、脱色次数3次;验证实验结果为:脱色率50.21%,多糖保留率90.39%。充分说明实际实验结果与正交优化方案中所得出的塔拉多糖脱色率和保留率稳合性较好,该正交优化方案具有较强的科学理论性和置信性。
3 结论
本实验主要针对塔拉多糖的脱色工艺展开研究,在具体实际实验过程中以活性炭颗粒、活性炭粉末、过氧化氢作为塔拉多糖溶液脱色试剂。在单因素实验的基础上选出活性炭颗粒作为最佳合理性脱色试剂,并为接下来将要展开的正交优化实验做好必要的前期准备,最终通过实验因素优化得出最佳合理性工艺参数配置。在对塔拉多糖水溶液进行脱色实验的过程中,得出实验过程中涉及到的多项实验数:脱色剂用量、脱色时间、脱色温度、脱色次数对塔拉多糖的脱色率具有不同程度上的影响,通过正交优化实验结果得出影响因素对多糖脱色率所造成的影响程度依次为:D-脱色次数>C-脱色温度>A-脱色剂用量>B-脱色时间,而各影响因素对多糖保留率所造成的影响程度依次为:A-脱色剂用量>B-脱色时间>D-脱色次数>C-脱色温度。
塔拉多糖脱色正交优化最佳实验参数为:脱色剂用量0.6 g、脱色时间45 min、脱色温度45℃、脱色次数3次,最终理论预期塔拉多糖脱色率50.55%,多糖保留率92.92%,在实际验证性实验过程中实验结果为:脱色率50.21%,多糖保留率90.39%,具有较高的吻合性。与冯慎等[18],活性炭脱色具有较好脱色效果,并且能够最大限度的保留多糖成分,结果趋于一致。充分说明正交优化对塔拉多糖的脱色工艺优化切实可行,能够对塔拉多糖进行合理性脱色工化处理。
1.张建云,李志国,夏定久,等.塔拉单宁和塔拉多糖研究现状[J].天然产物研究与开发,2009,21(1):183-188.
Zhang J Y,Li Z G,Xia D J,et al.Investigating actuality and the vista of Tara tannin and Tara polysaccharide[J].Natural Product Research and Development,2009,21(1):183-188.
2.马文秀,罗庆云,尚征贤,等.塔拉豆多糖研究[J].林产化学与工业,1999,19(4):29-34.
Ma W X,Luo Q Y,Shang Z X,et al.Study on polysaccharide in Tara seed[J].Chemistry and Industry of Forest Products,1999,19(4):29-34.
3.蒋建新,朱莉伟,张卫明,等.塔拉多糖胶的研究[J].西南林学院学报,2003,23(4):12-16.
Jiang J X,Zhu L W,Zhang W M,et al.Study on properties ofCaesalpiniaspinosapolysaccharide gum[J].Journal of Southwest Forestry College,2003,23(4):12-16.
4.夏定久,李志国.塔拉的工业用途与丰产栽培[M].昆明:云南科技出版社,2005:175-179.
Xia D J,Li Z G.Industrial use and high yield of Tara[M].Kunming:Yunnan Science & Technology Press,2005:175-179.
5.陈笳鸿,吴在嵩,毕良武,等.塔拉提取物化学利用的研究进展[J].林产化学与工业,1996,16(3):79-86.
Chen J H,Wu Z S,Bi L W,et al.Development of research on chemical utilization of tara extractives[J].Chemistry and Industry of Forest Products,1996,16(3):79-86.
6.孟凡欣,蒋朝军,于笑坤,等.刺五加多糖的提取及含量测定[J].食品工业科技,2005,(7):110-112.
Meng F X,Jiang C J,Yu X K,et al.Extraction of polysaccharides fromAcanthopanaxsenticosusand determination of polysaccharides content[J].Science and Technology of Food Industry,2005,(7):110-112.
7.何先元,许晋芳,王秋霜,等.当归多糖的超声提取及含量测定[J].中国药业,2010,19(19):34-35.
He X Y,Xu J F,Wang Q S,et al.Ultrasonic extraction and determination of polysaccharide inRadixangelicaesinensis[J].China Pharmaceuticals,2010,19(19):34-35.
8.方婷,曾红亮,陈晓垚,等.猪肚菇粗多糖脱蛋白脱色工艺优化研究[J].热带作物学报,2015,36(6):1166-1172.
Fang T,Zeng H L,Chen X Y,et al.Process optimization of deproteinization and decoloration from pork tripe mushroom crude polysaccharide[J].Chinese Journal of Tropical Crops,2015,36(6):1166-1172.
9.Omeje K O,Eze S O O,Ozougwu V E O,et al.Application of papain from Paw Paw(Caricapapaya) latex in theHydrolysisof Tiger Nut(C.esculentus) proteins[J].Mitteilungen Klosterneuburg,2014,64.
10.Cao J,Gonzalez-Covarrubias V,Straubinger R M,et al.A rapid,reproducible,on-the-fly orthogonal array optimization method for targeted protein quantification by LC/MS and its application for accurate and sensitive quantification of carbonyl reductases in human liver[J].Analytical Chemistry,2010,82(7):2680-2689.
11.Palanivel R,Koshy Mathews P.Prediction and optimization of process parameter of friction stir welded AA5083-H111 aluminum alloy using response surface methodology[J].Journal of Central South University,2012,19(1):1-8.
12.Nassourou M A,Njintang Y N,Noubissié T J B,et al.Genetics of seed flavonoid content and antioxidant activity in cowpea(VignaunguiculataL.Walp.)[J].The Crop Journal,2016,4(5):391-397.
13.孟宪军,李冬男,汪艳群,等.五味子多糖超声波提取条件的研究[J].食品工业科技,2010,31(4):313-315,319.
Meng X J,Li D N,Wang Y Q,et al.Study on ultrasound-assisted extraction polysaccharides fromSchisandrachinensisTurcz.Bail.[J].Science and Technology of Food Industry,2010,31(4):313-315,319.
14.邸明磊,单晓菊,马丽娜,等.苯酚—硫酸法测定苦豆子多糖含量[J].现代中药研究与实践,2012,26(1):59-61.
Di M L,Shan X J,Ma L N,et al.Determination of polysaccharide inSophoraalopecuroidesL.by the method of phenol-vitriol[J].Research and Practice on Chinese Medicines,2012,26(1):59-61.
15.谢建华,申明月,刘昕,等.苦瓜中多糖含量测定方法的研究[J].中国食品添加剂,2009(6):209-213.
Xie J H,Shen M Y,Liu X,et al.Study on the determination method of polysaccharide content inMomordicacharantiaL.[J].China Food Additives,2009(6):209-213.
16.刘燕,陈小银,杨丽丽,等.响应面优化菊芋菊糖的提取工艺研究[J].植物研究,2016,36(4):627-633.
Liu Y,Chen X Y,Yang L L,et al.Extraction process optimization of inulin fromHelianthustuberosusL.by response surface methodology[J].Bulletin of Botanical Research,2016,36(4):627-633.
17.路祺,高悦,项凤影,等.牡丹种荚多糖提取工艺研究[J].植物研究,2015,35(1):154-157.
Lu Q,Gao Y,Xiang F Y,et al.Polysaccharide extraction from peony seed pods by water bath[J].Bulletin of Botanical Research,2015,35(1):154-157.
18.冯慎,陈爽,李妍,等.植物多糖的纯化工艺研究进展[J].天津化工,2010,24(6):5-8.
Feng S,Chen S,Li Y,et al.Process of work in polysaccharide’s purification[J].Tianjin Chemical Industry,2010,24(6):5-8.
