清热止咳方对肺炎支原体感染BALB/c小鼠NLRP3炎性体mRNA表达的影响*
2018-06-22张涵索绪斌张云凌姚琳许庆瑞张树明王伟明
★ 张涵 索绪斌 张云凌* 姚琳 许庆瑞 张树明 王伟明
(1.黑龙江省中医药科学院 哈尔滨 150036;2.广东药科大学 广州 510006)
肺炎支原体(mycoplasma pneumonia, MP)是引发社区获得性肺炎(community-acquired pneumonia,CAP)的主要病原体之一,其引发的支气管炎或者肺炎,不仅常见于婴幼儿,也见于成人[1]。因其病程较长,且可引发哮喘及肺外症状,越来越受到学者们的关注。其发病机制可能与细胞黏附、社区获得性呼吸窘迫综合症毒素破坏及机体免疫异常有关[2-5]。NLRP3炎性体是一种细胞内模式识别受体,研究表明,肺炎支原体可被NLRP3识别,触发机体的固有免疫应答以及炎症反应,与肺炎支原体肺炎的发生和发展密切相关[6]。清热止咳方(芩百清肺浓缩丸)是一种治疗肺炎支原体感染的中药复方,实验研究表明,其抗肺炎支原体肺炎与调节NLRP3炎性体有一定关系[7]。本文旨在探讨其对MP感染模型小鼠肺组织NLRP3 炎性体mRNA表达及肺泡灌洗液中IL-18分泌动态变化的影响。
1 材料与方法
1.1 仪器与材料
1.1.1 实验动物 SPF级BALB/c小鼠,6~8周,全部为雌性,购自中山大学动物实验中心,饲养于华南农业大学实验动物中心负压SPF级动物房;动物合格证号为SCXK (粤) 2011-0029,许可证号为SYXK (粤) 2014-0136。
1.1.2 菌株 肺炎支原体标准菌株(ATCC-15531),为本实验室保存。
1.1.3 药物及试剂 清热止咳方(每1g含生药2.5g),黑龙江省中医药科学院中药研究所制备,制备方法同前[7];RNAiso Plus、PrimeScript RT reagent Kit及SYBR Premix Ex Taq 购自TaKaRa公司;NLRP3、ASC、Caspase-1引物由宝生物工程(大连)有限公司合成;IL-18 ELISA试剂盒购自ebioscience公司。
1.1.4 主要仪器 CFX96荧光定量PCR仪,美国Bio-Rad公司;BSP-250生化培养箱,上海博讯实业有限公司医疗设备厂;3k-20z型高效冷冻离心机,1300 SERIES A2二级生物安全柜,美国 thermo公司;GEN ios pro酶联免疫检测仪,瑞士NAVO公司。
1.2 方法
1.2.1 肺炎支原体培养 将冻存的MP标准菌株用PPLO完全培养液复溶,将其置于37℃生化培养箱中培养,培养液变橙黄色时传代。把处于对数生长期的MP,行颜色改变单位(CCU)定量并分管冻存,用时调至所需浓度。
1.2.2 分组、接种MP及给药 96只雌性BALB/c小鼠,随机分为正常对照组、MP组、罗红霉素组(50mg/Kg)、清热止咳方组(3.3g/Kg),每组24只,各组小鼠分笼饲养,其中正常对照组小鼠与其他组小鼠分房饲养,饲养环境和条件均一致。各组小鼠,均用乙醚麻醉,参照文献方法[9],滴鼻法建立肺炎支原体感染小鼠模型。正常对照组小鼠同法用等容量的PPLO代替MP菌液滴鼻。滴鼻后第1d,罗红霉素组及清热止咳方组开始给药,给药容量为10 mL/Kg,连续给药14d。模型组及正常对照组灌服相同容量蒸馏水。
1.2.3 标本的采集及保存 分别于MP感染模型建立后第7d、14d及28d,每组随机取出小鼠8只,颈椎脱臼法处死,并用75%乙醇消毒,在生物安全柜内分离气管,结扎右主支气管,气管插管,从气管插管处慢慢注入0.5mL 4℃预冷的PBS溶液,30s 后缓慢的抽出,此步骤重复三次,合并BALF,4℃ 3000rpm离心10min,分离上清,于-80℃保存,备做ELISA;分离左肺,-80℃冻存,备提RNA。
1.2.4 NLRP3、ASC、caspase-1mRNA相对表达量检测 常规方法提取各组小鼠左肺的RNA,并测定浓度。参照试剂说明书进行逆转录及PCR扩增,NLRP3、ASC、caspase-1mRNA引物序列及扩增条件参见文献[7]。用2-ΔΔCt法分析PCR产物的相对定量。
1.2.5 IL-18检测 用ELISA方法测定,操作步骤按照试剂盒说明书进行。
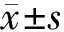
2 结果
2.1 清肺止咳方对MP感染BALB/c小鼠肺组织NLRP3、ASC、caspase-1mRNA相对表达量的动态变化 与正常对照组比较,感染后7d、14d模型组小鼠肺组织NLRP3、ASC、caspase-1 mRNA表达量均显著上调(P<0.01);感染后28d模型组小鼠肺组织NLRP3、ASC、caspase-1 mRNA表达量无明显变化,与正常对照组比较,没有显著性差异(P>0.05);清热止咳方组给药后7d、14d NLRP3、ASC、Caspase-1 mRNA表达量均下降,与模型组比较,差异有显著性(P<0.05)。给药后28d清热止咳方组NLRP3、ASC、Caspase-1 mRNA相对表达量无明显变化,与模型组比较,无显著性差异(P>0.05)。见表1-3。
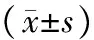
表1 清热止咳方对MP感染BALB/c小鼠肺组织NLRP3 mRNA表达的影响
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05。
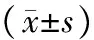
表2 清热止咳方对MP感染BALB/c小鼠肺组织ASC mRNA表达的影响
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05。
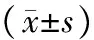
表3 清热止咳方对MP感染BALB/c小鼠肺组织caspase-1 mRNA表达的影响
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05。
2.2 清热止咳方对MP感染BALB/c小鼠BALF IL-18的影响 MP感染后7d、14d,模型组小鼠BALF中IL-18分泌量增加,与正常对照组比较,差异有显著性(P<0.01);感染后28d模型组小鼠BALF中IL-18分泌量稍有增加,但与正常组比较,无见显著性差异(P>0.05)。给予清肺止咳方 7d、14d,小鼠BALF中IL-18分泌量减少,与模型组比较,差异有显著性 (P<0.05,P<0.01)。清热止咳方给药14d,再停止给药14d,与模型组比较,无显著性差异(P>0.05)。结果见表4。
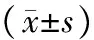
表4 清热止咳方对MP感染BALB/c小鼠BALF IL-18分泌的影响
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
3 讨论
NOD样受体蛋白3即NLRP3炎性体是由NLRP3、ASC、Caspase-1组成的一种多蛋白复合物,属于胞内识别受体,它在巨噬细胞、树突状细胞等多种细胞中表达,在多种感染性及非感染性疾病的发生和发展过程发挥作用[8-9]。
研究表明,细胞感染肺炎支原体后,活性氧以及肺炎支原体特有的社区获得性呼吸窘迫综合征毒素均可被NLRP3炎性体识别,并激活NLRP3,通过与衔接蛋白ASC作用,活化caspase-1,进而裂解无活性的pro-IL-1β,将其剪切为成熟的IL-1β,并介导一系列炎症反应,在肺炎支原体肺炎的发生和发展过程中起重要作用[6,10]。
本研究通过MP滴鼻法建立BALB/c小鼠感染模型,通过体内实验进一步动态观察了NLRP3炎性体相关基因及IL-18在MP感染小鼠肺组织或BALF的变化,结果发现,小鼠接种MP 7d,NLRP3炎性体相关基因表达上调,BALF中IL-18分泌明显增加;感染14d NLRP3炎性体相关基因表达及BALF中IL-18分泌虽较7d下降,但还高于正常对照组,即炎症有所减退;感染28d,NLRP3炎性体相关基因表达及BALF中IL-18分泌无明显变化,即炎症基本消失。其中,NLRP3炎性体相关基因表达的变化趋势与其相关蛋白表达的变化趋势基本一致[7]。前期体外试验结果显示,MP感染RAW264.7细胞后,细胞上清液IL-18的分泌量未有明显变化,但本文整体动物试验结果表明,IL-18在肺炎支原体感染初期和中期分泌增加,感染后期分泌趋于正常,可能是由于体外试验中选取的时间点不同,抑或由于体外试验脱离了体内试验的内环境,故两者结果不甚一致,具体原因有待于进一步研究[11]。
清热止咳方是治疗肺炎支原体感染的中药复方,方中以黄芩为君药,以其苦寒之性,清泄肺火;百部为臣药,甘、苦、微温,可润肺止咳;地龙性寒、味咸,可清热、止喘;桔梗味苦、辛、性平,可宣肺、利咽、祛痰、排脓,并辅以麦冬、紫菀,全方共奏清热解毒、润肺止咳的功效。前期体外实验研究表明,清热止咳方含药血清能降低MP感染小鼠巨噬细胞RAW264.7细胞NLRP3炎性体相关基因的相对表达量并减少肺泡灌洗液IL-1β的分泌,本研究通过体内实验,从NLRP3炎性体相关基因表达变化的角度探讨其治疗肺炎支原体感染的作用机制。结果表明,给予中药复方清热止咳方7d、14d后能下调MP模型组小鼠肺组织NLRP3、ASC、Caspase-1 mRNA表达及BALF中IL-18的分泌。即清热止咳方可能通过抑制NLRP3炎性体相关基因表达而抑制相关炎性细胞因子IL-18的分泌来发挥对肺炎支原体感染的治疗作用。
[1]Liu H, Xiao XC, Lu JY, et al. Study on epidemic characteristics and etiology of community acquired pneumonia in Guangzhou from 2009 to 2012. Chin J Prev Med, 2013, 47(12): 1 089-1 094.
[2]Balish MF. Mycoplasma pneunomiae attachment proteins and toxins as mediators in disease production[J].Curr Pediatr Rev, 2013, 9(4): 296-303.
[3]Kannan TR, Musatovova O, Balasubramanian S, et al. Mycoplasma pneumonia community acquired respiratory distress syndrome toxin expression reveals growth phase and infection dependent regulation[J].Mol Microbiol, 2010, 76(5): 1 127-1 141.
[4]Becker A, Kannan TR, Taylar AB, et al. Structure of CARDS toxin, a unique ADP-ribosylating and vacuolating cytotoxin from Mycoplasma pneumonia[J].Proc Natl Acad Sci USA, 2015, 112(16):5 165-5 170.
[5]李沫民, 柳旎, 张淼, 等. 肺炎支原体感染患儿的免疫水平研究[J].中华医院感染学杂志, 2017, 27(16): 3 795-3 797,3 836.
[6]张涵, 马晶, 张云凌, 等. 肺炎支原体经ROS激活NLRP3炎性体诱导RAW264.7细胞分泌IL-1β[J].中国病理生理杂志, 2015, 31(12): 2 244-2 248.
[7]张涵, 索绪斌, 张云凌, 等. 芩百清肺浓缩丸对肺炎支原体感染BALB/c小鼠NLRP3炎性体的影响[J].中国病原生物学杂志, 2017,12(10): 943-946.
[8]Eun-Kyeong Jo, Jinkyung Kim, Dong-Min Shin, et al. Molecular mechanisms regulating NLRP3 inflammasome activation[J].Cell Mol Immunol, 2016,13(2):148-159.
[9]毛开睿,孙兵. NLRP3炎症小体研究进展[J].现代免疫学杂志, 2011, 31(1): 1-4.
[10]Bose S, Segovia JA, Somarajan SR, et al. ADP-ribosylation of NLRP3 by Mycoplasma pneumoniae CARDS toxin regulates inflammasome activity[J].mBio, 2014,5(6): e02186-14.
[11]张涵, 马晶, 张云凌, 等. 肺炎支原体感染RAW264.7细胞NLRP3炎性体及下游分子的表达[J].中国病原生物学杂志, 2014, 9(6): 496-499.
