大黄酸兔源多克隆抗血清的制备与鉴定
2018-06-20王咏枝屈会化邢洪霞张越成金俊熊威罗娟赵琰孔慧王庆国
王咏枝 屈会化 邢洪霞 张越 成金俊 熊威 罗娟 赵琰 孔慧 王庆国


摘要:目的 合成大黃酸人工抗原,制备敏感性高、特异性强的大黄酸兔源多克隆抗血清。方法 采用碳二亚胺法制备大黄酸人工抗原,将大黄酸分别与牛血清白蛋白和卵清蛋白相偶联。用紫外扫描法鉴定大黄酸人工抗原是否偶联成功,免疫新西兰兔,制备多抗血清,通过间接竞争ELISA测定抗血清效价,通过间接竞争ELISA鉴定抗血清的敏感性和特异性,并分别用间接竞争ELISA和HPLC检测大黄中大黄酸的含量。结果 2只新西兰兔产生的多抗血清效价在1∶64 000以上,其中,2号兔多抗血清敏感性最好,半数抑制浓度为0.09 ng/mL,且具有良好的特异性。兔抗血清测得大黄中大黄酸含量为(0.026±0.001)%,HPLC测得大黄中大黄酸含量为(0.027±0.000)%。结论 本研究制备了敏感性高、特异性强的大黄酸兔源多克隆抗体血清,为建立大黄酸免疫亲和色谱分析技术和快速检测方法奠定了基础。
关键词:大黄酸;人工抗原;碳二亚胺法;兔源多抗血清;酶联免疫分析
DOI:10.3969/j.issn.1005-5304.2018.05.010
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2018)05-0041-05
Preparation and Identification of Rhein Rabbit Polyclonal Antiserum
WANG Yong-zhi1, QU Hui-hua2, XING Hong-xia3, ZHANG Yue1, CHENG Jin-jun4,
XIONG Wei1, LUO Juan1, ZHAO Yan4, KONG Hui4, WANG Qing-guo4
1. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China;
2. Beijing Institute of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China; 3. Qufu Traditional Chinese Medicine Hospital, Qufu 273100, China;
4. School of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
Abstract: Objective To synthesize rhein (RHE) artificial antigens; To prepare high sensitivity and specificity polyclonal antiserum against RHE. Methods RHE was coupled respectively to bovine serum albumin (BSA) and ovalbumin (OVA) by using carbodimide two-step method. The RHE artificial antigen was identified by UV spectrophotometry, then it was injected to rabbits for antiserum preparation. Anti-serum titer was determined by indirect ELISA. Sensitivity and specificity were identified by indirect competitive ELISA. And the contents of RHE of Rhei Radix et Rhizoma were detected by indirect competitive ELISA and HPLC. Results Indirect ELISA showed a high titer above 1∶64 000. The sensibility of No.2 antiserum was better, which IC50 was 0.09 ng/mL and had good specificity. The content of RHE in Rhei Radix et Rhizoma was (0.026±0.001)% detected by rabbit polyclonal antiserum, and the content of RHE was (0.027±0.000)% detected by HPLC. Conclusion In this study, RHE artificial antigens is synthesized successfully. RHE rabbit polyclonal antiserum with high sensitivity and specificity is prepared, and these may provide basis for the immune affinity chromatography analysis technology and immunology fast detection methods.
Keywords: rhein; artificial antigen; carbodiimide two-step method; rabbit polyclonal antiserum; ELISA
基金项目:国家自然科学基金重点项目(81430102)
通讯作者:王庆国,E-mail:wangqg5858@sina.com
大黄酸(rhein,RHE)属单蒽核类1,8-二羟基蒽醌衍生物,是大黄、虎杖、何首乌等多种中药的主要有效成分[1],也是大黄药材的质控指标之一。现代药理研究表明,大黄酸具有抗肿瘤[2]、抗菌[3]、抗炎[4]、降糖调脂[5]、保肝抗纤维化[6]等多种活性,在治疗糖尿病肾病及协同抗肿瘤方面表现尤其突出[7]。目前大黄酸常用检测方法为HPLC[8-9],此方法依赖高精密仪器,分析成本高;样品前处理复杂,要求专业的分析人员,耗时长;不适宜现场检测和大样本检测。而基于小分子多克隆抗体的中药活性成分免疫学分析方法(ELISA)灵敏度高,特异性强,前处理简单,高通量,且不依赖贵重仪器,操作也较为简便[10-11]。RHE免疫分析方法的建立需要得到抗RHE的抗体。本研究对RHE的人工完全抗原进行了合成与鉴定,免疫动物新西兰大白兔获得了特异性强、灵敏度高的兔源多克隆抗体。
1 实验材料
1.1 动物
雌性新西兰大白兔2只,体质量2.5 kg,8周龄,斯贝福(北京)生物技术有限公司中心,动物许可证号SCXK(京)2015-0005。饲养于北京中医药大学实验动物研究中心,温度15~25 ℃,相对湿度55%~65%,光照12 h,自由摄食饮水。
1.2 主要试剂与仪器
RHE,南京泽朗有限公司;大黄饮片,北京仟草有限公司;甲醇(色谱纯,Fisher),双蒸水(娃哈哈);N-羟基琥珀酸亚胺(NHS),Biotopped;脱脂奶粉,Oxoid公司;卵蛋白(OVA),Sigma公司;水溶性碳二亚胺盐酸盐(EDC),北京化学试剂厂;牛血清白蛋白(BSA),Sigma公司;弗式完全佐剂(F5881),Sigma公司;弗式不完全佐剂(F5506),Sigma公司;酶标二抗(HRP-标记羊抗兔IgG),Gene-Script公司;四甲基联苯胺(TMB),Sigma公司;二甲基甲酰胺(DMF),Sigma公司。可调微量系列加样器,Eppendorf;SZ-93自动纯水蒸馏器,Labsystems;BS124S电子分析天平,赛多利斯公司;高效液相色谱仪,Agilent Technologies 1260 Infinity;QL-901漩涡混合器,其林贝尔仪器制造有限公司;84-1A磁力搅拌器,上海司乐仪器有限公司;紫外-可见分光光度计,Beckman coulter DU 800;10 kD超滤管,Sigma 公司;UV-265FW分光光度计,日本岛津;Millipore 纯水系统,Millipore,USA;96孔酶标板,Corning;酶标仪,Tecan Safire2全波长多功能酶标仪;TGL-16G台式高速冷冻离心机,北京医用离心机厂。
2 实验方法
2.1 大黄酸完全抗原的合成方法
根据本实验室人工抗原合成方法[12-14],采用碳二亚胺两步法,将RHE分别与BSA、OVA偶联制备人工抗原与包被抗原。具体方法:准确称取BSA 100 mg,溶于2 mL碳酸盐缓冲液(pH 9.6),为A液;称取RHE 100 mg,溶于14 mL碳酸盐缓冲液,另外称取EDC 76 mg和NHS 38 mg分别溶于1 mL碳酸盐缓冲液,加入以上配好的RHE溶液中,滴加DMF 2 mL,室温磁力搅拌2 h,为B液。将A液缓慢滴加到B液中,边滴边摇,密封且用锡箔纸包裹避光,室温搅拌连续反应6 h,用10 kD超滤管超滤,碳酸盐缓冲液清洗3次,获得RHE-BSA。以相同方法获得RHE-OVA。
2.2 大黄酸完全抗原的鉴定
2.2.1 紫外扫描法
用PBS精确配制适宜浓度的RHE与BSA标准溶液,然后将待检样品按1∶10浓度稀释,用紫外分光光度计测出RHE(a)、BSA(b)、RHE-BSA(c)的全波长图谱,计算RHE-BSA的偶联比。同法計算RHE-OVA的偶联比。
2.2.2 动物免疫
用RHE-BSA免疫原经颈部皮下多点注射免疫2只雌性新西兰兔。首次免疫予弗氏完全佐剂充分混匀乳化,免疫剂量以RHE计1 mg/只。以后每间隔2周加强免疫1次,改用弗氏不完全佐剂乳化抗原,免疫剂量相同。第4次免疫后,耳缘静脉取血,4 ℃静置12 h,5000 r/min离心10 min分离血清,分别编号为1#、2#[14]。
2.2.3 抗体效价测定
RHE-OVA作为包被原,采用间接竞争ELISA测定RHE抗血清的效价。包被抗原RHE-OVA用CBS按1∶10 000稀释,加入100 μL/孔,37 ℃孵育2 h,PBST洗板,每次5 min,共3次。5%脱脂奶粉100 μL/孔封闭,37 ℃封闭1 h,PBST洗板3次。加样100 μL/孔,抗血清的初始稀释倍数为2000倍,以2倍为稀释梯度逐级稀释。以空白血清作为阴性对照。37 ℃孵育1 h,PBST洗板3次,再加入100 μL/孔HRP-羊抗兔二抗(1∶10 000),37 ℃反应1 h。PBST洗板3次,加入显色液100 μL/孔,37 ℃显色15 min,每孔加2 mmol/L硫酸50 μL终止反应。测OD450 nm吸光度。以同一稀释倍数抗血清(P)与阴性血清(N)OD450 nm比值(P/N)>2.1时血清的最大稀释度为抗体效价[15]。
2.2.4 抗体敏感性测定
间接竞争ELISA实验步骤与间接ELISA测定方法大体相同,不同处在于第1步加入多抗血清50 μL(1∶2000稀释)和不同浓度RHE溶液50 μL作为竞争物,其余操作步骤相同。以RHE质量浓度的对数值为横坐标,以抑制率A/A0(A0为RHE质量浓度为0时的吸光度,A为RHE不同质量浓度的吸光度)为纵坐标,绘制多抗血清对RHE的抑制曲线,根据曲线回归方程,计算多抗血清对RHE的半数抑制浓度(IC50),评价RHE抗血清的敏感性。
2.2.5 抗体特异性测定
选择与RHE具有醌类母核或羧基等类似结构的化合物,通过间接竞争ELISA测定多抗血清对不同竞争物的IC50值。以多抗血清对RHE的IC50与多抗血清对竞争物的IC50比值作为交叉反应率(CR)[16],并以CR反映多抗血清的特异性。
2.3 大黄酸含量测定
2.3.1 HPLC测定
准确称取大黄酸标准品0.10 mg,用甲醇配制50 μg/mL标准品溶液2 mL。取大黄饮片粉碎,称取大黄粉末1.00 g,加30 mL甲醇超声30 min,过滤,重复2次,合并滤液,浓缩,甲醇定容至成10 mL,即为大黄供试品溶液。参考2015年版《中华人民共和国药典》(一部),选用Agilent ZORBAX SB-C18色谱柱(4.6 mm×150 mm,5 μm),流动相为甲醇- 0.1%磷酸溶液(85∶15),检测波长 254 nm,进样量10 μL。取标准品溶液1 mL,以甲醇配成50、45、35、30、25、20、15、10 μg/mL 8个浓度,绘制标准曲线,供试品用甲醇稀释10倍,作为待测样品,平行测定3次。
2.3.2 间接竞争ELISA测定
取上述HPLC大黄供试品溶液100 μL,以PBS稀释1000倍作为间接竞争ELISA检测的供试品溶液,按照“2.2.4”项下方法测定,平行测定3次。
3 结果
3.1 RHE-BSA偶联比
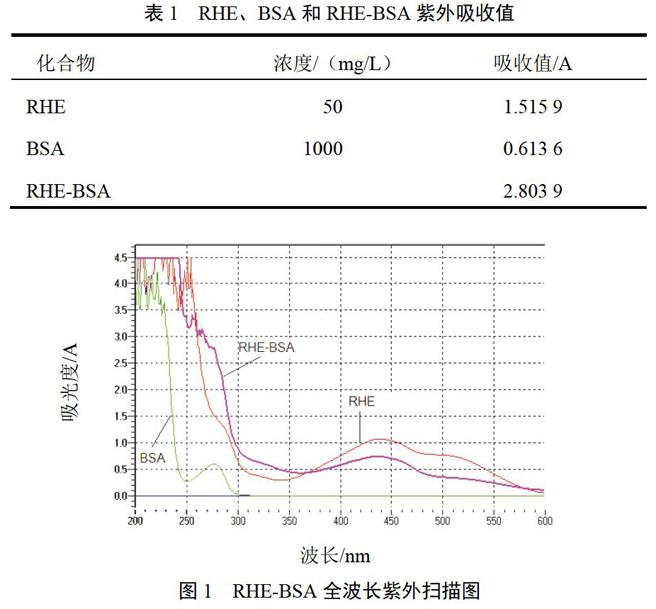
紫外-可见分光光度计扫描结果可以看出,加入RHE-BSA结合物的PBS中,RHE吸收峰在437 nm波长处,BSA的最大吸收为Kmax=277 nm,RHE-BSA结合物紫外光谱明显具有RHE和BSA蛋白叠加的特征,并且相同BSA质量浓度的结合物和标准蛋白BSA的紫外光谱相比,在277 nm波长处吸光度明显增高。由于偶联产物经透析袋充分透析后,排除未结合BSA的RHE小分子,而BSA属于大分子被截留在透析袋内,故吸光度增加推测其原因是RHE与BSA结合所致。经计算RHE-BSA偶联比约为17∶1,在文献推荐范围(5∶1~20∶1)[15]内。结果见表1、图1。
图1 RHE-BSA全波长紫外扫描图
3.2 抗体效价
间接ELISA实验结果表明,2只新西兰兔均有特异性抗体产生,P/N≥2.1时,效价均在1∶64 000以上,见图2。
图2 间接ELISA法测定血清效价
3.3 敏感性测定结果
间接竞争ELISA测定RHE多抗血清抑制效价的结果见图3。可知第2只新西兰兔所产生的多抗血清均对RHE有很好的抑制效果,线性回归方程为Y=-0.205 4X+0.288 6,R2=0.983 8,IC50为0.09 ng/mL,表示2号兔的多抗血清对RHE具有很高的敏感性。
图3 2号兔多抗血清对RHE的间接竞争ELISA抑制曲线
3.4 抗体特异性测定结果
间接竞争ELISA测定兔多抗血清特异性的结果见表2。可知該兔多抗血清对RHE的交叉反应率为100%,除芦荟大黄素的交叉反应率是0.1%,其余化合物均小于0.1%,说明抗RHE的多抗血清具有良好的特异性。
3.5 大黄酸含量测定结果
Ic-ELISA测得大黄中RHE含量为(0.026±0.001)%。HPLC测定:标准曲线为Y=61.126X-1174.7。测得大黄中RHE含量为(0.027±0.000)%,采用SPSS20.0对2组数据进行t检验,差异无统计学意义(P>0.05)。因此,Ic-ELISA与HPLC检测结果具有一致性,从而验证了所建立的Ic-ELISA的准确性。
4 讨论
基于抗体特异性的免疫分析方法具有耗时少、能够大批量处理样品、灵敏度和准确度高等优点,并且有多种技术形式,将免疫分析方法应用于中医药的研究具有广阔前景[12,15]。我们通过合成RHE人工抗原,进而产生抗RHE抗体,可以建立起相应的免疫分析方法,来进行大黄药材、含大黄中成药的质量检测以及相关药物的作用机理研究等。
人工抗原合成有很多种方法,如碳二亚胺法、高碘酸钠氧化法及活泼酯法等。不同偶联方法所选择半抗原的连接基团或连接部位不同,决定半抗原表位构型表达上的差异,影响半抗原的免疫原性,更决定其免疫抗体的特异性[16]。RHE为1,8-二羟基-3-羧基蒽醌,根据化学结构中的1、8位羟基和3位羧基,设计RHE人工抗原的合成[17]。为了最大程度保证半抗原的极性与目标待测物的一致性,需要使间隔臂的介入点远离特征性基团,故本实验室选用基于羧基的碳二亚胺法来合成其人工抗原[18]。本方法中,EDC先和RHE反应生成一个加成中间产物,再与蛋白质分子上的氨基反应形成酰胺键,从而实现两者的交联。本方法操作简便,且保留了RHE的特征性结构,可以提高RHE的免疫原性。
目前,鉴别人工抗原是否成功的方法主要有紫外分光光度法、电泳法、质谱法及同位素示踪法等[19]。本研究采用紫外光谱法对合成产物进行鉴定,经过初步鉴定,RHE与载体蛋白成功偶联,并且对免疫新西兰兔血清进行ELISA检测发现,所合成的RHE-BSA可使新西兰兔体内产生抗RHE抗体,效价达64 000以上,以兔血清测得大黄中RHE含量为(0.026±0.001)%,HPLC测得大黄中RHE含量为(0.027±0.000)%,兔多抗血清建立的免疫分析方法测定结果与HPLC测定结果差异无统计学意义(P>0.05)。
本研究采用免疫新西兰兔方法制备抗RHE免疫血清效价(64 000)较张波等[20]报道的Balb/C小鼠抗血清效价(8000)更高;抗体敏感性IC50为0.09 μg/L,远高于小鼠抗血清敏感性185.82 μg/L;另外,1只新西兰兔可得到约50 mL高性价比抗RHE免疫血清,而1只Balb/C小鼠仅能产腹水5~10 mL,并且所得腹水效价远低于血清。一般情况下制备基于抗体的免疫亲和色谱柱需要使用的抗体量比较大,所以兔源性多克隆抗体特别适合用来制备免疫亲和色谱柱,用于中药特异性成分的敲除[21]或分离[16]。
参考文献:
[1] 刘凯,郑海生,李应东.大黄酸的药理作用研究述略[J].中华中医药学刊,2004,22(9):1732-1734.
[2] 万宗明,孙文军,陈虹.大黄酸抗肿瘤作用的研究进展[J].武警医学, 2006,17(8):611-612.
[3] 陈红斌,陈钧.大黄对痔疮主要致病菌的体外抑菌作用研究[J].中药药理与临床,2006,22(3/4):111-113.
[4] 尹家乐,张爱香,王毓炜,等.大黄酸精氨酸预防大鼠实验性肠粘连抗炎机制的研究[J].中药新药与临床药理,2010,21(1):18-21.
[5] 吕鹏,盛宏光.大黄酸对高脂血症小鼠肝脏脂肪含量的影响[J].江苏大学学报:医学版,2012,22(1):55-57.
[6] 万晓强,郑紫丹,尚军洁,等.大黄酸对免疫性肝纤维化大鼠形成的影响[J].重庆医学,2009,38(10):1204-1206.
[7] 李玉贤,王雅君,冯焕姣.大黄酸防治糖尿病肾病的研究进展[J].中医药咨讯,2011,3(7):1-2.
[8] 汪跃峰,钟文武,陈爱民,等.HPLC法测定马兰中大黄酸的含量[J].安徽医药,2012,16(8):1082-1083.
[9] 吕惠子,朴光春,郑光洁.反相高效液相色谱法测定朝鲜大黄中大黄酸的含量[J].延边大学医学学报,2009,32(1):34-36.
[10] CHUANG J C, VAN EMON J M, JONES R, et al. Development and application of immunoaffinity column chromatography for atrazine in complex sample media[J]. Anal Chim Acta,2007,583(1):32-39.
[11] 屈会化,赵琰,王庆国.利用免疫芯片技术筛查中药注射剂致敏成分[J].北京中医药大学学报,2008,31(1):23-25.
[12] 赵琰,屈会化,王庆国.利用单克隆抗体特异性敲除技术解析中药药效物质基础的新方法[J].中国中药杂志,2013,38(17):2906-2910.
[13] 屈会化,赵琰,李翼飞,等.中药活性小分子人工抗原合成的技术要点[J].中草药,2012,43(10):1880-1885.
[14] 屈会化,赵琰,王雪茜,等.黄芩苷人工抗原的合成与鉴定[J].北京中医药大学学报,2010,33(9):606-609.
[15] 屈会化,赵琰,王庆国.基于中药活性小分子单克隆抗体的复方配伍机理研究新思路[J].中国中西医结合杂志,2012,32(10):1418-1421.
[16] QU H H, WANG Y, SHAN W, et al. Development of ELISA for detection of Rh1 and Rg2 and potential method of immunoaffinity chromatography for separation of epimers[J]. Journal of Chromatography B,2015,985(8):197–205.
[17] 李麗华,刘文泰,戴军,等.大黄素-BSA不同表位构型的免疫原性和特异性研究[J].中国免疫学杂志,2011,27(5):419-422.
[18] 姚嘉赞,沈锦玉,郝贵杰,等.氨基脲人工抗原的合成及其多克隆抗体的制备[J].中国动物检疫,2009,26(1):33-35.
[19] 刘洋,屈会化,任燕,等.人参皂苷Rg1人工抗原的合成及免疫原性鉴定[J].中草药,2013,44(13):1738-1742.
[20] 张波,袁媛,黄璐琦,等.大黄酸人工抗原合成及免疫原性鉴定[J]. 中国中药杂志,2015,40(8):1463-1467.
[21] ZHAO Y, FENG H B, SHAN W C, et al. Development of immunoaffinity chromatography to specifically knockout baicalin from Gegenqinlian Decoction[J]. J Sep Sci,2015,38(15):2746-2752.
(收稿日期:2017-09-05)
(修回日期:2017-10-07;编辑:华强)
