不同脱矿时间的梯度脱矿自体牙作为牙槽骨增量材料的效果*
2018-06-20沈昕吕娟李晓保朱有家
沈昕 吕娟 李晓保 朱有家*
自体骨是硬组织缺损重建的理想材料,被广大学者视作骨移植的金标准。牙齿和下颌骨均由外胚间叶的神经嵴细胞发育而来,且具有相似的化学组成[1,2],有学者提出,自体牙齿可替代自体骨用于骨移植,以避免自体骨移植造成的供骨区并发症等问题。早在上个世纪就有研究发现,从牙齿中能够提取出具诱导成骨性能的骨形态发生蛋白(Bone morphogenetic protein,BMP)[3],这为自体牙作为骨移植材料提供了理论依据。本研究利用经不同脱矿时间处理的梯度脱矿自体牙作为牙槽骨增量材料,观察不同脱矿时间对成骨效果的影响。
1 材料与方法
1.1 主要试剂及仪器
MAO2-1.5*7钛合金螺钉(慈北医疗器械有限公司,宁波); 颅颌面外科手术工具(慈北医疗器械有限公司,宁波);戊巴比妥钠(天盛兴生物科技有限公司,武汉);硫酸庆大霉素注射液(华中药业股份有限公司,襄阳),光学显微镜及照相系统(OLYMPUS,日本);RAY系列牙科X射线机(蓝野医疗,宁波);扫描电子显微镜(日立S-570,日本);口腔种植无菌手术包(武汉大学中南医院口腔医学中心,武汉)。
1.2 实验动物
健康清洁级新西兰兔16只,雌雄不限,3~6月龄,体重2.5 kg~3.0 kg,购于武汉市万千佳兴生物科技有限公司(许可证号:SYXK(鄂)2009-0025),常规条件下,分笼饲养于武汉大学中南医院动物实验中心。本实验获武汉大学中南医院动物伦理委员会批准。
1.3 确定骨移植手术部位
参考鄂玲玲等提出的新型兔牙槽骨缺损模型解剖兔下颌骨[4],见下颌切牙远中有一无牙区域(见图1黑色方块区域),骨壁较厚,制备骨缺损时不会伤及下颌切牙牙根。
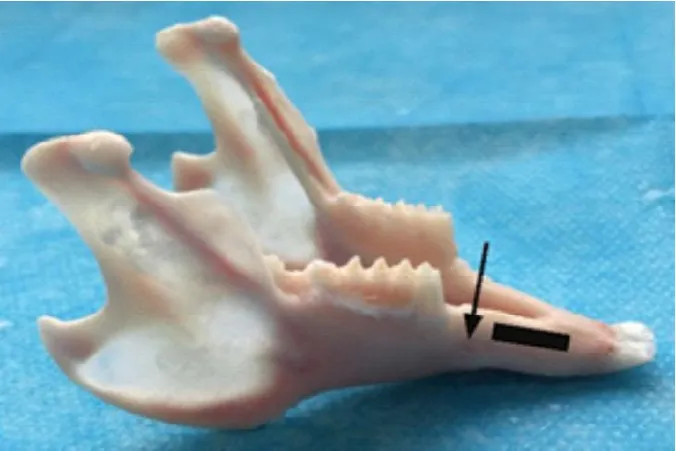
图1,体外确定建模位置(黑色方块区域为建模区,箭头指示为颏孔)。
1.4 骨增量材料制备及结构观察
本实验是为了推断合理的脱矿时间范围,因此根据课题组前期所获专利及相关体外预试验所得到的经验和数据[5],脱矿后的牙齿需要具有一定的机械强度,通常以脱矿后针能轻轻刺入而无法刺穿为标准,选择10%、5%两种浓度的盐酸进行不同时间的二次法对收集的离体兔牙进行梯度脱矿,排除使用脱矿后牙齿可被轻易穿透的时间组,最终决定10%盐酸脱矿30 min,而后续5%盐酸若脱矿时间长于40 min易致使牙齿丧失强度,随将实验对象的16只新西兰兔随机分为 A-D 4组,对各组自体牙脱矿条件(见表1)。脱矿完成后每组取一个样本经2.5%戊二醛溶液固定后用扫描电镜观察表面结构特征。

表1,各组家兔自体牙脱矿条件
实验动物称重后1%戊巴比妥钠静脉注射麻醉(3 mL/kg),仰卧位固定,上颌切牙区域消毒,分离牙龈,拔除切牙,去除牙根,磨除表层釉质,将牙齿制备为10 mm×4 mm×3 mm大小的牙片,在其中心部位用金刚砂车针制备一个直径1.5 mm长的圆。按表1所示进行脱矿处理,经盐酸处理的自体牙片每次从盐酸中取出后需用生理盐水反复冲洗,避免残留;D组始终浸泡于生理盐水中。制备好的材料按相应编号浸泡于生理盐水中待用。
1.5 骨增量材料移植
右侧下颌区备皮、消毒、铺巾。在距兔口角约10 mm处紧贴下颌骨上缘作一长约15 mm的切口,钝性分离至骨膜,切开骨膜,暴露下颌切牙远中无牙区,磨除表面骨皮质,250 mL生理盐水中加入8万单位庆大霉素配置成冲洗液,术中不间断冲洗术区。将制备好的自体增量材料用钛钉(1.5 mm×7.0 mm)固定于术区,分层缝合骨膜、肌肉及皮肤,术后饲喂青霉素粉末7天。
1.6 X线检查
术后即刻各组分别处死1只实验动物,取材后行 X线观察。术后3个月,处死全部实验动物后取出含移植材料的骨块行X线观察。
1.7 HE染色
常温下4%多聚甲醛固定1周,8%硝酸溶液快速脱钙处理,流水冲洗24 h,常规脱水包埋,在靠近钛钉处沿钛钉长轴方向做连续切片,每组各制作3张切片,HE染色。
1.8 定量分析
术后3个月,测量各样本钛钉与移植区表面垂直距离,每个样本选取4个位点,记录数值。OLYMPUS显微镜下观察并采集图像,每张切片随机取4个视野拍照,用Image J图像分析软件选取未降解移植物,测量其相对面积(a),再选取视野下全部组织并测量出其相对面积(b),最后计算出移植材料相对留存率(a/b)的值,取平均数。采用 SPSS 22.0统计学软件,Dunnett-t检验分析比较各处理组移植材料相对留存率,<0.05为差异有统计学意义。
2 结果
2.1 各实验组移植材料扫描电镜观察结果
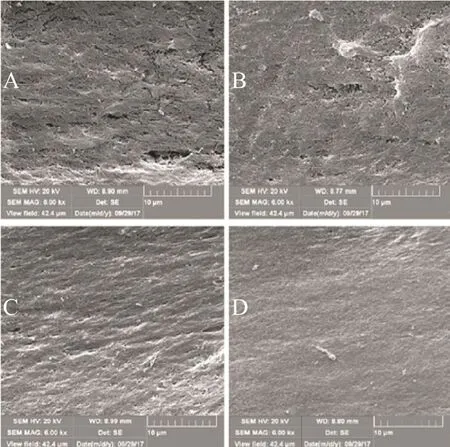
图 2,不同条件处理后的自体牙移植材料表面结构特征(6000×,SEM)。
扫描电镜观察结果显示,自体牙片在不同时间脱矿处理的作用下,表面结构发生显著变化。D组(见图2D)表面结构较为致密,牙本质小管排列紧密;而随着脱矿时间的增加,由C组(见图2C)到A组(见图2A),牙片表面结构逐渐变得疏松,胶原纤维束暴露,而在 A组中,胶原纤维束丧失原本有序的结构,排列凌乱。
2.2 骨增高术后观察
实验动物术后1天均恢复自主进食。术后3个月,可见实验动物下颌骨移植区伤口均愈合良好,未见感染迹象。
2.3 大体观察
术后3个月肉眼观察,A组钛钉顶部与骨面之间有一间隙,未见移植物存在;B组、C组钛钉顶端与移植区表面结合紧密,钛钉顶部可见新骨爬行覆盖,仍可辨认部分移植物存在;D组钛钉顶部未见新骨覆盖,移植物形态清楚,与周围骨组织界限清晰。
2.4 X线观察
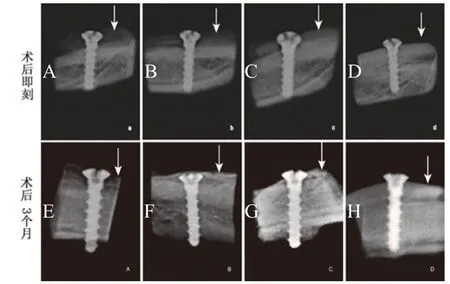
图3,骨增量术后即刻与3个月X线影像(白色箭头所示为骨增量区域)。
术后即刻X线观察结果显示,随着脱矿时间的增加,移植物密度降低(见图3A-D)。术后3个月X线观察结果显示,钛钉与下颌骨发生稳定结合,未见明显暗影,与术后即刻影像相比发生较为明显的改变;A组(见图3E)钛钉顶端与周围组织未接触,周围低密度影;B组(见图3F)和C组(见图3G)可见部分移植物影像,钛钉与移植区表面接触较为紧密,C组移植区影像密度高于B组,移植物与下颌骨之间界限不清,二组移植区密度均高于术后即刻影像;D组(见图3H)骨增量区见清晰的牙齿形态,与下颌骨分界明显。
2.5 HE染色
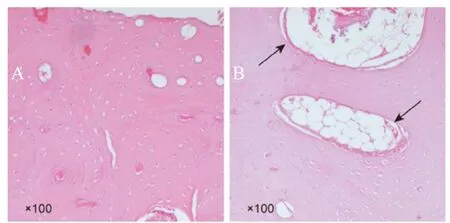
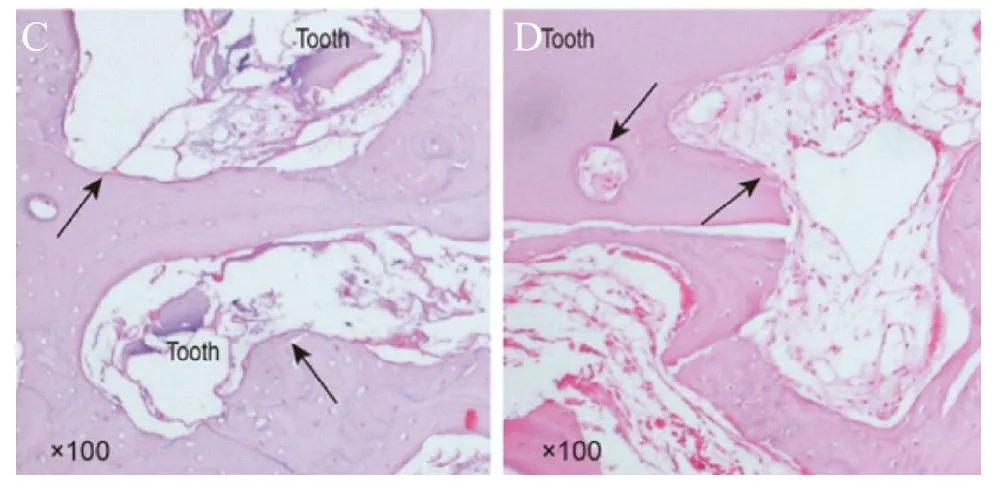
图4,骨增量术后3个月HE染色(Tooth:移植牙齿;黑色箭头:骨改建区,彩图见插页)。
术后3个月,A组(图4A)未见明显骨改建,未见牙样结构存在;B组(图4B)见骨改建区,毛细血管及成骨细胞出现,有较均匀的新骨形成,未见明显牙样结构;C组(图 4C)可见有大面积骨改建区,骨祖细胞、破骨细胞出现,新骨取代原有移植物,骨改建区内见少量牙样结构;D组(图4D)见大面积牙样结构,边缘呈蚕食状,分界明显,骨改建区边缘有骨母细胞出现。
2.6 统计学分析
在术后3个月,B组、C组、D组骨增量能力无显著差异性(>0.05);A组骨增量能力弱于D组(<0.05),差异有统计学意义(见表2)。
表2,各组钛钉与移植区表面垂直距离比较(±s,mm)
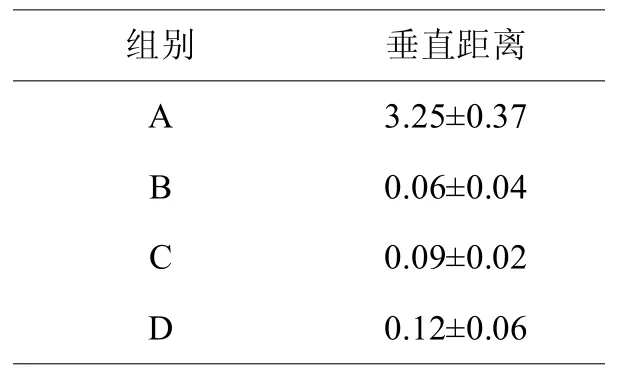
表2,各组钛钉与移植区表面垂直距离比较(±s,mm)
?
术后3个月,各组移植材料相对留存率具有显著性差异,差异有统计学意义(<0.05)(见表3),随着脱矿时间的增加,移植材料降解的速度增加。
表3,各组移植材料相对留存率比较(±s,%)
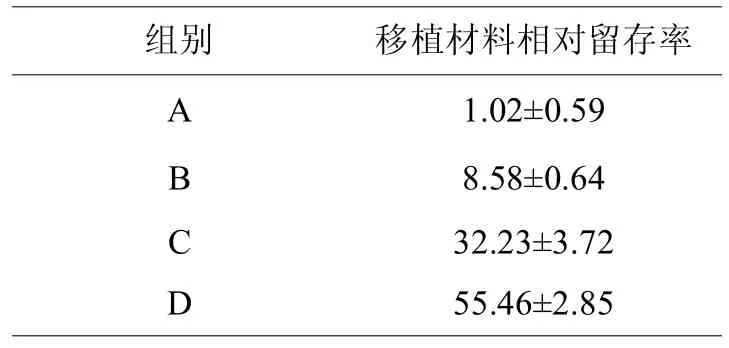
表3,各组移植材料相对留存率比较(±s,%)
组别 移植材料相对留存率A B C D 1.02±0.59 8.58±0.64 32.23±3.72 55.46±2.85
3 讨论
理想的骨移植材料应具备以下条件:表面结构类似于天然骨,生物相容性优越;生物降解速率与新骨形成速率相匹配;具有一定的机械强度及硬度,能够维持空间形态;可提供促进新骨形成的相关生长因子[6]。牙齿具有与皮质骨相似的表面结构与化学组成[7]。临床上观察发现,外伤牙牙根的牙本质和牙骨质可与牙槽骨发生置换性吸收,产生骨性粘连[8],提示牙齿可与骨整合。牙齿作为一种自体材料,不存在传播疾病的风险与发生免疫排异反应的可能,且来源丰富,因牙周病或无功能第三磨牙拔除所获得的牙齿形态完整,无需对患者进行二次手术,制成块状牙片后具有一定的硬度和强度,是一种可期的骨替代材料。本实验中采用不同脱矿时间处理的二次脱矿自体牙片进行移植手术,显示随着脱矿时间增加,牙片的吸收速度增加,在一定脱矿时间范围内,经处理的自体牙片能与骨发生渐进性整合,实现骨增量效果。
组织学观察结果发现,3个月时,未脱矿自体牙片(D组)尚未与骨组织发生牢固结合,移植物边缘可见破骨细胞吸收原移植物,有骨改建区出现;过度脱矿的自体牙片(A组)早期被破骨细胞吸收,成骨细胞不能沿牙片支架爬行,无法达到骨增量的目的;恰当脱矿时间处理的自体牙片(B组、C组)则与骨发生置换性吸收,新骨沿牙片支架爬行并逐渐取代原移植物,形成了骨整合,且随着脱矿时间增加,牙片被新骨吸收取代的速率增加。
牙齿植入机体后诱发改建,与其中含有的有机成分有关,BMP诱导软骨细胞和成骨细胞生成,Ⅰ型胶原和其他非胶原蛋白(如骨钙蛋白等)参与软骨和骨的钙化过程,BMP单独植入机体中会快速降解而无法发挥成骨效果,必须与Ⅰ型胶原或羟基磷灰石联合应用[8]。未脱矿的牙齿中含有大量羟基磷灰石,阻碍BMP的释放[10],新骨形成速度较慢,而经过适度脱矿后,牙中的有机成分仍存在活性,牙本质小管周围有机基质暴露,胶原纤维束松弛,为BMP等生长因子的释放提供通道[11]。在本实验中,自体牙经过不同条件处理后置于6000倍扫描电子显微镜下观察表面结构,发现随着脱矿时间的增加,胶原纤维束的松弛度逐渐增加,直至完全丧失原有的结构与排列。脱矿时间过长会导致过度脱矿,如本实验中的 A组,胶原纤维及羟基磷灰石结构被严重破坏,原支架材料被迅速吸收,BMP直接进入机体中,发生快速降解,难以发挥诱导成骨的作用,无法实现骨增量效果,这亦与观察到的实验结果相互印证。
自体牙取材方便,无需二次手术,降低了经济成本与时间成本,经过简单处理即可使用,易于被患者接受,近十年来在亚洲广泛应用[9,11,12],多数学者将自体牙制备成为粉末状或片屑状材料,存在不易塑形及难以维持局部空间结构的问题;传统未脱矿自体牙降解速率低,修复周期长,需要考虑结合其他生长因子使用[13]。
本课题组早期针对单一浓度脱矿人牙本质中的无机物及有机物含量进行过相应研究,原位衰减全反射红外光谱图(ART)与X射线能谱仪的结果都显示,在合适的脱矿浓度下,脱矿时间的增加对无机物的含量有明显的影响,但对于有机物几乎没有影响[14],而且,在牙齿材料中出现一个明显分界区域,将材料分为外部的脱矿区和内部完全未脱矿区,该区无机物相对含量不随脱矿时间的变化而发生改变,之前有学者进行的牙本质酸液脱矿后的分层结构分析也显示相同的现象[15],在单一浓度脱矿的牙齿中不会出现矿物质浓度呈阶梯性的变化,深层生长因子无法充分释放。后期,本实验组针对人牙进行了梯度脱矿处理后的体外检测[5],ART光谱显示,代表有机物的酰胺基团的吸收波谱范围在1650cm-1,而代表无机物的磷酸基团的吸收波谱在1050cm-1,从表面到中心,形成了孔隙率不同的多孔结构,无机物与有机物的相对含量从表面向中心呈现梯度性的变化,并且具有一定的硬度和弹性,能够维持空间结构并避免对下颌骨产生压迫导致骨吸收[5],在早期就能形成良好的结合,说明牙齿是牙槽骨增量手术比较理想的植入材料,实验结果也证实了梯度脱矿自体牙作为骨增高材料的可行性。
应当指出的是,梯度脱矿的时间是该方法成功与否的关键,本实验就兔牙的脱矿时间提出了大致的推断范围,初步圈定了时间范围,但由于人牙与兔牙的尺寸不同,所含化学成分的量可能亦略有差异,需要后期继续进行体外实验的材料性能检测以加强说服力,并且在后期进一步细化,进行实验以确定最优的脱矿时间范围。
[1] ArthurA,Rychkov G,ShiS,etal.AdultHuman DentalPulp Stem Cells Differentiate Toward Functionally Active Neurons Under Appropriate EnvironmentalCues[J].Stem Cells,2008,26(7):1787-1795.
[2] Boskey AL.Mineralization of bones and teeth[J].Elements,2007,33(3):385-391.
[3] Bang G,Urist MR.Bone induction in excavation chambers of decalcified dentin[J].Archives of Surgery,1967,94(6):781-789.
[4] 鄂玲玲,王东胜,师占平,等.一种新型的兔牙槽骨缺损模型的建立[J].中华老年口腔医学杂志,2011,9(3):137-140,171.
[5] 王九龙,刘心,朱有家.自体牙应用于牙槽骨增量手术联合Locator式种植覆盖义齿修复的体外模拟实验研究[J].医学新知杂志,2017,27(3):228-232.
[6] Liu Y,Liu S,Luo D,et al.Hierarchically staggered nanostructure of mineralized collagen as a bone-grafting scaffold[J].Advanced Materials,2016,28(39):8740-8748.
[7] Kim YK,Yeo IS,Yu SK,et al.Autogenous teeth used forbone grafting:a comparision with traditional grafting materials[J].Oral Surg Oral Med Oral Pathol Oral Radiol,2014,117(1):e39-e45.
[8] Andersson L.Dentoalveolar ankylosisand associated root resorption in replanted teeth[J].Swedish dental journal(Supplement),1988,56:1.
[9] Kim YK,Um IW,Murata M.Tooth Bank System for Bone Regeneration-Safety Report[J].JHard Tissue Biology,2014,23(3):371-376.
[10]Priya A,Nath S,Biswas K,etal.In vitro dissolution of calcium phosphate-mullite composite in simulated body fluid[J].JMaterSciMater Med,2010,21(6):1817-1828.
[11]Murata M,Akazawa T,Takahata M,et al.Bone induction of human tooth and bone crushed by newly developed automatic mill[J].Journal of the Ceramic Society of Japan,2010,118(1378):434-437.
[12]Kim ES.Autogenous fresh demineralized tooth graft prepared at chairside for dental implant[J].Maxillofacial Plastic and Reconstructive Surgery,2015,37(1):8.
[13]Xu Qin,Regmi M.Raj,Xiao-Fu Liao.Using rigidly fixed autogenous tooth graft to repair bone defect:an animal mode[J].Dental Traumatology,2014,30:380-384.
[14]张敏,彭杰,朱友家.自体智齿作为鞍鼻畸形整复材料的实验研究[J].临床口腔医学杂志,2013,29(6):341-343.
[15]Xu Z,Neoh KG,Kishen A.Monitoring acid-demineralization of human dentine by electrochemical impedance spectroscopy(EIS).[J].Journal of Dentistry,2008,36(12):1005-1012.
