桑黄液体深层发酵培养基优化研究
2018-06-20唐思煜赵优萍蔡成岗毛建卫
唐思煜,赵优萍,吴 迪,蔡成岗,2,3,毛建卫,2,3
(1.浙江科技学院,生物与化学工程学院,杭州310023;2.浙江省农产品化学与生物加工技术重点试验室,杭州310023;3.浙江省农业生物资源生化制造协同创新中心,杭州310023)
桑黄(Phellinus linteus)为多孔菌科真菌火木层孔菌的子实体,是一种珍稀的食药用真菌,隶属于担子菌亚门层菌纲多孔菌目多孔菌科木层孔菌属[1-2]。该菌在中国中南地区通常生长于桑属植物上,且其子实体为黄褐色,故名桑黄。研究发现桑黄含有多糖、黄酮、甾醇类物质等多种成分[3-5],其药理活性物以多糖为主。目前国内外开展了桑黄多糖的抗肿瘤、增强免疫、抗纤维化、抗氧化、降血糖、抗炎[6-11]等药理学方面的研究。桑黄多糖主要分胞内多糖和胞外多糖,是桑黄中主要的有效成分,具有显著的抗肿瘤效果和其他药用功效,值得深入研究开发[12];它是目前国际公认的生物治癌领域中有效率排在第一位的药用菌[13],市场需求很大,前景较好,但桑黄野生资源稀少,人工栽培难度较大[14],价格昂贵。采用液态深层培养技术进行桑黄发酵培养具有广阔的前景,韩国已有桑黄的人工栽培和批量生产,但国内对桑黄液态培养相关研究并不充分,也未成规模,且仅集中在液体发酵过程中碳、氮源等的筛选等方面[15-16]及理化因子的选择上[17]。因此,本研究通过对菌丝体发酵培养基的优化以期为桑黄液体深层培养和进一步应用提供参考。
1 试验材料及设备
1.1 菌种及试验材料
菌种为桑黄,由实验室保存。试剂为葡萄糖、蔗糖、乳糖、牛肉膏、蛋白胨、淀粉、氯化铵、硫酸铵、磷酸氢二钾、硫酸镁、氯化钠、硫酸锌。以上试剂均为分析纯,购自华东医药试剂公司。
1.2 仪器及设备
UV-1780紫外分光光度计,日本岛津;TD4K-2离心机,湖南湘仪集团;SHA-C数显水浴恒温振荡器,上海福玛试验设备有限公司;DF-101B集热式恒温搅拌器,金坛市国王试验仪器厂;SPX-250B-Z型生化培养箱,上海福玛试验设备有限公司;QYC-211全温空气摇床,上海福玛试验设备有限公司;LDZX-40B1型立体式自动电热压力蒸汽灭菌器,上海申安医疗器械厂;ZY-TP电子天平,浙江凯丰集团有限公司;MP511pH计,上海精密仪器仪表有限公司。
2 试验方法
2.1 培养基
2.1.1 PDA 种子培养基
称取200 g马铃薯煮沸30 min后,滤液加入葡萄糖20 g,定容至1 L,分装30 mL于250 mL三角瓶中,121℃灭菌20 min,冷却至室温备用。
2.1.2 碳源筛选培养基
碳源筛选培养基各成分的质量浓度:KH2PO40.5 g/L、MgSO40.5 g/L、NaCl 1.0 g/L、酵母粉 10 g/L,分别添加乳糖、淀粉、蔗糖至30 g/L,pH值自然,分装50 mL于250 mL三角瓶中,121℃灭菌20 min,冷却至室温备用。
2.1.3 氮源筛选培养基
氮源筛选培养基各成分的质量浓度:KH2PO40.5 g/L、MgSO40.5 g/L、NaCl 1.0 g/L、蔗糖 30 g/L,分别添加尿素、牛肉膏、蛋白胨和NH4Cl至10 g/L,pH值自然,分装50 mL于250 mL的三角瓶,121℃灭菌20 min,冷却至室温备用。
2.2 发酵条件
2.2.1 种子发酵条件
接种桑黄菌丝体于种子培养基,于28℃、150 r/min条件下培养24 h。
2.2.2 液体发酵培养条件
用无菌枪头移取2 mL种子液,接种于液体深层发酵培养基,并于28℃、150 r/min条件下培养7 d。
2.3 检测方法
2.3.1 桑黄生物量测定
发酵结束后以4 000 r/min离心20 min,再用无菌水洗涤2次后,60℃烘干至恒重并称重。
2.3.2 糖含量测定
还原糖含量采用DNS试剂法测定;总糖含量采用苯酚-硫酸法测定[16];多糖以两者差值计算。
2.4 试验设计
2.4.1 正交试验设计
在获得碳、氮源试验结果的基础上,结合预试验和部分参考文献[11-14],以碳氮质量比、MgSO4、KH2PO4和NaCl质量浓度为因素,分别设定为因素A、B、C、D,设计4因素3水平正交试验,优化发酵过程中培养基组成,试验设计因素水平见表1。

表1 正交试验因素水平Table 1 Factors and levels of orthogonal tests
2.4.2 生长过程分析
配制优化后的培养基各成分质量浓度:蔗糖 70 g/L,NH4Cl 10 g/L,KH2PO40.5 g/L,MgSO40.5 g/L,NaCl 1 g/L,pH值自然,250 mL三角瓶装液量50 mL,121℃灭菌20 min,冷却后以5%接种量接种,28℃、150 r/min条件下培养,每培养24 h取3瓶测定菌丝体质量,结果取3组平均值,共发酵8 d。发酵液pH值用pH计测定。
3 试验结果与分析
3.1 标准曲线
采用DNS法测定还原糖含量,得出标准曲线方程为y=0.306 67x-0.016 48(R2=0.993 9),还原糖标准曲线如图1所示。采用苯酚-硫酸法检测,以葡萄糖作为标准曲线,得出标准曲线方程为y=0.607 08x-0.029 08(R2=0.992 3),总糖标准曲线如图2所示。

图1 DNS法测定还原糖标准曲线Fig.1 Standard curve of reducing sugar analysis by DNSmethod
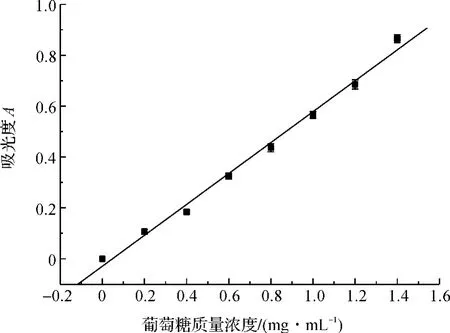
图2 苯酚-硫酸法测定总糖标准曲线Fig.2 Standard curve of total sugar analysis by phenol-sulphate acid method
3.2 培养基的优化
以蔗糖、淀粉、乳糖等为碳源,考察不同碳源对桑黄菌丝体生长的影响,结果如表2所示。由表2可知,最适合桑黄生长的碳源是蔗糖。
以尿素、牛肉膏、NH4Cl、蛋白胨为氮源进行优化,菌丝体干质量最大的为NH4Cl,结果如表3所示。

表2 不同碳源对桑黄菌丝干质量的影响Table 2 Effects of carbon sources on growth of Phellinus linteus

表3 不同氮源对桑黄干质量的影响Table 3 Effects of nitrogen sources on growth of Phellinus linteus
在对碳、氮源的筛选研究中,有采用玉米粉、黄豆粉[18]作为碳、氮源,以及采用玉米粉和麦麸作为碳源,蛋白胨作为氮源进行优化的研究[19],得到了较好的结果,后续可结合天然有机碳源和氮源进行研究。
3.3 合成培养基筛选
正交试验是在碳、氮源筛选的基础上,结合桑黄液体发酵适宜的碳氮质量比(A)、MgSO4(B)、KH2PO4(C)、NaCl(D)做因素水平设计,得到最适合桑黄生长的培养基,结果如表4所示。

表4 正交试验结果Table 4 Results of orthogonal tests
由正交试验结果可知,蔗糖70 g、NH4Cl 10 g(碳氮质量比 70 ∶10),NaCl、KH2PO4、MgSO4质量浓度分别为1、0.5、0.5 g/L时,对桑黄菌丝体生长最有利,在此条件下进行发酵试验,得到菌丝体干质量为2.814 g。
发酵液以4 000 r/min离心20 min得到菌丝体,再加蒸馏水洗涤2次后于60℃烘干,加20倍水研磨后浸提,离心取上清液用苯酚-硫酸法测总糖,还原糖用DNS法测定(表5)。

表5 正交试验桑黄菌丝体中的糖含量Table 5 Orthogonal results of polysaccharide concentrations in mycelial biomass %
由试验结果可知,正交试验中第7组总糖含量最高,还原糖含量也最高,两者之差即菌丝体多糖含量也最高,与菌丝体干质量含量结果一致;其次为第8组。这说明还原糖含量增加有利于桑黄菌丝体多糖的积累。该方法以总糖与还原糖含量之差进行多糖含量计算,可以初步反映多糖的含量,因此有必要用寡糖含量、对标药典等检测方法作深入研究。
3.4 桑黄的生长周期试验
将桑黄菌以5%接种到深层发酵培养基中连续培养,从第24 h开始测定其在培养192 h过程中的pH值和菌丝干质量变化,由图3可知桑黄在120 h时菌丝干质量达到最大值,pH值在培养120 h前呈下降的趋势,之后基本上趋于稳定(图4)。
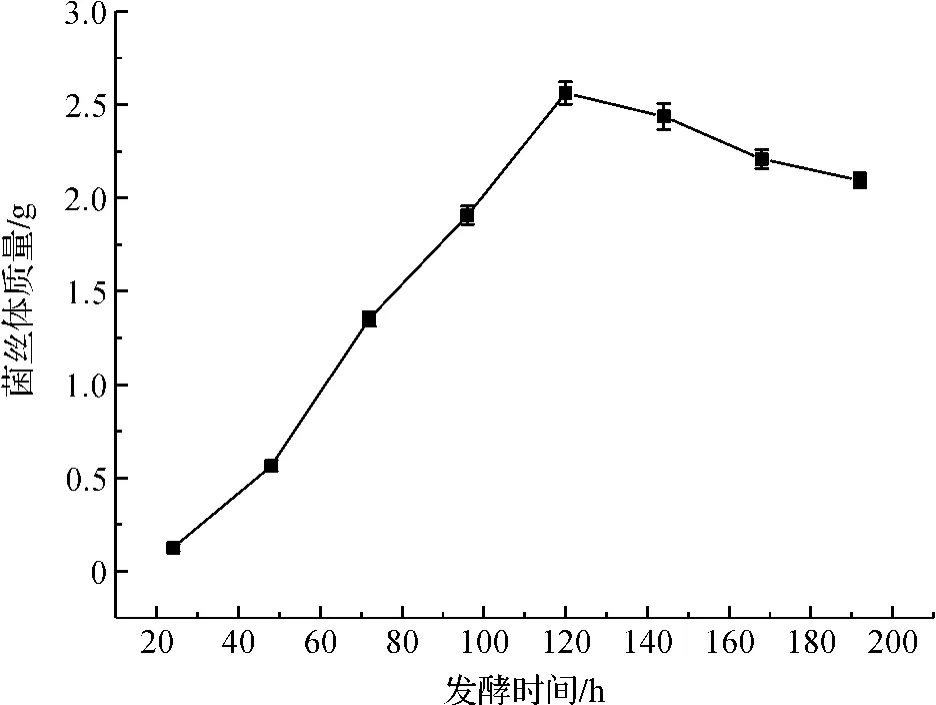
图3 桑黄菌丝体含量随发酵时间的变化Fig.3 Change of Phellinus ligniarius mycelium growth with time of fermentation

图4 pH值在桑黄培养过程中的变化Fig.4 Change of pH value in Phellinus ligniarius culture medium during fermentation
4 结论
以菌丝体生物量和多糖产量为主要指标,对桑黄(鲍氏层孔菌)的深层发酵碳源和氮源进行了初步筛选。结果表明,最适合桑黄生长的碳源和氮源分别是蔗糖和NH4Cl,在此基础上对桑黄发酵影响的培养基成分进行了三水平四因素正交试验,进一步表明,较优的培养基质量浓度为蔗糖70 g/L、NH4Cl 10 g/L、NaCl 1 g/L、KH2PO40.5 g/L、MgSO40.5 g/L,在此培养基下,接种量 5%,装液量 50 mL,培养 7 d 得到桑黄菌丝体2.814 g。发酵进程试验表明,桑黄菌丝体生成量呈现上升趋势,在120 h达到最高,随后呈逐渐下降的趋势;发酵液pH值呈逐渐下降的趋势,发酵120 h时基本趋于稳定。
[1] HSIEH P W,WU J B,WU Y C.Chemistry and biology of Phellinus linteus[J].BioMedicine,2013,3(3):106.
[2] 张林芳,邹莉.桑黄多糖的研究进展[J].中国食用菌,2012,31(4):1.
[3] WANG Y,YU J X,ZHANG C L,et al.Influence of flavonoids from Phellinus ligniarius on sturgeon caviar:antioxidant effects and sensory characteristics[J].Food Chemistry,2012,131(1):206.
[4] LUNG M Y,TSAI J C,HUANG P C.Antioxidant properties of edible basidiomycete Phellinus ligniarius in submerged cultures[J].Journal of Food Science,2010,75(1):18.
[5] ZHU T,KIM S H,CHEN C Y.A medicinal mushroom:Phellinus linteus[J].Current Medicinal Chemistry,2008,15(13):1330.
[6] REIS F S,BARREIRA J C M,CALHELHA R C,et al.Chemical characterization of the medicinal mushroom Phellinus linteus,(Berkeley & Curtis)Teng and contribution of different fractions to its bioactivity[J].LWT-Food Science and Technology,2014,58(2):478.
[7] 张文隽,吴亚召,雷萍,等.秦巴山区野生桑黄rDNA ITS序列及亲缘关系分析[J].中国食用菌,2015,34(1):50.
[8] SONG Y S,KIM S H,SA J H,et al.Antiangio genic,antioxidant and xanthine oxidase inhibition activities of the mushroom Phellinus linteus[J].Journal of Ethnophrmacology,2003,88(1):113.
[9] LI G,KIM D H,KIM T D,et al.Protein-bound polysaccharide from Phellinus linteus induces G2/M phase arrest and apoptosis in SW480 human colon cancer cells[J].Cancer Letters,2004,216(2):175.
[10] SHONE M Y,KIM T H,SUNG N J.Antioxidants and free radical scavenging activity of Phellinus baumii(Phellinus of Hymenochaetaceae)extracts[J].Food Chemistry,2003,82(4):593.
[11] 许谦.桑黄菌丝体黄酮液体发酵培养基的优化[J].食品与机械,2015,31(1):190.
[12] 丁兴红,温成平,丁志山,等.桑黄液体发酵生产多糖工艺研究[J].中草药,2012,43(5):906.
[13] 周新,李宏杰.黄酮类化合物的生物活性及临床应用进展[J].中国新药杂志,2007,16(5):350.
[14] 张文隽,吴亚召,雷萍,等.桑黄黄酮液体发酵培养条件的优化[J].中国食用菌,2017,36(2):52.
[15] 邵倩,杨焱.桑黄菌丝体研究进展[J].天然产物研究与开发,2013,25(B12):135.
[16] RAMOS M,BELTRN A,PELTZER M,et al.Release and antioxidant activity of carvacrol and thymol from polypropylene active packaging films[J].LWT-Food Science and Technology,2014,58(2):470.
[17] 宋红志,王方芹,王俊,等.桑黄菌丝体的液体发酵培养及多糖提取和抗氧化活性测定[J].蚕业科学,2016,42(4):700.
[18] 傅海庆,周阳,傅华英.药用真菌桑黄的液体发酵培养基的配方优化筛选研究[J].江西农业大学学报,2012,34(5):1039.
[19] 许谦.生产桑黄三萜类化合物液体发酵培养基的优化[J].中药材,2016,39(12):2836.
