黄土高原风蚀水蚀交错区典型植被对土壤酶活性的影响
2018-06-19王嘉维
王嘉维
(山西大学环境与资源学院,山西 太原 030006)
黄土高原风蚀水蚀交错区,是干旱和半干旱区生态系统共同作用的重要交错地带[1]。该区生态系统的优劣对于黄土高原防止水土流失、改善土壤质量和维护生态平衡具有重要作用。近年来,随着退耕还林(草)工程的实施,黄土高原风蚀水蚀交错区的生态系统得到有效改善,典型生物结皮与草本镶嵌分布,且覆盖度高达60%~70%[2]。目前,关于该区生态系统的研究报道已有不少,但大多集中于生物结皮的空间分布特征[3-4]、水土保持功能[5]、对土壤养分的影响[6]以及对土壤理化性质的影响[7]等。关于生物结皮与不同植被对生态系统的交错影响研究尚少,而二者对土壤酶活性的交错影响研究更为鲜见。
土壤酶是一种特殊的生物蛋白质,具有催化土壤养分分解和加速土壤元素循环的作用[8]。土壤酶来源于微生物、土壤动物和残体以及植物根系和凋零物分泌[9]。土壤酶的生物催化作用尤其以水解酶最为显著,对生态系统中的物质循环影响最为重要。植被可通过根系分泌物和凋零物分解来影响土壤酶活性,同时也通过改善微生物生存环境和酶促反应条件来影响土壤酶活性[10]。目前,已有许多学者针对水陆交错带[11]、农田生态系统[12-13]、森林态系统[14-15]以及湿地生态系统[16-17]中不同植被类型下的土壤酶活性差异进行了研究。黄土高原风蚀水蚀交错区地处干旱和半干旱区,该区植被恢复对整个黄土高原的水土流失治理乃至全国的生态修复有着重要意义,但针对该区不同类型植被土壤酶活性差异的研究仍鲜有报道。
本研究以毛乌素沙漠东缘发育近30 a的典型藓结皮、沙蒿群落以及长芒草群落为研究对象。分层(0~30 cm)取样,测定3种土壤酶活性,同时测定土壤有机质、碱解氮和速效磷的含量,分析了不同植被类型的土壤酶活性差异、垂直分布特征以及其对土壤养分的影响,以期进一步揭示典型植被对土壤酶活性的贡献,旨在为进一步了解土壤酶活性的作用机制提供实证,同时为毛乌素沙漠东缘的生态修复提供理论依据。
1 材料和方法
1.1 研究区概况
研究区位于黄土高原北部的陕西省神木县六道沟流域(38°46′~48°51′N,110°21′~110°23′E),海拔1 094.0~1 273.9 m[7],属中温带半干旱气候,降雨集中在6—9月,年降水量408.5 mm[7]。黄土高原北部是黄土高原向毛乌素沙漠的过渡地带,生态环境脆弱,风蚀、水蚀交错,水土流失严重。流域为典型的盖沙黄土丘陵地貌,分为东西两半,西部多为固定沙丘,以风沙土为主,占流域总面积的13.5%,东部则大部分为黄绵土覆盖,占流域总面积的86.5%[7]。
1.2 样地选择与样品采集
样品采集工作于2016年9月12—15日进行。沙蒿、长芒草和藓结皮3种典型植被类型各选3个样地(表1)。每种植被类型样地相邻近,且一一对应。每个样地随机选择4个样点,每个样点采集6种深度(0~5,5~10,10~15,15~20,20~25,25~30 cm)的土壤样品,并将同一样地中4个样点的同层次样品混合,即4种处理×3个样地×6种深度,共采集72个样品。样品使用直径70 mm、高50 mm的环刀采集,并将样品存于密封采样袋中于4℃下保存。样品预处理和分析测定于实验室进行。

表1 样地基本情况
1.3 测定项目及方法
1.3.1 土壤酶活性测定 脲酶活性用奈氏比色法测定[18],以37℃下1 g土样1 h生成NH3-N的μg数表示;碱性磷酸酶活性用磷酸苯二钠比色法[18]测定,以37℃下1g土样1h生成苯酚的μg数表示;蔗糖酶活性用3,5-二硝基水杨酸比色法[18]测定,以37℃下1 g土样1 h生成葡萄糖的μg数表示。
1.3.2 土壤理化性质测定 土壤有机质采用重铬酸钾氧化法进行测定;碱解氮采用碱扩散法进行测定;速效磷采用碳酸氢钠浸提-钼锑抗比色法进行测定。
1.4 数据处理
使用SPSS Statistics 22.0中描述性统完成数据平均值和标准误差的计算,使用LSD多重比较分析土壤酶活性和土壤养分的差异显著性。用Origin-Pro8.0完成数据作图。
2 结果与分析
2.1 不同类型植被的土壤酶活性差异
从图1可以看出,沙蒿6个土层的脲酶、碱性磷酸酶和蔗糖酶活性的平均值分别为25.2,27.6,19.6 μg/(g·h),分别是长芒草3种酶活性的1.2倍,1.1倍和1.1倍,是藓结皮的2.4倍,2.1倍和4.3倍。可见,沙蒿对土壤酶活性的影响明显大于长芒草和藓结皮。3种植被的土壤酶活性存在明显的表聚现象,且随土壤深度的增加而减弱。LSD分析结果表明,沙蒿的脲酶、碱性磷酸酶和蔗糖酶活性分别在0~20,0~15,0~15 cm土层与下层土壤存在显著差异,长芒草和藓结皮的3种酶活性分别在0~15,0~15,0~10 cm土层与下层土壤存在显著差异,表明沙蒿对土壤酶活性影响的表聚作用更为明显。
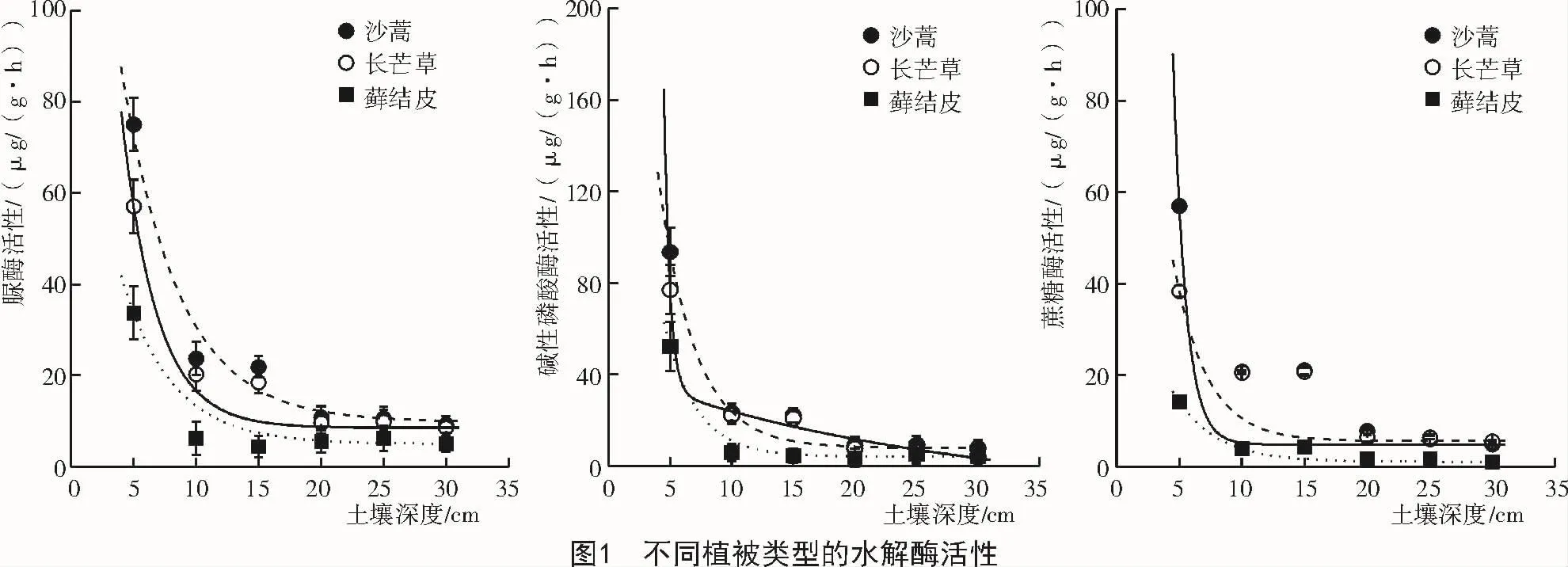
2.2 不同类型植被的有机质含量差异

3种植被的土壤有机质含量都随着土壤深度的增加而递减,其中,沙蒿的递减趋势更为明显(图2)。LSD分析结果表明,沙蒿的有机质含量在0~20 cm土层差异显著,长芒草的有机质含量仅在0~10 cm土层差异显著,而藓结皮的有机质含量则是在0~30 cm土层差异均不显著。沙蒿、长芒草和藓结皮有机质含量的平均值分别为2.4,1.1,0.8 g/kg,沙蒿的有机质含量是长芒草的2.1倍,是藓结皮的3.0倍,表明沙蒿对土壤有机质的影响幅度明显大于长芒草和沙蒿。
2.3 不同类型植被的速效氮和速效磷含量差异
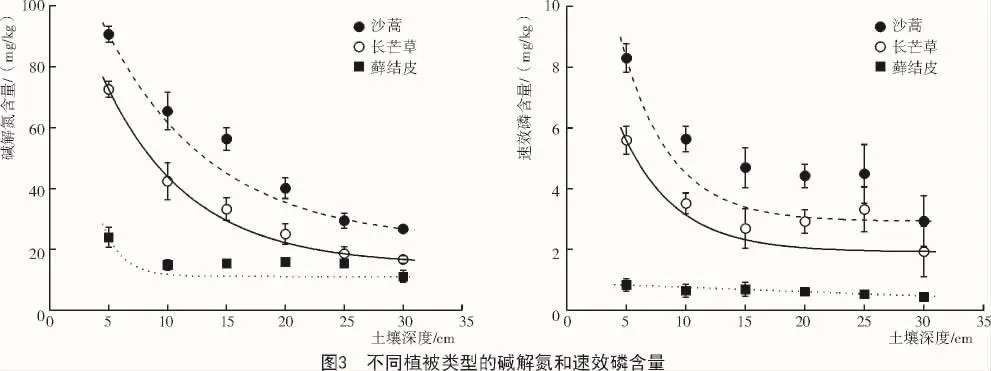
从图3可以看出,与土壤有机质含量相似,3种典型植被的碱解氮和速效磷含量有明显的垂直剖面分布特征,即碱解氮和速效磷含量随土壤深度增加而递减。沙蒿的碱解氮含量在0~30 cm土层差异显著,长芒草的碱解氮含量在0~20 cm土层差异显著,而藓结皮的碱解氮含量仅在0~5 cm土层差异显著;就3种典型植被的相互比较而言,在0~30 cm土层范围内3种植被的碱解氮含量两两之间存在显著差异。LSD分析表明,沙蒿的速效磷含量在0~15,25~30 cm土层差异显著,长芒草的速效磷含量在0~20 cm土层差异显著,而藓结皮的速效磷含量仅在0~5 cm土层差异显著,且在0~30 cm土层范围内3种植被的速效磷含量两两之间存在显著差异。3种植被碱解氮含量的平均值为51.4,34.7,16.1 mg/kg;3种植被碱解氮含量的平均值为5.0,3.3,0.6 mg/kg,表明沙蒿对碱解氮和速效磷含量的影响明显大于长芒草和藓结皮。
2.4 土壤酶活性与土壤养分的相关性
对土壤酶和土壤养分之间进行了相关性分析,结果显示,不仅土壤酶与土壤养分之间存在着极显著相关性(P<0.01),且土壤酶之间也存在极显著相关性(P<0.01)(表2)。表明土壤酶活性不仅对土壤养分有明显影响,酶与酶之间也存在着相互影响作用。
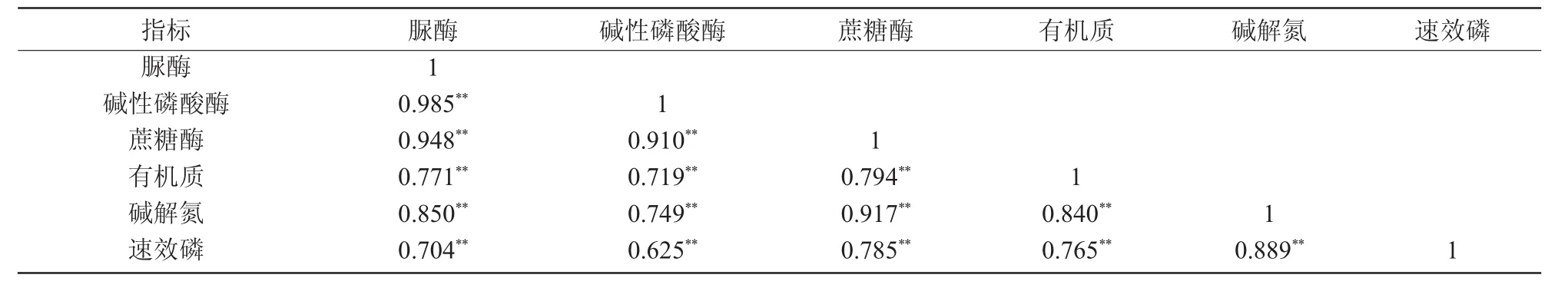
表2 土壤酶活性与土壤养分的相关关系
3 讨论
3.1 植被类型对土壤酶活性的影响
本研究表明,植被类型对土壤酶活性的影响大小是草本>结皮,且二者之间存在极显著差异(P<0.001)。这与刘艳等[19]在黄河三角洲冲积平原湿地、刘存歧等[20]在长江口潮滩湿地以及SEDIA等[21]在新泽西的研究结果相似。相关研究表明,不同植被类型对土壤酶活性的影响存在着显著差异,其作用机制主要包括3个方面:植物根和凋零物是土壤酶的主要来源之一,不同类型植被的生物量存在显著差异,从而导致植物根和凋零物向周围土壤分泌酶活性的差异[22];土壤微生物是土壤酶的另一重要来源,不同类型植被土壤微生物的丰度、多样性以及生物量存在差异,继而导致不同类型植被酶活性的差异[23];土壤温度、水分以及pH值等土壤性质是酶促反应的重要条件,不同类型植被对土壤酶促反应条件的改变间接影响了土壤酶活性的提升[18]。但本研究中3种水解酶活性的提升幅度低于刘艳等和刘存歧等的研究,其原因可能是由于不同研究区,植被的发育年限、植被覆盖度、植被生物量以及植物根系的发达程度存在差异,从而导致不同研究区植被类型对土壤酶活性的提升差异;不同研究区土壤微生物的丰度和多样性存在差异,导致不同研究区土壤微生物的酶分泌能力差异。
本研究结果表明,不同植被类型的土壤酶活性存在相似的垂直分布特征,即土壤酶活性随土壤深度增加而递减。这与吴楠等[24]和ENOWASHU等[25]的研究结论相似。其原因主要是:土壤酶作为一种特殊的生物蛋白并不能单独存在于土壤中,而是与以物理或化学结合形式吸附在土壤有机和无机颗粒上,或与腐殖质络合,本研究表明,土壤有机质含量在垂直分布上存在着明显的垂直递减特征,因此,土壤酶活性呈相似的递减特征;植被对土壤理化性质的改善随土壤深度的增加而减弱,对土壤微生物生存环境和营养源的改善也随土壤深度的增加而减弱,因此,土壤微生物存在垂直递减特征,进而影响酶活性的垂直分布特征;所研究的3种植被类型的植物根系发达程度均随土壤深度的增加而递减,从而导致植物根在酶分泌能力上存在着垂直递减特征。
3.2 土壤性质对土壤酶活性的影响
脲酶能够催化尿素水解生成氨、二氧化碳和水[18],脲酶在土壤氮循环中起重要作用[18]。安韶山等[26]研究认为,脲酶能促进碱解氮的转化,而SAKORN[27]则认为,脲酶虽能促进碱解氮的转化,但二者间并无明显相关关系。这种差异可能与不同研究区氮含量、土壤微生物数量以及植被生长状况的差异有关。碱性磷酸酶参与有机磷的转化,酶促酯磷盐键的水解性裂解[18]。大多研究认为,碱性磷酸酶能加速有机磷的脱磷速度,提高土壤磷的有效性[28-30]。蔗糖酶断裂蔗糖分子键,生成葡萄糖和果糖[18],在土壤碳循环中起重要作用。徐华勤等[31]研究认为,蔗糖酶有利于有机质的分解转化,但也有学者研究认为,蔗糖酶与有机质并没有明显相关性[32],这与有机质是土壤长期积累的产物,而蔗糖酶活性受环境因素的影响而产生短时间的变化有关。本研究结果显示,土壤水解酶活性与土壤养分含量彼此之间显著相关,3种水解酶能显著提升土壤有机质、碱解氮和速效磷含量,与徐华勤等[31]、安韶山等[26]以及叶协锋等[28]的研究结论一致。
4 结论
本研究结果表明,沙蒿的脲酶、碱性磷酸酶和蔗糖酶活性平均值分别为25.2,27.6,19.6 μg/(g·h),长芒草的土壤酶活性的平均值分别为20.6,23.1,16.3 μg/(g·h),而藓结皮的3种土壤酶活性的平均值分别为10.1,12.7,4.5 μg/(g·h),植被类型对3种土壤酶活性的影响大小是沙蒿>长芒草>藓结皮;3种典型植被的土壤酶活性呈现相似的剖面分布特征,即随着土壤深度增加而递减;沙蒿的有机质、碱解氮和速效磷含量的平均值分别为2.4 g/kg和51.4,5.0 mg/kg,长芒草的3种土壤养分含量的平均值分别为1.1 g/kg和34.7,3.3 mg/kg,藓结皮的3种土壤养分含量的平均值分别为0.8 g/kg和16.1,0.6 mg/kg,植被类型对土壤养分的影响大小是沙蒿>长芒草>藓结皮;土壤酶活性和土壤养分含量之间显著相关。综合认为,黄土高原风蚀水蚀交错区不同植被类型之间的土壤酶活性和土壤养分含量存在显著差异,且植被对土壤酶活性和土壤养风含量的影响随着土壤深度增加而减弱。黄土高原植被发育对土壤养分积累具有重要作用,对生态环境修复意义重大。
[1]卜崇峰,蔡强国,张兴昌,等.黄土结皮的发育机理与侵蚀效应研究[J].土壤学报,2009,46(1):16-23.
[2]王一贺,赵允格,李林,等.黄土高原不同降雨量带退耕地植被- 生物结皮的分布格局[J].生态学报,2016,36(2):377-386.
[3]袁方,张振师,张朋,等.陕北小流域生物结皮空间分布影响因子的通径分析[J].水土保持研究,2015,22(6):30-35.
[4]卜崇峰,张朋,叶菁,等.陕北水蚀风蚀交错区小流域苔藓结皮的空间特征及其影响因子 [J].自然资源学报,2014,29(3):490-499.
[5]孟杰,卜崇峰,张兴昌,等.陕北水蚀风蚀交错区不同植被下生物结皮的发育特征研究 [J].西北林学院学报,2011,26(4):41-46.
[6]肖波,赵允格,邵明安.黄土高原侵蚀区生物结皮的人工培育及其水土保持效应[J].草地学报,2008,16(1):28-33.
[7]肖波,赵允格,许明祥,等.陕北黄土区生物结皮条件下土壤养分的积 累及 流失风险 [J].应 用生态学报,2008,19(5):1019-1026.
[8]杨航宇,刘艳梅,王廷璞.荒漠区生物土壤结皮对土壤酶活性的影响[J].土壤学报,2015,52(3):654-664.
[9]ZHANGBC,ZHOUX B,ZHANG Y M.Responses of microbial activities and soil physical-chemical properties to the successional process of biological soil crusts in the Gurbantunggut Desert,Xinjiang(In Chinese)[J].Journal of Arid Land,2015,7(1):101-109.
[10]BOWKER MA,MAU R L,MAESTRE F T,et al.Functional profiles reveal unique ecological roles of various biological soil crust organisms[J].Functional Ecology,2011,25(4):787-795.
[11]杨文彬,耿玉清,王冬梅.漓江水陆交错带不同植被类型的土壤酶活性[J].生态学报,2015,35(14):4604-4612.
[12]杨敏芳,朱利群,韩新忠,等.耕作措施与秸秆还田对稻麦两熟制农田土壤养分、微生物生物量及酶活性的影响[J].水土保持学报,2013,27(2):272-275,281.
[13]顾美英,徐万里,茆军,等.新疆绿洲农田不同连作年限棉花根际土壤微生物群落多样性 [J].生态学报,2012,32(10):3031-3040.
[14] VASCONCELLOS R L F,BONFIM J A,ANDREOTE F D,et al.Microbiological indicators of soil quality in a riparian forest recovery gradient[J].Ecological Engineering,2013,53:313-320.
[15]孔爱辉,耿玉清,余新晓.北京低山区栓皮栎林和油松林土壤酶活性研究[J].土壤,2013,45(2):264-270.
[16]万忠梅,宋长春,郭跃东,等.毛苔草湿地土壤酶活性及活性有机碳组分对水分梯度的响应 [J].生态学报,2008,28(12):5980-5986.
[17]吴俐莎,唐杰,罗强,等.若尔盖湿地土壤酶活性和理化性质与微生物关系的研究[J].土壤通报,2012,43(1):52-59.
[18]关松荫.土壤酶及其研究方法 [M].北京:中国农业科技出版社,1986:19-20.
[19]刘艳,马风云,侯龙鱼,等.黄河三角洲冲积平原湿地土壤脲酶活性与养分通径分析 [J].华中农业大学学报,2007,26(3):327-329.
[20]刘存歧,陆健健,李贺鹏.长江口潮滩湿地土壤酶活性的陆向变化与环境因子的相关性 [J].生态学报,2007,27(9):3663-3669.
[21]SEDIA E G,EHRENFELD J G.Differential effects of lichens and mosses on soil enzyme activity and litter decomposition[J].Biology and Fertility of Soils,2006,43(2):177-189.
[22]AON M A,COLANERI A C.II.Temporal and spatial evolution of enzymatic activities and physico-chemical properties in an agricultural soil[J].Applied Soil Ecology,2001,18(3):255-270.
[23]TAYLOR J P,WILSONB,MILLSMS,et al.Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques[J].Soil Biology and Biochemistry,2002,34(3):387-401.
[24]吴楠,张元明.古尔班通古特沙漠生物土壤结皮影响下的土壤酶分布特征[J].中国沙漠,2010(5):1128-1136.
[25] ENOWA SHU E,POLL C,LAMERSDORF N,et al.Microbial biomass and enzyme activities under reduced nitrogen deposition in a spruce forest siol[J].Applied soil Ecology,2009,43:11-21.
[26]安韶山,黄懿梅,李壁成,等.用典范相关分析研究宁南宽谷丘陵区不同土地利用方式土壤酶活性与肥力因子的关系 [J].植物营养与肥料学报,2005,11(5):704-709.
[27]SAKORN P P.Urease activity and fertility status of some lowland rice soils in the central plain[J].Thai J of Agric Sci,1987,20:173-186.
[28]叶协锋,杨超,李正,等.绿肥对植烟土壤酶活性及土壤肥力的影响[J].植物营养与肥料学报,2012,19(2):445-454.
[29]SARDANS J,PEUELAS J,ESTIARTE M.Changes in soil enzymes related to C and N cycle and in soil C and N content under prolonged warming and drought in a Mediterranean shrubland[J].Applied Soil Ecology,2008,39(2):223-235.
[30]HU Y L,WANG S L,ZENG D H.Effects of single Chinese fir and mixed leaf litters on soil chemical,microbial properties and soil enzyme activities[J].Plant and Soil,2006,282(1/2):379-386.
[31]徐华勤,章家恩,冯丽芳,等.广东省典型土壤类型和土地利用方式对土壤酶活性的影响 [J].植物营养与肥料学报,2010,16(6):1464-1471.
[32] TIAN L,DELL E,SHI W.Chemical composition of dissolved organic matter in agroecosystems:correlations with soil enzyme activityand carbon and nitrogen mineralization[J].Applied Soil Ecology,2010,46(3):426-435.
