桔梗与大葱间作对土壤养分、微生物区系和酶活性的影响
2018-06-19祝丽香陈香香孙文帅
王 鹏,祝丽香,陈香香,冯 惠,孙文帅,秦 宁
(山东农业大学农学院,山东泰安 271018)
桔梗是典型的忌连作经济作物,连作造成桔梗根腐病严重、植株生长不良、产量和品质下降。目前,药农多使用农药防治桔梗连作障碍以致土壤农药残留超标。随着人们环保意识的增强和对桔梗品质要求的提高,减少农药使用量势在必行,无公害防治连作障碍是桔梗种植业可持续发展的关键。
连作障碍与土壤微生物种类和数量密切相关。桔梗连作障碍是土壤微生态失调、养分失衡的必然结果[1],调控土壤微生态环境和土壤养分是控制桔梗连作障碍的关键所在。合理的土壤微生物群落结构、丰富的多样性和较高的活性能够缓解或消除连作障碍[2]。土壤微生物多样性与田间植物多样性密切相关。间作增加了田间作物种类,有利于土壤微生物多样化。而且,合理间作消减连作障碍的现象已在农作物、蔬菜等间作体系如西瓜与旱稻、小麦与蚕豆的间作研究中得到证实[3–4]。
间作能控制病害、消减连作障碍的主要机理是利用作物与病原菌之间的化感效应。很多植物茎叶产生的挥发性物质、根系产生的分泌物质具有抑菌活性,能够抑制病原菌的繁殖和生长。葱属植物产生的含硫化合物能够氧化巯基使与微生物生长繁殖有关的含硫巯基酶失活,从而对众多致病菌起到抑制或杀灭作用,减少致病菌数量[5–6],提高了土壤中有益微生物所占比例,有利于恢复土壤生态平衡。大葱是人们喜食的调味蔬菜,农民习惯在作物垄间、地头种植大葱。大葱为须根系、入土浅,主要吸收表层土壤的养分,桔梗为主根系,入土深,主要吸收深层土壤的养分。在土壤中桔梗、大葱根系分布存在空间生态位分离,空间生态位分离是间作优势产生的主要生态机制。前期试验也证实,间作大葱显著提高桔梗养分吸收量,具有明显的间作优势[7]。但未研究桔梗大葱间作是否有助于桔梗连作田恢复土壤微生态平衡、消减桔梗连作障碍。
土壤中致病真菌数量增加是桔梗连作障碍产生的主要原因[1]。李家家等[8]研究平邑甜茶幼苗与葱混作发现,混作大葱能提高连作土壤中细菌数量,减少真菌数量,减轻苹果连作障碍。杨敏等[9]证实,间作葱属作物能有效控制由镰孢菌、立枯丝核菌等病原菌引起的土传病害。桔梗根腐病的主要病原菌为镰孢腐霉属真菌。由此假设桔梗与大葱间作能够改善桔梗连作田土壤环境,减轻桔梗连作障碍。
本研究采用田间试验研究桔梗大葱不同行比间作土壤微生物数量、土壤酶活性和土壤养分含量的变化,旨在探索桔梗大葱间作对土壤环境的影响,为消减桔梗连作障碍提供一种绿色无公害的种植方法。
1 材料与方法
1.1 试验材料与试验设计
田间试验采用随机区组试验。基肥为常规复合肥 (N∶P2O5∶K2O = 14∶14∶14),由山东农大肥业科技有限公司生产,用量1500 kg/hm2。做南北走向、高15 cm、宽100 cm、畦间距45 cm的高畦。试验设桔梗单作和桔梗∶大葱行数比2∶1、3∶1、4∶1间作共4个处理,分别标记为SJG、IJC21、IJC31、IJC41。桔梗、大葱均采用种苗移栽且株行距相同,桔梗株行距6 cm × 25 cm,大葱为6 cm × 20 cm,在畦面上按东西方向种植。小区面积为12 m2(长12 m × 宽1 m),三次重复。桔梗大葱的移栽时间2013、2014、2015、2016分别为4月15日、4月25日、4月16日、4月21日。
田间试验于2013—2016年在山东农业大学药用植物栽培基地进行。试验地位于东经117.06°,北纬36.20°,海拔174.40 m,属于温带大陆性半湿润季风气候区。年平均气温13.4℃,全年 ≥ 0℃平均积温4731℃,≥ 10℃平均积温4213℃,无霜期195 d,年降水量697.3 mm,夏季降水占年降水量的62.1%。试验田为桔梗连作3年的地块,2013年试验开始时耕层 (0—20 cm) 土壤有机质7.13 g/kg、碱解氮48.63 mg/kg、速效磷29.3 mg/kg、速效钾53.09 mg/kg、pH 6.3。
1.2 取样及土壤特性测定
2016年4月21日移栽后第15 d (即5月6日) 开始取样,以后每隔30 d采集土样,共采集6次土样。取样点设置在桔梗–桔梗行间、桔梗–大葱行间各选5个采样点采集0—20 cm土壤,每个小区所取土壤按对角线法留取1 kg土壤作为样品。一部分样品冷冻保存用于测定土壤微生物,一部分自然风干常温保存用于测定土壤酶活性及土壤有效氮磷钾含量。
1.3 测定项目与方法
土壤脲酶、碱性磷酸酶、转化酶和多酚氧化酶活性分别采用靛酚蓝比色法、磷酸苯二钠比色法、3,5-二硝基水杨酸比色法和邻苯三酚法[10]。土壤微生物采用平板培养计数法,细菌、真菌、放线菌分别采用牛肉膏蛋白胨、马丁氏和改良高氏培养基[11]。土壤碱解氮含量采用碱解扩散法测定;有效磷含量采用0.5 mol/L NaHCO3浸提—钼锑抗比色法测定;速效钾含量采用1 mol/L NH4OAC浸提—火焰光度计法测定[12]。
1.4 数据处理
采用DPS7.05软件和最小显著差数法 (LSD) 进行数据统计分析。
2 结果与分析
2.1 间作对土壤有效氮、磷、钾含量的影响
桔梗单作和间作土壤有效氮含量6月最高,随后持续下降至10月最低。生育期内桔梗大葱间作处理土壤有效氮含量显著高于桔梗单作处理 (图1)。10月,桔梗大葱间作处理IJC21、IJC31、IJC41土壤有效氮含量分别为44.80、42.00和36.54 mg/kg,比桔梗单作处理SJG分别提高了50.0%、40.6%和22.3%,提高幅度随桔梗大葱间作行比增加逐渐降低。桔梗大葱行比为4∶1时,土壤碱解氮含量仍显著高于桔梗单作SJG,说明间作大葱有利于提高土壤有效氮含量。
桔梗单作和间作土壤有效磷含量5—7月呈下降趋势,7月后开始升高至8月出现峰值,随后降低。5—8月桔梗大葱间作土壤有效磷含量高于桔梗单作,8月后反之。与5月相比,10月桔梗单作土壤有效磷含量降低了32.8%,桔梗大葱间作降低了37.8%~43.4%,降低幅度随桔梗大葱间作行比的增加而减少。10月,与桔梗单作处理SJG相比桔梗大葱间作处理IJC21、IJC31、IJC41土壤有效磷含量分别降低了11.6%、8.8%和3.7%。可见,桔梗大葱间作提高桔梗生育前期土壤有效磷含量,降低桔梗生育后期土壤有效磷含量。
桔梗单作和间作处理土壤速效钾含量变化趋势相同,5—8月快速下降,桔梗单作处理土壤速效钾含量高于桔梗大葱间作处理,桔梗大葱间作处理间差异不显著;8—10月桔梗单作和间作处理土壤速效钾含量无明显差异。10月,桔梗大葱间作处理IJC21、IJC31、IJC41土壤速效钾含量分别为56.26、56.93和56.87 mg/kg,不同间作处理间差异不显著,且仅比桔梗单作处理SJG降低了1.3%~2.4%。
2.2 间作对土壤酶活性的影响
由图2可知,5—6月桔梗单作和间作脲酶活性维持最高水平,桔梗大葱间作处理间土壤脲酶活性无显著差异,但显著高于桔梗单作处理。5月,桔梗大葱间作处理土壤脲酶活性比桔梗单作增加了7.4%~10.0%,6月仅增加了3.4%~6.7%。6—8月桔梗单作和间作处理土壤脲酶活性均快速下降至8月最低值,随后略有升高。10月,桔梗大葱间作处理IJC21、IJC31、IJC41土壤脲酶活性分别比桔梗单作处理SJG提高了12.0%、9.9% 和5.7%,差异显著。可见,间作大葱有利于提高土壤脲酶活性。
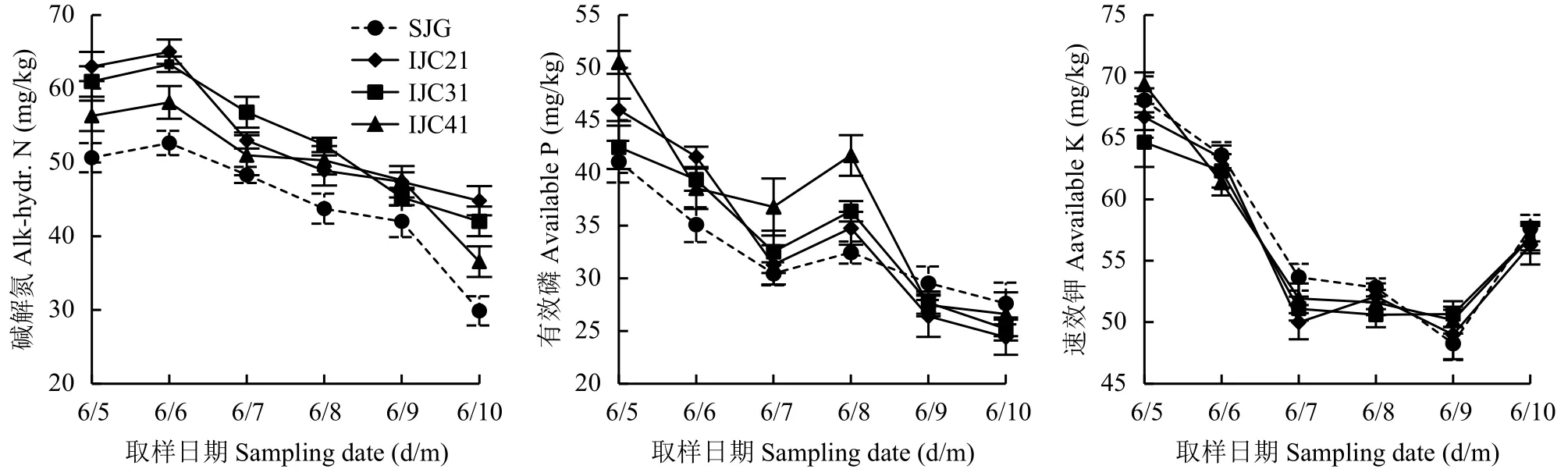
图 1 不同间作处理下土壤有效氮磷钾含量随时间的变化Fig. 1 Soil available N, P and K contents alone with growing time under different intrcropping patterns

图 2 不同间作模式下土壤酶活性随时间的变化Fig. 2 Dynamics of enzyme activities of soil with growing days under different intrcropping patterns
桔梗单作和桔梗大葱间作处理IJC21土壤碱性磷酸酶活性呈单峰曲线变化,桔梗单作处理土壤碱性磷酸酶活性最高值 (1.53 mg/g) 出现在7月,桔梗大葱间作处理 (1.47 mg/g) 出现在6月 (图2)。桔梗大葱间作处理IJC31、IJC41土壤碱性磷酸酶活性呈双峰曲线变化,峰值分别出现在6月和8月,且6月峰值显著高于8月。生育期内桔梗大葱间作处理土壤碱性磷酸酶活性除7月外均高于桔梗单作。10月,桔梗大葱间作处理IJC21、IJC31、IJC41土壤碱性磷酸酶活性分别比桔梗单作处理SJG提高了11.8%、42.1%和30.1%,表明间作大葱显著提高了土壤碱性磷酸酶活性。
桔梗单作和间作处理土壤转化酶活性保持稳定,维持在100.75~103.64 mg/g(图2),生育期内仅波动2.95个单位。
5—8月桔梗单作和间作处理土壤多酚氧化酶活性变化趋势相同且无显著差异,均表现为先快速下降,后缓慢升高。8—10月,桔梗大葱间作处理IJC21、IJC31土壤多酚氧化酶活性继续升高,桔梗单作和桔梗大葱间作处理IJC41则开始降低 (图2)。生育期内,桔梗大葱间作处理土壤多酚氧化酶活性高于桔梗单作。
10月,桔梗大葱间作处理IJC21、IJC31、IJC41土壤多酚氧化酶活性分别比桔梗单作处理SJG提高了181.9%、151.1%和29.1%,差异显著。随桔梗大葱间作行比增加土壤多酚氧化酶活性逐渐降低,表现为 JC21> JC31> JC41。
2.3 间作对土壤微生物的影响
由图3可知,生育期内桔梗大葱间作处理土壤细菌数量始终显著高于桔梗单作处理。桔梗单作和间作土壤细菌数量呈单峰曲线变化,7月数量最多,随后开始下降。7月桔梗大葱间作处理IJC21、IJC31、IJC41土壤细菌数量比桔梗单作处理SJG分别增加了71.3%、66.2%和57.0%,10月分别增加了52.6%、47.6%和20.7%。生育期内土壤细菌数量 IJC21> IJC31> IJC41>SJG。由此可知,间作大葱显著增加土壤细菌数量,增加幅度随桔梗大葱间作行比的增加而降低。
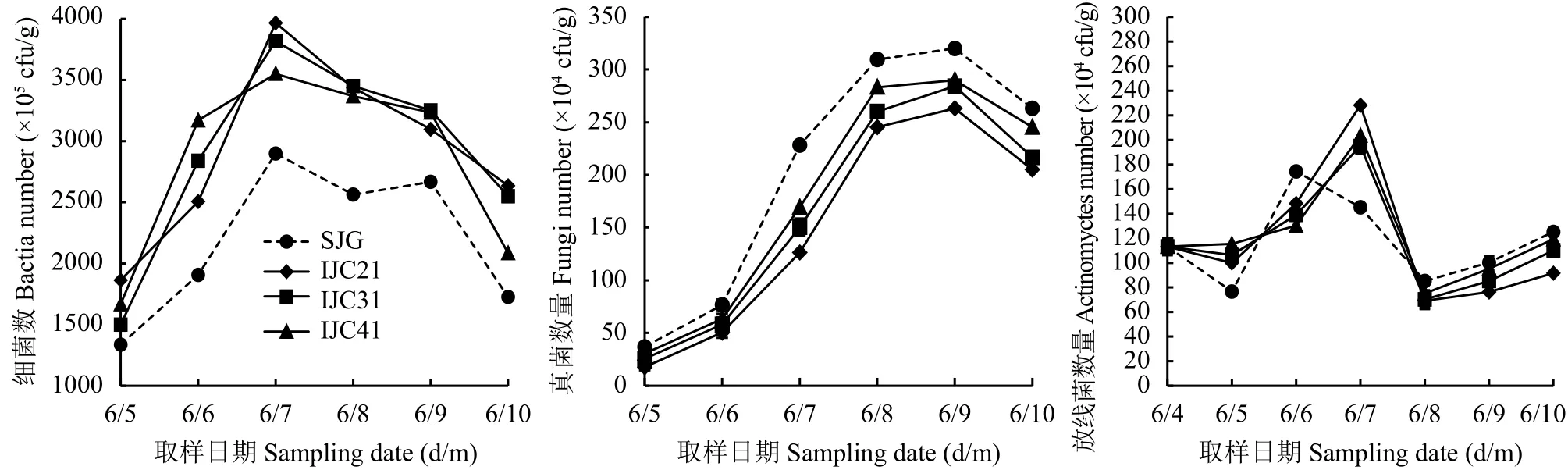
图 3 不同间作模式下土壤微生物量随时间的变化Fig. 3 Population variation of soil microorganism with growing time under different intercropping patterns
桔梗单作和间作土壤真菌数量变化趋势相同,呈单峰曲线。5—8月桔梗单作和间作土壤真菌数量快速增加,8—9月土壤真菌数量最多且保持稳定,9月后略有降低。10月,桔梗大葱间作处理IJC21、IJC31、IJC41土壤真菌数量比桔梗单作处理分别降低了22.1%、17.7%和6.8%。生育期内桔梗单作处理土壤真菌数量显著高于桔梗大葱间作处理,表现为SJG > JC41> JC31> JIC21,说明间作大葱能够降低土壤真菌数量。
桔梗单作土壤放线菌数量最大值出现在6月,比5月增加了27.5%,桔梗大葱间作处理土壤放线菌数量最大值出现在7月且显著高于桔梗单作处理。与5月相比,7月桔梗大葱间作处理IJC21、IJC31、IJC41土壤放线菌数量分别增加了128.2%、83.3%和76.5%。桔梗单作和间作处理土壤放线菌数量最小值均出现在8月 (图3)。8—10月,桔梗单作土壤放线菌数量高于桔梗大葱间作,表现为SJG > JC41> JC31>JIC21,但桔梗单作和桔梗间作处理间土壤放线菌数量差异不显著。
与桔梗单作处理相比,桔梗大葱间作处理不改变土壤细菌、真菌、放线菌数量的变化趋势,增加了细菌和放线菌数量,降低了真菌数量。
采收期,桔梗大葱间作处理增加了土壤微生物总量,改变了土壤细菌和真菌比值 (表1)。桔梗大葱间作处理土壤微生物总量比桔梗单作增加2.43~2.89倍,其中细菌数量增加2.96~3.64倍,而真菌数量则降低6.85%~22.08%,细菌/真菌提高了3.18~4.67倍。随着桔梗大葱间作行比的增加,土壤细菌数量呈下降趋势,土壤真菌数量呈上升趋势。说明桔梗大葱间作对土壤微生物数量及其比例具有良好的调节作用,不仅提高了土壤微生物总量,而且提高细菌所占比率,有利于改善土壤环境。
3 讨论
作物生长过程中需要从土壤中吸取养分,同时以根系分泌的方式向土壤输送如碳、氮等有机化合物,从而影响土壤养分含量。作物不同生长阶段根系分泌物数量和种类的差异造成土壤养分含量的季节性变化。间作根系分泌物的种类和数量显著大于单作,以致间作土壤养分的季节性变化幅度大于单作。多数研究发现,土壤脲酶活性与土壤有效氮含量正相关,本研究中桔梗单作和间作处理土壤脲酶活性差异不显著,而桔梗大葱间作处理土壤有效氮含量显著高于桔梗单作,这意味着桔梗大葱间作土壤有效氮含量的提高来自其他途径。Fan等[13]发现,土壤微生物能将全氮转化为有效氮,提高土壤有效氮含量。王淑平[14]、王华等[15]研究证实土壤有效氮含量与土壤微生物总量显著正相关。桔梗大葱间作土壤微生物总量显著高于桔梗单作,这可能是桔梗大葱间作土壤有效氮含量显著高于桔梗单作的主要原因。
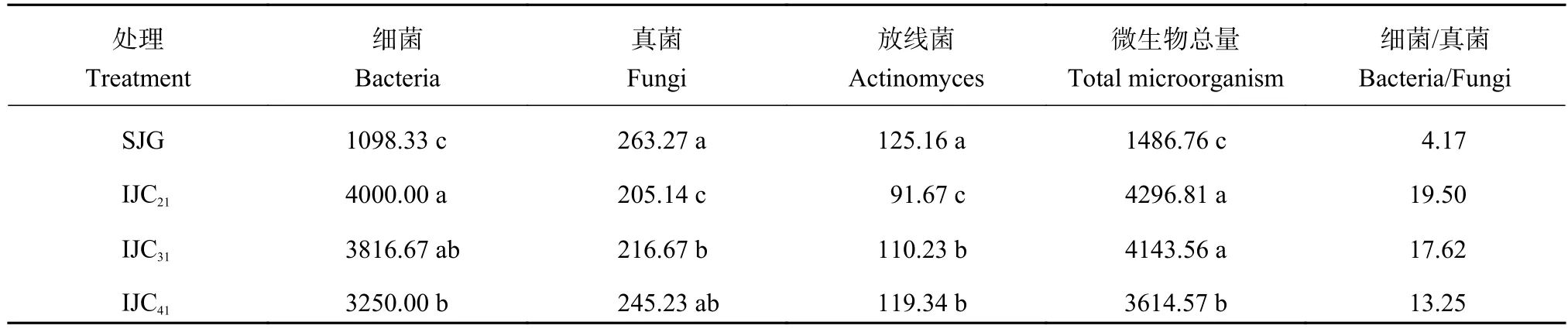
表 1 采收期不同间作模式土壤微生物的变化 (× 105 cfu/g)Table 1 Soil microorganism at the harvest under different intercropping patterns
磷在土壤中移动性差,植物对磷的吸收属于接触吸收,根系的空间分布及动态变化影响根系对磷的吸收。5—8月大葱处于低资源需求的缓苗期和夏眠期,根系生长缓慢在土壤中分布范围小,吸收磷的能力弱,而桔梗处于高资源需求的生长旺盛期,根系在土壤中迅速扩展,吸收磷的能力强以致桔梗单作土壤有效磷含量低于桔梗大葱间作。土壤碱性磷酸酶是一种诱导性酶,土壤有效磷缺乏时其活性增强促进土壤有机磷转化成植物能利用的有效磷[16]。7月桔梗单作土壤碱性磷酸酶活性高于桔梗大葱间作恰好说明桔梗单作土壤有效磷缺乏。8—10月大葱进入高资源需求的生长旺盛期,须根数量增多。Fohse等[17]研究认为,细根对磷的吸收效率大于粗根。大葱须根纤细且数量众多,增强了大葱吸收土壤磷的能力,导致桔梗大葱间作生育后期土壤有效磷含量低于桔梗单作,增强了桔梗大葱间作土壤磷酸酶活性。
大葱、桔梗的生物学特性决定了5—8月桔梗大葱间作土壤中钾吸收能力低于桔梗单作,土壤速效钾含量应高于桔梗单作。大葱对土壤氮磷钾吸收比例为1∶0.41∶1.3,桔梗为1∶0.28∶0.48,9—10月大葱生长旺盛期恰逢桔梗生长衰弱期,桔梗单作吸收土壤钾的能力显著低于桔梗大葱间作,土壤速效钾含量应高于桔梗大葱间作。但研究结果却与此相反:5—8月桔梗单作土壤速效钾含量高于桔梗大葱间作,9—10月与桔梗大葱间作无显著差异。已有研究表明,土壤养分比例失调易产生离子拮抗,抑制植物对离子的吸收。祝丽香等[1]研究发现桔梗连作造成土壤有效氮磷钾比例失调。本研究试验用地为桔梗连作3年的地块,试验持续4年,即桔梗单作田连续种植桔梗7年,连作造成土壤养分失调导致桔梗钾吸收障碍。这可能是桔梗单作土壤速效钾含量高于桔梗大葱间作的主要原因。时安东等[18]在研究烤烟与红薯、花生间作时也发现,烤烟长期单作土壤养分失调造成烤烟养分吸收障碍以致土壤养分含量高于烤烟间作。
桔梗连作障碍主要表现为根腐病发病率显著升高。Hao等[19]研究认为,作物土传病害发生的根本原因是连作作物根系分泌物的定向选择作用刺激了土壤中病原微生物生长、抑制了有益微生物生长,导致土壤微生态失衡。调控土壤微生物群落结构是防治土传病害的关键所在,这需要依靠土壤微生物的群体作用。当土壤微生物群落结构越丰富以及多样性越高时对抗病原菌的综合能力就越强[20]。Latz等[21]证实增加植物种类可以显著提高土壤有益微生物数量,降低致病菌数量。Wang等[22]发现土壤微生物多样性与地上植被物种的多寡正相关。间作增加了田间作物种类,提高了土壤微生物多样性[23]。黄瓜大葱间作增加土壤细菌数量,降低真菌数量,土壤真菌多样性和均匀度指数显著升高[24]。Kumari等[5]和张伟等[25]研究均发现,葱属植物根系分泌的含硫化合物能够氧化巯基,对致病原真菌具有抑制或杀灭作用。果园混种大葱减少了以尖孢镰刀菌为主的有害真菌数量[8],桔梗根腐病的致病菌正是镰刀腐霉属真菌[26]。由此推测,桔梗大葱间作降低真菌数量,主要是降低了镰刀腐霉属真菌的数量,有利于缓解桔梗连作障碍。
进一步分析桔梗大葱间作土壤真菌数量变化有以下原因:第一,每种植物的根系分泌物各有其特点,桔梗大葱间作增加了根系分泌物的种类,而且葱的根系分泌物能抑制土壤有害真菌,降低土壤真菌数量;第二,本研究用地是桔梗已连作3年的地块而且试验持续4年,即桔梗连续种植7年。桔梗连作形成了特定的土壤环境,微生物种类与数量已发生改变,即细菌和放线菌数量下降,真菌数量剧增,这与以往的研究结果相同[1]。
土壤中细菌比例增加,是土壤质量改善的重要标志[27]。桔梗大葱间作土壤微生物总量 (表1) 和细菌数量显著高于桔梗单作,同时土壤有效氮和有效磷含量 (8月以前) 显著高于桔梗单作,表明土壤有效氮和有效磷含量与土壤细菌数量和微生物总量显著正相关 (图1)。Insam等[28]研究也发现土壤微生物数量与土壤有效养分含量正相关,土壤微生物数量的增加能增强土壤养分转化效率,提高土壤有效养分含量,这与本研究结果一致。
多酚氧化酶能分解土壤中酚类和有毒物质,具有修复土壤的功能,其活性与解毒能力密切相关[29]。Zhou等[30]研究发现,间作葱属植物显著提高土壤多酚氧化酶活性,改善土壤环境。桔梗大葱间作土壤多酚氧化酶活性高于桔梗单作,而且随桔梗大葱间作行比增加逐渐降低,说明间作大葱有利于改善桔梗根系生长的土壤环境。本研究还发现土壤多酚氧化酶活性最高时恰逢土壤放线菌数量最低,反之亦然。这意味着多酚氧化酶和放线菌共同维持土壤微生态平衡。
4 结论
桔梗大葱间作提高了土壤有效氮、有效磷含量,增加了土壤微生物总量和细菌数量,降低真菌数量,提高细菌/真菌比值,土壤细菌化明显,提高土壤肥力和土壤有效养分供给量;桔梗大葱间作还提高了土壤多酚氧化酶活性,有利于创建良好的土壤环境,是消减桔梗连作障碍的一种种植模式。
[1]祝丽香, 霍学慧, 孙洪信. 桔梗连作对土壤理化性状和生物学性状的影响[J]. 水土保持学报, 2013, 27(6): 177–182.Zhu L X, Huo X H, Sun H X, et al. Effects of continuous cropping of Platycodon grandiflorum on the soil physical-chemical properties and biological properties[J]. Journal of Soil and Water Conservation,2013, 27(6): 177–182.
[2]Hamel C, Vujanovic V, Jeannotte R, et al. Negative feedback on a perennial crop: Fusarium crown and root rot of asparagus is related to changes in soil microbial community structure[J]. Plant and Soil,2005, 268(1): 75–87.
[3]国辉, 毛志泉, 刘训理. 植物与微生物互作的研究进展[J]. 中国农学通报, 2011, 27(9): 28–33.Guo H, Mao Z Q, Liu X L. Research progress of interaction between plant and microorganism[J]. Chinese Agricultural Science Bulletin,2011, 27(9): 28–33.
[4]胡举伟, 朱文旭, 张会慧, 等. 桑树/大豆间作对植物生长及根际土壤微生物数量和酶活性的影响[J]. 应用生态学报, 2013, 24(5):1423–1427.Hu J W, Zhu W X, Zhang H H, et al. Effects of mulberry/soybean intercropping on the plant growth and rhizosphere soil microbial number and enzyme activities[J]. Chinese Journal Applied Ecology,2013, 24(5): 1423–1427.
[5]Kumari K, Mathew B C J, Augusti K T. Antidliabetic and hypolipidemic effects of S-methyl cysteine sulfoxide isolated from Allium cepa Linn.[J]. India Journal Biochemistry, 1995, 32(1):49–54.
[6]司民真, 李伦, 张川云, 等. 顶空及SERS结合快速检测葱属植物-大葱挥发物[J]. 激光生物学报, 2015, 24(4): 348–384.Si M Z, Li L, Zhang C Y, et al. Rapid detection of volatile organic compounds of green Chinese onion using headspace combined with SERS[J]. Acta Laser Biology Sinica, 2015, 24(4): 348–384.
[7]祝丽香, 张文静, 王鹏, 等. 桔梗间作模式中作物养分吸收和利用对间作优势的贡献[J]. 中国林副特产, 2016, 2(1): 5–9.Zhu L X, Zhang W J, Wang P, et al. Uptake and conversion efficiencies of NPK and corresponding contribution to intercropping advantage in platycodon grandiflorum based intercropping systems[J]. Forest By-Product and Speciality in China, 2016, 2(1):5–9.
[8]李家家, 相立, 潘凤兵, 等. 平邑甜茶幼苗与葱混作对苹果连作土壤环境的影响[J]. 园艺学报, 2016, 43(10): 1853–1862.Li J J, Xiang L, Pan F B, et al. Effects of Malus hupehensis seedlings and Allium fistulosum mixed cropping on replanted soil environment[J]. Acta Horticulturae Sinica, 2016, 43(10): 1853–1862.
[9]杨敏, 梅馨月, 廖静静, 等. 三种葱属作物挥发物和提取液对植物病原真菌和卵菌的抑菌活性[J]. 植物保护, 2013, 39(3): 36–44.Yang M, Mei X Y, Liao J J. Antimicrobial activity of volatiles and extracts of 3 Allium crops to plant pathogenic fungi and oomycetes[J]. Plant Protection, 2013, 39(3): 36–44.
[10]关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1982.168–171.Guang S Y. Soil enzyme and its research methods [M]. Beijing:Agriculture Press, 1982.168–171.
[11]许光辉, 郑洪云. 土壤微生物分析方法手册[M]. 北京: 农业出版社,1986. 102–110.Xu G H, Zheng H Y. Soil microorganism analysis method manual[M]. Beijing: Agriculture Press, 1986. 102–110.
[12]鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社,1999.Lu R K. Soil agricultural chemical analysis method [M]. Beijing:China Agricultural Science and Technology Press, 1999.
[13]Fan F, Zhang F, Lu Y. Linking plant identity and interspecific competition to soil nitrogen cycling through ammonia oxidizer communities[J]. Soil Biology & Biochemistry, 2011, 43(1): 46–54.
[14]王淑平, 周广胜, 孙长占, 等. 土壤微生物量氮的动态及其生物有效性研究[J]. 植物营养与肥料学报, 2003, 9(1): 87–90.Wang S P, Zhou G S, Sun C Z, et al. The dynamics of soil microbial biomass nitrogen and its biological availability[J]. Plant Nutrition and Fertilizer Science, 2003, 9(1): 87–90.
[15]王华, 王辉, 赵青云, 等. 槟榔不同株行距间作香草兰对土壤养分和微生物的影响[J]. 植物营养与肥料学报, 2013, 19(4): 988–994.Wang H, Wang H, Zhao Q Y, et al. Influence of different planting spacing of areca nut intercropping with Vanilla on soil microbes and nutrients[J]. Journal of Plant Nutrition and Fertilizer, 2013, 19(4):988–994.
[16]孙海国, 张福锁. 缺磷条件下的小麦根系酸性磷酸酶活性研究[J].应用生态学报, 2002, 13(3): 379–381.Sun H G, Zhang F S. Effect of phosphorus deficiency on activity of acid phosphatase exuded by wheat roots[J]. Chinese Journal of Applied Ecology, 2002, 13(3): 379–381.
[17]Fohse D, Claassen N, Jungk A. Phosphorus efficiency of plants[J].Plant and Soil, 1991, 132(2): 261–272.
[18]时安东, 李建伟, 袁玲. 轮间作系统对烤烟产量、品质和土壤养分的影响[J]. 植物营养与肥料学报, 2011, 17(2): 411–418.Shi A D, Li J W, Yuan L. Effects of rotation and intercropping systems on yield, quality of flue-cured tobacco and soil nutrients[J].Plant Nutrition and Fertilizer Science, 2011, 17(2): 411–418.
[19]Hao W Y, Ren L X, Ran W, et al. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp. niveum[J]. Plant and Soil, 2010, 336(1–2): 485–497.
[20]Janvier C, Villeneuve F, Alabouvette C, et al. Soil health through soil disease suppression: Which strategy from descriptors to indicators?[J]. Soil Biology & Biochemistry, 2007, 39(1): 12–23.
[21]Latz E, Eiisenhauer N, Ralll B C, et al. Plant diversity improves protection against soil-borne pathogens by fostering antagonistic bacterial communities[J]. Journal of Ecology, 2012, 100(3): 597–604.
[22]Wang M Z, Chen X N. Obstacle and countermeasure of sustainable high yield for peanut in low-hilly red soil region[J]. Journal of Peanut Science, 2005, 34(2): 17–22.
[23]Gao X, Wu M, Xu R N, et al. Root interactions in maize/soybean intercropping system control soybean soil-borne disease, red crown rot[J]. PLoS ONE, 2014, 9(5): e95031.
[24]时伟, 徐宁, 魏珉, 等. 大葱根系分泌物对黄瓜幼苗根际微生态环境的影响[J]. 山东农业科学, 2013, 45(12): 72–76.Shi W, Xu N, Wei M, et al. Effects of welsh onion root exudates on rhizosphere micro ecological environment of cucumber seedlings[J].Shandong Agricultural Science, 2013, 45(12): 72–76.
[25]张伟, 廖静静, 朱贵李, 等. 8种植物挥发物和浸提液对三七根腐病菌的抑制活性研究[J]. 中国农学通报, 2013, 29(30): 197–201.Zhang W, Liao J J, Zhu G L, et al. The study of inhibitory activity of eight plant volatiles and extracts to Panax notoginseng root rot pathogens[J]. Chinese Agricultural Science Bulletin, 2013, 29(30):197–201.
[26]吴悦明, 孙芙蓉, 徐玉芳, 等. 桔梗根腐病发病原因及防治措施研究[J]. 山东农业大学学报, 2008, 39(3): 424–428.Wu Y M, Sun F R, Xu Y F, et al. The pathogenic fungi and its control of root rot disease of balloon flower[J]. Journal of Shandong Agricultural University, 2008, 39(3): 424–428.
[27]徐瑞富, 任永信. 连作花生田土壤微生物群落动态与减产因素分析[J]. 农业系统科学与综合研究, 2003, 19(1): 33–38.Xue R F, Ren Y X. Effect of peanut continuous cropping on soil microbiological population[J]. System Science Comprehensive Studies in Agriculture, 2003, 19(1): 33–38.
[28]Insam H, Mitchell C C, Dormaar J F. Relationship of soil microbial biomass and activity with fertilization practice and crop yield of three Ultisols[J]. Soil Biology & Biochemistry, 1991, 23(5): 459–464.
[29]乔蓬蕾, 吴凤芝, 周新刚. 连作对作物根际土壤微生物菌群及酶活性影响[J]. 沈阳农业大学学报, 2013, 44(5): 524–530.Qiao P L, Wu F Z, Zhou X G. Effects of continuous cropping on soil microbe communities and enzyme activity[J]. Journal of Shenyang Agricultural University, 2013, 44(5): 524–530.
[30]Zhou X G, Yu G B, Wu F Z. Effects of intercropping cucumber with onion or garlic on soil enzyme activities, microbial communities and cucumber yield[J]. European Journal of Soil Biology, 2011, 47(5):279–287.
