烟叶成熟期氮代谢酶活性、基因表达与烤烟氮素利用效率的关系
2018-06-19周健飞武云杰徐世晓彭玉富杨铁钊
周健飞,武云杰,薛 刚,徐世晓,彭玉富,杨铁钊*
(1 河南农业大学烟草学院,郑州 450002;2 河南中烟工业有限责任公司技术中心,郑州 450000)
氮素是作物生长发育和品质形成的重要因素,氮代谢特性在不同基因型间存在差异[1]。我国目前植烟地区氮肥用量普遍偏多,如遭遇生育后期较多雨水,土壤中缓效氮和矿化氮释放量增加,使土壤中有效态氮素含量提高,背离“烟株长成肥退劲”的需肥规律。此外,造成不耐氮肥品种贪青晚熟,影响烟叶碳氮代谢转化,形成难以烘烤的“黑暴”烟叶,降低烤烟品质。因此,深入研究氮素利用生理生化机制,对于筛选和培育氮素适应范围广的烟草品种具有重要指导意义。
不同品种间氮效率差异主要围绕作物的叶绿素含量、根系活性和吸收面积以及硝酸还原酶活性等生理指标来研究[2–3]。分子生物学和遗传学研究结果表明,谷氨酰胺合成酶 (GS) 同工酶基因表达及其活性在植物的氮素转运和分配中具有重要作用,GS同工酶的相对比例可能是影响氮素利用效率的原因之一[4]。
高等植物的GS基于亚细胞定位不同可以分为两类,一类为多基因编码的GS1,定位于胞液中;另一类为一个核基因编码的GS2,存在于叶绿体中。GS1的功能是对叶片衰老时的氮源进行转移及再利用,而GS2主要对光呼吸、硝酸还原产生的氨进行同化[5]。目前对GS同工酶的研究逐渐成为改良作物氮代谢效率的热点。Hirel等利用层析技术对玉米叶片的GS同工酶进行分离纯化,发现功能叶中起主导作用的是GS2同工酶,且随着叶片的衰老GS2同工酶活性逐渐降低,而GS1同工酶活性逐渐增高[6]。Fei等通过对GS1-5转基因大豆的研究发现,超表达GS1-5的大豆促进了氮素的吸收与同化,且叶片的GS酶活性、干物质重量和氮含量均有提高[7]。Li等对266个中国小麦品种进行了单倍体分析,发现了TaGS2基因在小麦染色体上的定位,并发现了4个可以赋予小麦幼苗更好农艺性状和更好氮效率的单倍型,这也表明了GS2在氮素同化功能中的作用[8]。以上研究结果均说明,GS基因的表达对于植物氮素利用效率的调控具有重要作用。硝酸还原酶 (NR) 受诱导并将其转化为随后经亚硝酸还原酶转变为。赵小强等[10]通过转基因技术发现外源NR基因的超表达可以显著提高冬性小麦的籽粒重量和籽粒蛋白质含量。
大量研究结果集中于粮食作物中GS同工酶和NR等在转录水平和酶活性上的变化动态以及不同氮效率品种间的差异。但不同烤烟品种的氮代谢酶活性和基因表达差异及其与相关生理指标的联系,以及对氮效率的影响尚未见报道。本试验选用成熟期氮低效烤烟品种豫烟10号[11]、中等氮效率品种K326[12]和成熟期氮高效品种NC89[13]为试验材料,采用荧光定量PCR和质外体提取等方法,探索GS同工酶、NR基因表达丰度与相关生理指标的关系,进一步研究不同氮效率品种成熟期氮素代谢机制和分子机理,以期为筛选氮素适应范围广的烤烟品种提供理论依据。
1 材料与方法
1.1 试验设计
盆栽试验于2017年在河南农业大学科教园区进行。参试烤烟品种为豫烟10号、K326和NC89 (成熟期氮效率为 NC89 > K326 > 豫烟 10 号[11–13])。供试土壤为黄色壤土 (取自河南农业大学科教园区),pH值为7.82,有机质9.71 g/kg、全氮0.94 g/kg、速效氮69.25 mg/kg、有效磷26.83 mg/kg、速效钾95.67 mg/kg。盆栽采用聚乙烯塑料盆,内径为35 cm,高度30 cm,装土18.0 kg。每盆植烟1株,每个品种60盆,重复3次。每盆施用纯氮4 g,N∶P2O5∶K2O为1∶2∶3,常规水分管理。
在叶龄35、45、55、65、75 d (以幼叶长1 cm、宽0.5 cm时作为叶龄第1天) 取第12片叶 (自下向上数),用于测定烟叶氮代谢酶基因NtGS1、NtGS2和NtNit的表达丰度,同时测定叶片及质外体相关生理指标。
1.2 测定项目与方法
1.2.1 RNA提取及cDNA合成 将取回的新鲜烟叶样品用液氮研磨后,根据Trizol试剂盒 (Invitrogen) 使用说明书提取总RNA,用1.0%琼脂糖凝胶电泳检测其完整度。cDNA的合成采用PrimeScriptTMRT reagent Kit with gDNA Eraser进行 (TaKaRa公司)。
1.2.2 氮代谢酶qRT-PCR引物设计及过程引物 根据NCBI上已登录的相关基因运用Primer Premier 5.0软件进行设计 (表1),由Invitrogen Biotechnology Co., LTD公司合成,选择烟草beta-Actin作为内参基因。实时荧光定量PCR在Life technologies公司的StepOneTMReal-Time PCR仪上完成,每个样品均作3个复孔,使用SYBR® Premix Ex TaqTM试剂盒进行(TaKaRa公司)。反应参数:95℃ 60 s,1个循环 (预变性);95℃ 15 s,58℃ 20 s,72℃ 45 s,共 40 个循环,扩增结束后利用熔解曲线检测产物特异性,从60℃缓慢升温至95℃,每20 s升温1℃。10 μL反应体系包括2 × qPCR Mix 5 μL,引物工作液 (2.5 μmol/L) 1.0 μL,模板 1.0 μL,ddH2O 2.8 μL 和 Rox 0.2 μL。采用 2–ΔΔCT法分析基因的相对表达量。
1.2.3 酶活性测定 谷氨酰胺合成酶 (GS) 活性以1mg/min粗蛋白催化产生的γ-谷氨酰异羟肟酸数量来表示[14]。硝酸还原酶 (NR) 活性测定采用活体法进行[15]。
1.2.4 其他生理指标测定方法 叶片浓度采用改良的茚满三酮法测定,可溶性蛋白采用考马斯亮蓝G-250法测定,总氮含量采用凯氏定氮法测定[15]。质外体浓度和质外体pH测定参考文献[16]的方法。氨气补偿点的计算参考文献[17]的方法。叶片氨气挥发量采用武云杰等[18]的方法测定。
1.3 数据处理
用Excel 2016计算各测定指标的平均值和标准差,用IBM SPSS Statistics 22.0进行方差分析,对各处理差异进行LSD多重比较,最后进行相关性分析。
2 结果与分析
2.1 烤烟叶片氮代谢酶基因表达动态变化
由图1可知,NtGS1表达丰度在叶龄35 d时非常低,叶龄45 d始NtGS1表达丰度大幅上调,与35 d相比,NC89、K326和豫烟10号分别增加了5.47、4.52和2.53倍;在叶龄55 d时持续上调并达到最大值,随后该基因逐渐下调表达。NtGS1表达丰度变化趋势在品种间表现一致。说明烤烟中部叶在叶龄45 d时已完成生长发育而进入成熟阶段,GS1的基因被启动,氮运转进入分配再利用阶段,在叶龄75 d时烟叶已进入衰老晚期。3个参试品种在叶龄45 d、55 d和65 d时 NtGS1表达丰度差异均达极显著水平,顺序为 NC89 > K326 > 豫烟 10 号。
表 1 qRT-PCR所用引物Table 1 Primers for qRT-PCR

图 1 不同品种烤烟叶片NtGS1、NtGS2和NtNit基因表达丰度动态变化Fig. 1 Dynamic changes of gene expression of NtGS1, NtGS2 and NtNit of flue-cured tobacco leaves
NtGS2表达丰度在叶龄35 d时最高,45 d时大幅下调,降幅非常剧烈。叶龄45 d到75 d之间依然趋于下调表达,但是幅度较缓。叶龄45 d时NC89的NtGS2表达丰度分别为K326和豫烟10号的1.07倍和1.39倍。45~65 d始终表现为NC89 >K326 > 豫烟10号,且差异达到极显著水平。
NtNit表达丰度变化趋势和NtGS2相似,在叶龄35~45 d大幅下调表达,随后趋于平缓。不同氮效率品种35~65 d之间NtNit表达丰度均表现为NC89 > K326 > 豫烟 10 号,且 NC89 和豫烟 10 号差异始终达到极显著水平。
2.2 叶片氮代谢酶活性动态变化
由图2可知,GS活性在叶龄35 d最高,随后整体呈下降趋势。与NC89相比,豫烟10号和K326的GS活性下降非常剧烈。45 d时NC89、K326和豫烟10号分别下降18.8%、28.3%和62.5%。45~65 d始终表现为NC89 > K326 > 豫烟10号,且差异达到极显著水平。NR活性在叶龄35 d最高,随后呈现缓慢下降趋势。在叶龄35~65 d时各参试品种均表现为NC89 > K326 > 豫烟10号且品种间差异达到极显著水平。
2.3 叶片浓度、总氮和可溶性蛋白含量的动态变化
由图3可知,GS活性在叶龄35 d最高,随后整体呈下降趋势。与NC89相比,豫烟10号和K326的GS活性下降非常剧烈。45 d时NC89、K326和豫烟10号分别下降18.8%、28.3%和62.5%。45~65 d始终表现为NC89 > K326 > 豫烟10号,且差异达到极显著水平。NR活性在叶龄35 d最高,随后呈现缓慢下降趋势。在叶龄35~65 d时各参试品种均表现为NC89 > K326 > 豫烟10号且品种间差异达到极显著水平。
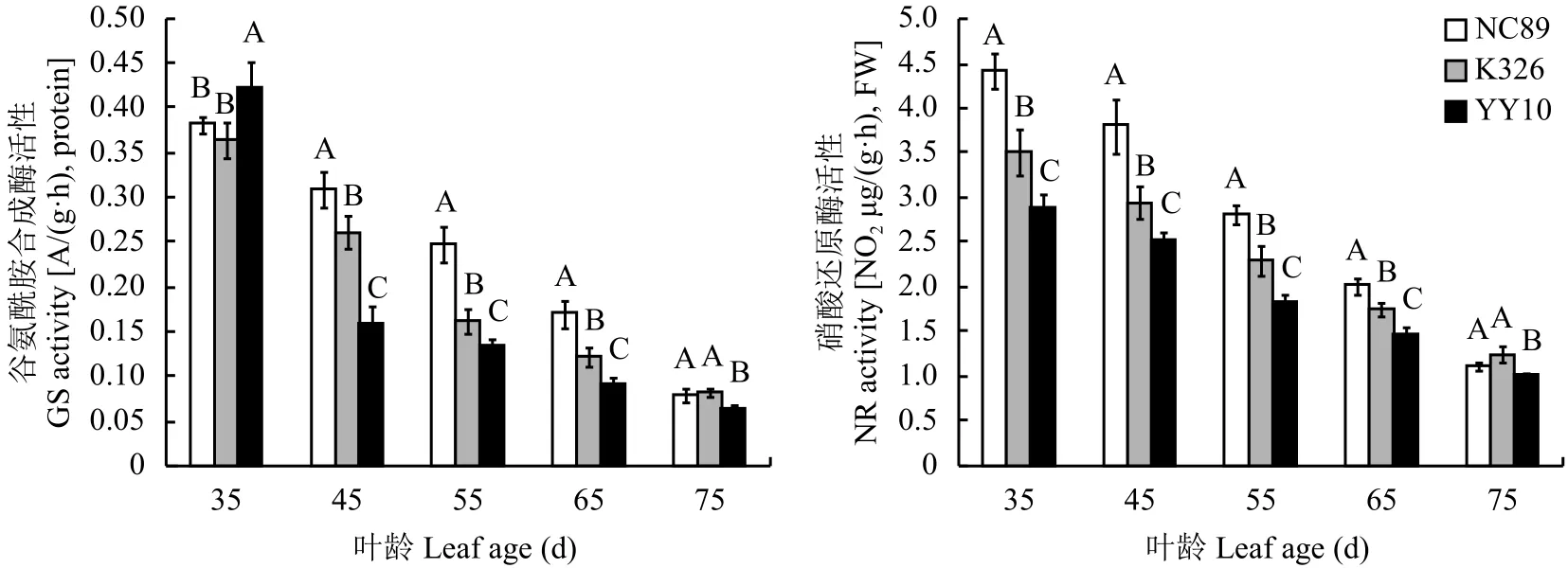
图 2 不同品种烤烟叶片氮代谢酶活性动态变化Fig. 2 Dynamic changes of enzyme activities related to nitrogen metabolism of flue-cured tobacco leaves
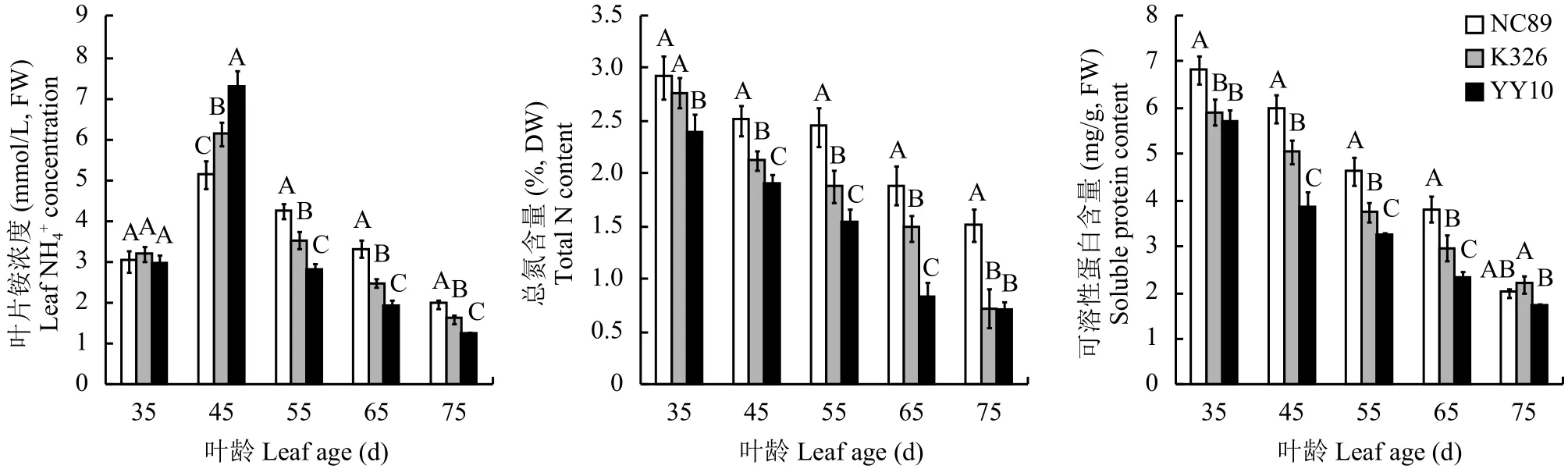
图 3 不同品种烤烟叶片浓度、总氮和可溶性蛋白含量的变化动态Fig. 3 Dynamic changes of the contents of total nitrogen and soluble protein of flue-cured tobacco leaves
烟叶总氮含量可以体现叶片总体的氮素水平。叶片总氮含量表现出持续下降的趋势。35 d时各品种之间差异不大, 45~65 d均表现为NC89 > K326 >豫烟10号,差异达到极显著水平。叶龄65 d时豫烟10号总氮含量仅为0.81%,NC89和K326的总氮含量分别是其2.33倍和2.09倍。可溶性蛋白的变化趋势和总氮相似,但是下降幅度较缓。
2.4 叶片质外体相关生理指标和氨气挥发量的动态变化
质外体的NH4+是叶片氨气挥发的重要来源,质外体pH值越高越有利于氨气挥发[19]。由图4可以看出,质外体NH4+浓度和质外体pH均呈现先升高后降低的趋势,质外体NH4+浓度于55 d达到最高点,随后大幅下降,在45~65 d间始终表现为豫烟10号 > K326 > NC89,其中豫烟10号增长幅度非常大。质外体pH在45 d达到最大值,随后开始下降。45~65 d豫烟10号质外体pH始终大于NC89和K326,差异达到极显著水平。
氨气补偿点由质外体NH4+浓度和质外体pH计算而来[16],在叶龄35 d时较低,于45 d达到最大值,豫烟10号、K326和NC89的升高幅度分别为128.8%、44.4%和24.7%,三者差异达到极显著水平。随后尽管豫烟10号有较大的下降幅度,但依然显著高于K326和NC89。由烟草叶片氨气挥发收集装置测得的氨气实际挥发量变化趋势和上述三个指标基本相同, 且品种间变化趋势一致。各品种均于叶龄55 d达到最大值,与质外体NH4+浓度变化一致,豫烟10号、K326和NC89分别为24.91、14.98和6.85 μg/(m2·h),三个品种在叶龄 45 d 后差异均达到极显著水平。
2.5 烟叶成熟期氮代谢酶的基因表达丰度与生理指标的相关性分析
由相关性分析 (表2) 可知,GS1的基因表达丰度与叶片总氮、叶片铵浓度、质外体铵浓度以及氨气挥发量呈极显著负相关,与NR活性、质外体pH呈显著负相关,而与GS活性和可溶性蛋白含量相关性不显著。GS2的基因表达丰度与GS活性、总氮、可溶性蛋白含量和质外体pH呈极显著正相关,与NR活性、叶片铵浓度呈显著正相关,而与质外体铵浓度和氨气挥发量呈显著负相关。NR的基因表达丰度仅和NR活性呈极显著正相关,且相关性较强,与总氮、可溶性蛋白含量、叶片铵浓度呈显著正相关,与氨气挥发量呈显著负相关,与其它生理指标没有相关性。说明成熟期烟叶氮素运筹主要受GS同工酶基因表达丰度的影响,且可能由于GS2同工酶所占比例较高[20],其在叶片衰老过程中的大量降解导致了GS总活性的下降。NR的基因表达丰度对成熟期氮效率虽有一定影响,但是作用较小,不是氮素调控网络的核心。
3 讨论
成熟期是烤烟叶片品质形成的关键时期,氮代谢只有适时向碳代谢转化才能形成符合工业要求的优质烟叶[21]。与粮食作物不同,烤烟现蕾打顶之后,原有的源库关系发生改变,生长重心转移到保留的叶片的生长发育上来[22]。叶位偏下、叶龄较大的烟叶仍然是“源”,而叶位偏上或未完全成熟的烟叶成为新的“库”。理想的烤烟养分吸收模式要求成熟期具有较低的氮素同化效率。衰老叶片降解的氮素既可以转移到其它叶片中进行再利用,亦可以通过质外体以氨气的形式挥发出去[18],不同氮效率品种这两部分所占比重不同。近年来大量研究结果表明不同源库器官GS同工酶的相对含量可能是造成这种差异的重要原因之一[23]。

图 4 不同品种烤烟叶片质外体浓度、质外体pH、氨气补偿点和氨气挥发量的变化动态Fig. 4 Dynamic changes of apoplastic concentration, pH, NH3 compensation point and NH3 volatilization of flue-cured tobacco leaves
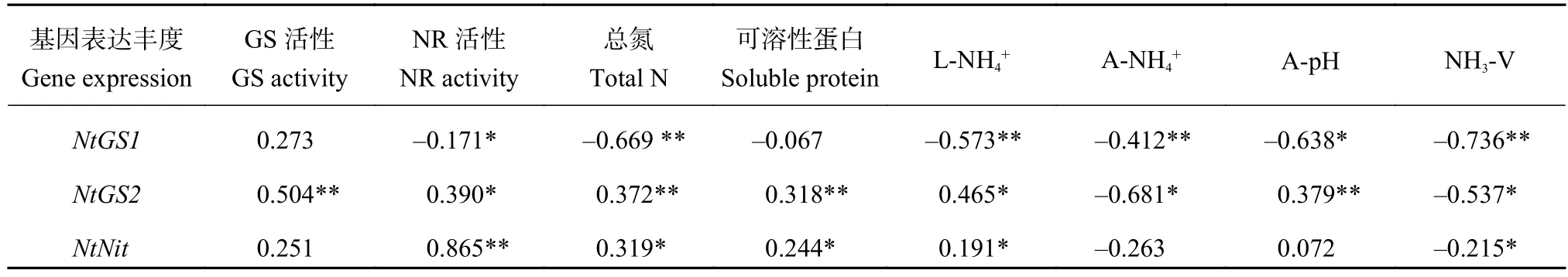
表 2 烟叶成熟期氮代谢酶的基因表达丰度与生理指标的相关性分析Table 2 Correlation analysis of gene expression abundance in nitrogen metabolism and physiological indexes of leaves at maturing stage
GS同工酶GS1主要定位于细胞液中,其在叶片衰老时期的功能主要是降解氮素的转移再利用[24–25]。在本研究中,各品种编码叶片GS1同工酶的NtGS1基因在进入衰老之后表达丰度均明显升高。成熟期氮低效烤烟品种相对于氮高效品种而言,NtGS1基因具有较低的表达丰度,因此降解氮素向“库”转移的能力相对较弱,表现为氮低效品种叶片具有较低的总氮和可溶性蛋白等含量。这与其他作物研究结果较为一致。Brauer等[26]通过在水稻中超表达GS1基因后发现,超表达的品系氮素收获指数更高,GS1改变了籽粒灌浆期的氮素分配。付捷等[27]研究发现,氮利用高效小麦品种在籽粒形成时期具有较高的GS1基因表达丰度,可能是其具有较高氮素重新利用能力的重要原因之一。
编码起同化作用的GS2同工酶的基因NtGS2在衰老启动时表达量就剧烈降低。成熟期氮低效品种的NtGS2表达丰度更是低于氮高效品种,表现为成熟期各阶段GS活性均较低,最终导致叶片降解的氮素再同化量较少。在植物体内过量积累将产生毒害作用,而本研究中叶片浓度在叶龄45 d之后持续下降,质外体浓度积累高峰比叶片晚10 d左右,且氨气挥发量在成熟期大量增加,说明向质外体转移可能是一种缓解氨害积累的生理机制。同时成熟期氮低效品种具有相对较高的质外体pH, 有利于形成氨气挥发出去,从而实现自身的氮素调亏。氮高效品种在成熟期具有相对较高的GS1同工酶和GS2同工酶的基因表达丰度。从“源库流”理论解释,较高的氮素同化效率造成了氮同化物在“源”的富集,为成熟期烟株的代谢提供了丰富的底物,“源”压力较大,同时由于其GS1基因表达丰度高,转运效率高,衰老降解的氮素被大量再利用,向质外体转移量较少。源库之间的压力差和质外体生理上的差异综合导致了不同基因型烤烟成熟期氮素利用效率的差异。
Nit基因与硝酸还原酶活性变化趋势相同,硝酸还原酶是植物硝酸盐同化中的限速酶和调节酶[9]。成熟期氮低效品种具有较低的NR活性主要是由于其基因转录活性较低,导致硝酸盐同化能力弱于氮高效品种。整体而言,NR酶活性变化趋势在不同氮效率品种间表现和GS基本相似,但是和氮代谢生理指标相关性极弱,甚至没有相关性。可能由于NR酶活性在烟叶成熟期氮同化过程中起不到氮代谢中枢的作用,只为GS/GOGAT循环提供代谢底物,而氮代谢底物一般不构成限制氮素利用的主要瓶颈[28]。
综上所述,从GS同工酶的生理功能出发,推测不同烤烟品种GS同工酶的基因表达丰度差异可能导致成熟期氮高效品种源库间的“源库强差”高于氮低效品种,碳氮代谢物在源库间转运效率较高,更多的氮素被转运到库中进行储存。相关性分析也表明,成熟期不同氮效率烤烟品种叶片质外体生理指标及氨气挥发量与GS同工酶基因表达丰度呈显著或极显著的相关性,说明GS同工酶基因表达丰度的差异是不同基因型间具有不同成熟期氮效率的主要原因之一。
最新研究表明,GS同工酶活性的调控在RNA转录、蛋白质翻译及翻译后修饰等不同水平上实现[29–30]。王小纯等[31]通过对小麦GS同工酶的研究,发现GS同工酶上有氧化、乙酰化、磷酸化等多个翻译后修饰作用位点,本文的研究尚未对不同成熟期氮效率品种的GS同工酶翻译后修饰位点进行对比。此外,某些转录因子也可以对GS的基因表达丰度造成影响,如TaDof1转录因子活性的提高可以延长生育后期小麦GS活性,从而提高小麦籽粒中蛋白质的含量[32]。有关不同成熟期氮效率烤烟品种根系铵态氮和硝态氮转运蛋白活性的对比也尚未见报道。氮素利用效率是作物的一个复杂的数量性状,还需要其他调控的参与,如外界环境条件、激素调控等,这些都是下一步研究工作的方向和重点。
4 结论
研究了不同氮效率烤烟品种成熟期的氮代谢酶活性、基因表达以及叶片和质外体生理指标的差异。结果表明,氮低效烤烟品种成熟期GS同工酶和NR的基因表达丰度均较低,氮素营养物质降解速度快且转移再利用能力弱,向质外体转移能力强,从而以氨气大量挥发的形式实现氮素调亏;而氮高效品种与其恰好相反。相关性分析表明,叶片GS酶转录活性最终决定了不同烤烟品种的氮素代谢能力和衰老特性。本研究对于解释烤烟品种氮代谢差异和大田合理施肥具有一定的指导意义,同时对于成熟期氮低效品种的选育和新品种氮效率的预测也具有重要作用。
[1]严小龙, 张福锁. 植物营养遗传[M]. 北京: 中国农业出版社, 1997,78–106.Yan X L, Zhang F S. Genetics of plant nutrition[M]. Beijing: China Agriculture Press, 1997, 78–106.
[2]杨铁钊, 林彩丽, 丁永乐, 等. 不同基因型烟草对氮素营养响应的差异研究[J]. 烟草科技, 2001, (6): 32–35.Yang T Z, Lin C X, Ding Y L, et al. Study on response of different tobacco genotypes to nitrogen nutrition[J]. Tobacco Science and Technology, 2001, (6): 32–35.
[3]梁景霞, 梁康迳, 林文雄, 等. 烟草氮素营养的基因型差异初探[J].中国烟草学报, 2007, 13(6): 36–40.Liang J X, Liang K J, Lin W X, et al. Primary study of genotypic differences in nitrogen nutrition in tobacco germplasms[J]. Acta Tabacaria Sinica, 2007, 13(6): 36–40.
[4]Purcino A A C, Lima T R, Pinto A C, et al. Glutamine synthetase response to nitrate in maize genotypes of contrasting nitrogen use efficiency[J]. Maydica, 2008, 53(2): 101–109.
[5]邓扬悟. 甜瓜谷氨酰胺合成酶基因的克隆和功能研究[D]. 上海:上海交通大学博士学位论文, 2010.Deng Y W. Cloning and characterization of glutamine synthetase genes in melon[D]. Shanghai: PhD Dissertation of Shanghai Jiaotong University, 2010.
[6]Hirel B, Andrieu B, Renard S, et al. Physiology of maize II:Identification of physiological markers representative of the nitrogen status of maize (Zea mays) leaves during grain filling[J]. Physiologia Plantarum, 2005, 124(2): 178–188.
[7]Fei H, Chaillou S, Hirel B, et al. Effects of the overexpression of a soybean cytosolic glutamine synthetase gene (GS15) linked to organspecific promoters on growth and nitrogen accumulation of pea plants supplied with ammonium[J]. Plant Physiology and Biochemistry,2006, 44(10): 543–550.
[8]Li X P, Zhao X Q, He X, et al. Haplotype analysis of the genes encoding glutamine synthetase plastic isoforms and their association with nitrogen-use- and yield-related traits in bread wheat[J]. New Phytologist, 2011, 189(2): 449–458.
[9]田华, 段美洋, 王兰. 植物硝酸还原酶功能的研究进展[J]. 中国农学通报, 2009, 25(10): 96–99.Tian H, Duan M Y, Wang L. Research progress of plant nitrate reductase function[J]. Chinese Agricultural Science Bulletin, 2009,25(10): 96–99.
[10]赵小强. 在小麦中引入和表达外源硝酸还原酶基因的研究[D]. 北京: 中国农业大学博士学位论文, 2014.Zhao X Q. Introduction and expression of exogenous nitrate reductase genes in wheat [D]. Beijing: PhD Dissertation of China Agricultural University, 2014.
[11]崔昌范, 王书凯, 宋立君. 烤烟新品种K326和NC89特征特性及配套栽培技术规范[J]. 延边大学农学学报, 1999, (1): 70–75.Cui C F, Wang S K, Song L J. Characteristics of flue-cured tobacco new varieties K326 and NC89 and their cultivation techniques[J].Journal of Yanbian University, 1999, (1): 70–75.
[12]杨铁钊, 张小全, 殷全玉, 等. 烤烟新品种豫烟10号的选育及特征特性[J]. 中国烟草学报, 2015, 21(3): 48–56.Yang T Z, Zhang X Q, Yin Q Y, et al. Breeding and characteristics of a new flue-cured tobacco variety Yuyan 10[J]. Acta Tabacaria Sinica,2015, 21(3): 48–56.
[13]武云杰, 李飞, 杨铁钊,等. 氮素营养水平对衰老期烟叶氮代谢的影响及品种间差异[J]. 中国烟草学报, 2014, (4): 41–47.Wu Y J, Li F, Yang T Z, et al. Effects of nitrogen nutrition on nitrogen metabolism in flue-cured tobacco leaves and differences among varieties[J]. Acta Tabacaria Sinica, 2014, (4): 41–47.
[14]O’Neal D, Joyk W. Glutamine synthetase of pea leaves. I.Purification, stabilization, and pH optima[J]. Archives of Biochemistry and Biophysics, 1973, 159: 113–122.
[15]邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000.56–129.Zou Q. The guidance of plant physiology experiment[M]. Beijing:China Agriculture Press, 2000. 56–129.
[16]段旺军, 杨铁钊, 刘化冰, 等. 烟叶氨气补偿点的品种间差异及其与氮素代谢的关系研究[J]. 植物营养与肥料学报, 2011, 17(2):149–158.Duan W J, Yang T Z, Liu H B, et al. Differences in NH3compensation point among tobacco (Nicotiana tabacum L.) cultivars and its relationship with nitrogen metabolism[J]. Plant Nutrition and Fertilizer Science, 2011, 17(2): 149–158.
[17]武云杰, 张小全, 段旺军, 等. 烤烟叶片衰老期氨气挥发特征及其生理调控研究[J]. 西北植物学报, 2012, 32(9): 2082–2088.Wu Y J, Zhang X Q, Duan W J, et al. Ammonia volatilization characteristics and its physiological regulation in flue-cured tobacco leaves during senescence[J]. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(9): 2082–2088.
[18]武云杰, 杨铁钊, 张小全, 等. 不同烤烟品种烟叶衰老期氨气挥发及其与氮素代谢的相关性[J]. 中国农业科学, 2013, 46(19):4027–4034.Wu Y J, Yang T Z, Zhang X Q, et al. Study on correlation between ammonia volatilization and nitrogen metabolism during the tobacco leaves senescence[J]. Scientia Agricultura Sinica, 2013, 46(19):4027–4034.
[19]Nielsen K H, Schjoerring J K. Regulation of apoplasticconcentration in leaves of oilseed rape[J]. Plant Physiology, 1998,118: 1361–1368.
[20]王小纯, 安帅, 熊淑萍, 等. 小麦叶片谷氨酰胺合成酶的分离纯化及鉴定[J]. 麦类作物学报, 2010, 30(1): 83–86.Wang X C, An S, Xiong S P, et al. Isolation, purification and identification of glutamine synthetase from wheat leaves[J]. Journal of Triticeae Crops, 2010, 30(1): 83–86.
[21]史宏志, 韩锦峰. 烤烟碳氮代谢几个问题的探讨[J]. 烟草科技,1998, (2): 34–36.Shi H Z, Han J F. Discussion on several problems about carbon and nitrogen metabolism in flue-cured tobacco[J]. Tobacco Science and Technology, 1998, (2): 34–36.
[22]陈永明, 邓海滨, 杨键. 不同打顶方法对烤烟生长及产量品质影响的研究[C]. 中国烟草学会2005年年会, 2005.Cheng Y M, Deng H B, Yang J. Study of effects on various methods of decapitation on growth, yield and quality of flue-cured tobacco[C].Chinese Tobacco Society Annual Meeting in 2005, 2005.
[23]王云华, 欧吉权, 王志强, 等. 黄瓜(Cucumis sativus L.)子叶发育过程中谷氨酰胺合成酶同工酶的变化[J]. 武汉大学学报(理学版),2005, 51(4): 517–520.Wang Y H, Ou J Q, Wang Z Q, et al. Changes of glutamine synthetase isozymes during the development of cucumber cotyledons[J]. Journal of Wuhan University (Science Edition), 2005,51(4): 517–520.
[24]Harrison J, Hirel B. Does lowering glutamine synthetase activity in nodules modify nitrogen metabolism and growth of lotus japonicas[J]. Plant Physiology, 2003, 133(1): 253–262.
[25]Cren M, Hirel B. Glutamine synthetase in higher plants: regulation of gene and protein expression from the organ to the cell[J]. Plant Cell Physiology, 1999, 40(12): 1187–1193.
[26]Brauer E K, Rochon A, Bi Y M, et al. Reappraisal of nitrogen use efficiency in rice overexpressing glutamine synthetase1[J].Physiologia Plantarum, 2011, 141(4): 361–372.
[27]付捷. 不同小麦品种氮效率差异及其机理初探[D]. 陕西杨凌: 西北农林科技大学硕士学位论文, 2014.Fu J. Physiological and molecular mechanism of difference of nitrogen use efficiency among winter wheat genotypes[D]. Yangling,Shaanxi: MS Thesis of Northwest A&F University, 2014.
[28]Cao C L, Li S X. Effect of nitrogen level on the photosynthetic rate,NR activity and the contents of nucleic acid of wheat leaf in the stage of reproduction[J]. Chinese Bulletin of Botany, 2003, 20(3):319–324.
[29]Rueda-López M, Crespillo R, Cánovas F M, et al. Differential regulation of two glutamine synthetase genes by a single of transcription factor[J]. The Plant Journal, 2008, 56: 73–85.
[30]Stanulović V S, Lovillo R M G D V, Labruyère W T, et al. The 3′-UTR of the glutamine-synthetase gene interacts specifically with upstream regulatory elements, contains mRNA-instability elements and is involved in glutamine sensing[J]. Biochimie, 2006, 88(9):1255–1264.
[31]Wang X, Wei Y, Shi L, et al. New isoforms and assembly of glutamine synthetase in the leaf of wheat (Triticum aestivum L.)[J].Journal of Experimental Botany, 2015, 66(21): 6827–6834.
[32]Kumar R, Taware R, Gaur V S, et al. Influence of nitrogen on the expression of TaDof1transcription factor in wheat and its relationship with photo synthetic and ammonium assimilating efficiency[J].Molecular Biology Reports, 2009, 36(8): 2209.
