低温胁迫下植物生长调节剂对玉米苗期光合及主要生理特性的影响
2018-06-19周雅卓梁烜赫郑大浩曹铁华
周雅卓, 赵 鑫, 梁烜赫, 郑大浩*, 曹铁华*
(1. 延边大学农学院,吉林 延吉 133002;2. 吉林省农业科学院,吉林 长春 130124)
春季低温冷害不仅是我国东北地区常见的气象灾害,也是制约东北春玉米保苗稳产的主要风险因子[1]。20世纪50~80年代,东北地区发生了8次较强的低温冷害,导致作物大面积减产[2]。进入21世纪以来,随着全球气候变暖,我国低温冷害事件的发生频率有所降低,但在吉林省东部部分地区,由低温冷害导致的作物延迟型、障碍型冷害仍时有发生。
化学调控作为调节作物生理生化过程的重要手段,也被广泛用于作物低温冷害的预防。前人在不同作物上所做的研究表明,在苗期叶片上喷施聚糠奈(PKN)、多效唑(MET)和矮壮素(CCC)等植物生长调节剂具有提高植物抗寒性的作用[3-9],但3者的作用机理却不尽相同。陈传晓等[5]和高娇等[6]的研究表明,PKN水剂主要通过其中含有的细胞分裂素,提高叶片中与光合作用相关的酶(RuBP羧化酶和PEP羧化酶)以及根系中硝酸还原酶等一系列酶的活性,促进光合效率和干物质积累,提高植物抗寒性。而MET[7]和CCC[4]则主要通过抑制细胞伸长、提高植物细胞液的浓度,使叶色变绿、茎秆变粗变矮,最终提高植物的耐寒能力。虽然PKN、MET和CCC在不同植物上的耐冷机理已有研究和报道,但这3种不同的生长调节剂在同一种植物上的效果有何差异,还有待阐明。
通常植物在低温胁迫条件下,光合系统电子传递活性会降低,引起植物光猝灭激发能力及能量捕获能力下降,造成能量过剩和过氧化损伤[10-11]。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)是植物细胞内广泛存在的重要抗氧化酶,在防御活性氧伤害[12-13]和清除体内过氧化物[14]等方面具有重要的功能;这些抗氧化酶活性的高低,可直接反映植物受到过氧化损伤的程度[15-17]。丙二醛(MDA)是膜脂过氧化产物,其含量的高低反映出膜脂的过氧化程度[12],是反映细胞膜通透性和离子交换能力的重要指标。
本试验利用人工气候室,依据计算机模拟的低温日变化曲线,在低温胁迫下对不同的植物生长调节剂对叶片叶绿素荧光参数、抗氧化酶活性及MDA积累的影响进行了比较研究,了解不同的生长调节剂对玉米苗期低温胁迫的缓解效果,以期为筛选和研发有利于提高玉米耐冷性的植物生长调节剂提供参考。
1 材料与方法
1.1 材料
本试验所用玉米为晚熟玉米杂交种“富民985”(审定编号:吉审玉20176001)。于2017年5月9日播种,穴播3粒,出苗后每盆保苗1棵。
1.2 盆栽、植物生长调节剂与低温处理
本试验利用吉林省农业科学院人工气候室(公主岭),模拟低温冷害气候,对苗期玉米进行低温处理。2017年5月9日,挑选籽粒饱满的“富民985”种子,在室外网室中,播种于盆土中(直径30 cm,高度50 cm),每盆播种3粒,共60盆;出苗后,每盆保苗生长健壮的幼苗1株。待玉米幼苗生长至3叶1芯时,早上10点,分别用清水(对照)、5%聚糠奈(PKN)、0.15%多效唑(MET)和0.65%矮壮素(CCC)均匀喷洒在玉米叶片上,每种处理5盆,3次重复;处理后第4天早10点,将玉米苗盆搬入模拟日平均为10 ℃的逐时气温变化的人工气候室中,连续低温处理5 d。低温处理结束后,将玉米苗盆从人工气候室搬至露天网室中。人工气候室设置的处理温度昼夜变化见图1。
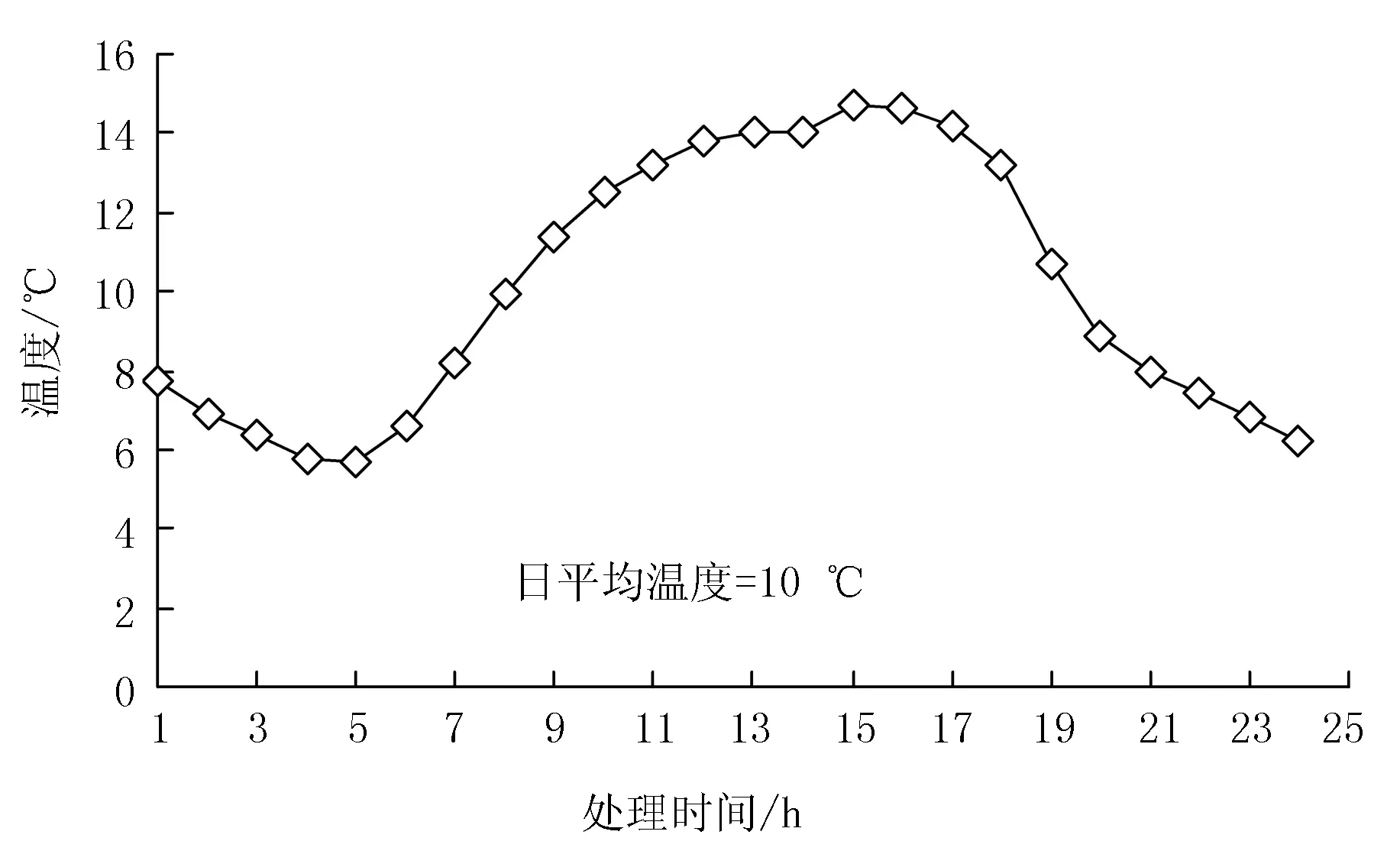
图1 人工气候室内处理温度昼夜变化曲线
1.3 叶绿素荧光参数及叶绿素值的测定
锚定植株第2和第3片真叶,利用英国Handy PEA植物效率分析仪,暗适应20 min后,测定初始荧光F0,最大荧光Fm及可变荧光Fv。光系统II(PSII)的最大光能转化效率(Fv/Fm)和潜在活性(Fv/F0)由仪器自动输出;利用日本产SPAD-502 叶绿素测定仪,测定叶绿素值(SPAD值)[18-21]。每次重复(3株)测定3次。
1.4 玉米叶片取样与生理指标的测定
1.4.1 叶片取样
在低温处理前1 d,低温处理第1、3和5天,低温处理结束后第1和3天,分别截取完全展开的第1片真叶,用蒸馏水擦净表面污物后,将叶片剪碎、混合均匀,放入-80 ℃冰箱中保存。
1.4.2 超氧化物歧化酶(SOD)活性测定
采用总超氧化物歧化酶(T-SOD)测试盒(羟胺法)进行测定[22]。其计算公式为:

1.4.3 过氧化物酶(POD)活性测定
采用过氧化物酶(POD)测试盒进行测定[23]。其计算公式为:

1.4.4 过氧化氢酶(CAT)含量测定
采用过氧化氢酶(CAT)测试盒进行测定[24]。其计算公式为:
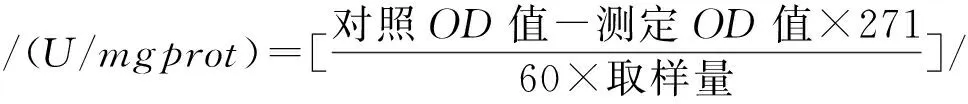
1.4.5 丙二醛(MDA)含量测定
采用丙二醛(MDA)测试盒(TBA法)进行测定[25]。其计算公式为:

1.5 数据处理
用 SAS 8.1 和Excel软件进行数据分析;采用L.S.D.法进行多重比较。
2 结果与分析
2.1 低温胁迫下不同植物生长调节剂对玉米苗期叶片叶绿素荧光参数的影响
叶绿素荧光参数Fv/F0值和Fv/Fm值分别用于衡量玉米叶片光系统II(PSII)的潜在活性和最大光能转换效率,是反映作物光合系统受到抑制和逆境胁迫程度的重要指标。由图2可知,喷施聚糠奈(PKN)、多效唑(MET)和矮壮素(CCC)等3种不同植物生长调节剂后,与对照(清水处理)一样,玉米叶片的Fv/F0值和Fv/Fm值随低温处理时间的延长,均呈持续下降趋势;而在低温处理结束后,随时间的推迟,Fv/F0值和Fv/Fm值逐渐得到恢复。但与对照(清水处理)相比,喷施PKN、MET和CCC后,在低温处理第5天时,玉米叶片的Fv/F0值分别比对照高7.7%、16.7%和4.2%,而Fv/Fm值分别比对照高2.3%,5.0%和1.2%;在低温处理结束后的第3天,玉米叶片的Fv/F0值分别比对照高16.2%、22.1%和11.2%,而Fv/Fm值分别比对照高4.9%,6.5%和3.8%。说明喷施PKN、MET和CCC等植物生长调节剂能够有效减轻低温对玉米叶片光合系统的抑制;在解除低温抑制后,叶片光合系统的各参数比对照更快地得到恢复。相对而言,MET的效果明显优于PKN和CCC;喷施PKN和CCC后的玉米在低温处理期间和低温处理结束后,叶片的Fv/F0值和Fv/Fm值存在一定交叉浮动,但喷施PKN的玉米叶片在低温处理结束后第3天时,其Fv/F0值和Fv/Fm值均高于喷施CCC的叶片,可能意味着喷施PKN玉米叶片光合系统的恢复略好于喷施CCC。
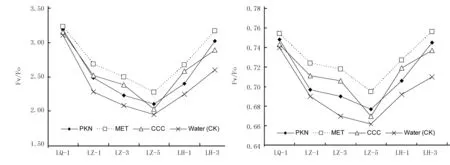
注:Fv/F0和Fv/Fm分别指光系统II的潜在活性和最大光化学量子产率;LQ-1表示低温处理前1 d;LZ-1、LZ-3和LZ-5表示低温处理第1天、第3天和第5天;LH-1和LH-3表示低温处理结束后第1和3天,下同。
图2喷施不同植物生长调节剂对苗期玉米叶片Fv/F0和Fv/Fm的影响
Fig.2EffectsofsprayingdifferentplantgrowthregulatorsonFv/F0andFv/Fmofmaizeseedlingleaves
2.2 低温胁迫下不同植物生长调节剂对玉米苗期叶片叶绿素值(SPAD)的影响
叶绿素值(SPAD)反映玉米叶片中叶绿素含量水平,直观地表现为叶片绿色深浅。与叶绿素荧光参数类似,玉米叶片的SPAD随低温处理时间的延长均呈现持续下降趋势;而在处理结束后,随着时间的推迟SPAD值逐渐得到恢复(图3)。
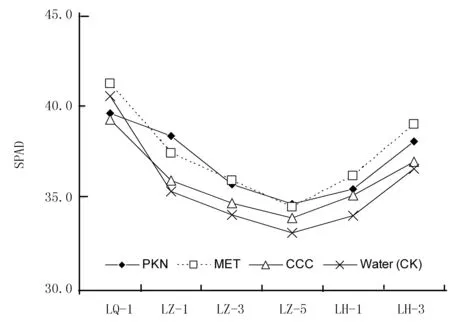
图3 喷施不同植物生长调节剂对玉米苗期叶片叶绿素值(SPAD)的影响
由图3可知,喷施聚糠奈(PKN)、多效唑(MET)和矮壮素(CCC)后,在低温处理期间和低温处理结束后,玉米叶片的SPAD值均高于对照(清水处理)。喷施PKN、MET和CCC的玉米叶片,在低温处理的第5天时,SPAD分别比对照高5.8%、2.0%和4.7%;低温处理结束后的第3天时,SPAD值分别比对照高5.9%、4.5%和3.9%。说明喷施PKN、MET和CCC等植物生长调节剂都能减缓低温造成的SPAD值降低,有效缓解玉米叶片失绿程度。相对而言,PKN和MET效果相近,但MET的效果略好于PKN;而CCC的效果则不如MET和PKN。
2.3 低温胁迫下植物生长调节剂对玉米苗期叶片不同抗氧化酶活性及MDA含量的影响
SOD、POD和CAT是生物体内存在的非常重要的保护酶。由图4可知,SOD、CAT和SOD的酶活性,均随着低温处理时间的延长而逐渐下降;到低温处理第5天时,SOD和CAT的酶活性下降,比POD更加剧烈;低温处理结束后,又逐渐回升。与抗氧化酶酶活性的变化相反,随着低温处理时间的延长,MDA含量急剧上升;而低温处理结束后,MDA含量则迅速下降。与低温处理前1天相比,到低温处理第5天时,对照的SOD、CAT和POD的酶活性值分别降低了84.8%、94.3%和38.7%;而低温处理前喷施PKN、MET和CCC的玉米叶片的SOD、CAT和POD的酶活性值分别降低了67.6%~75.2%、73.2%~91.2%和31.8%~34.8%。到低温处理结束后第3天时,对照的SOD、CAT和POD的酶活性值分别升高了228.3%、475.0%和19.2%;而喷施PKN、MET和CCC的玉米叶片,其SOD酶活性值分别升高了88.5%~123.5%、CAT酶活性值分别升高了200.0%~500.0%,POD酶活性值分别升高了15.3%~19.5%。
对于玉米叶片中的MDA含量来讲,与低温处理前相比,到低温处理第5天时,对照中MDA含量升高了572.2%,喷施PKN、MET和CCC的玉米叶片中MDA含量升高了447.4%~572.2%。低温处理结束后第3天时,与低温处理第5天相比,对照中MDA含量减少了44.8%,而喷施PKN、MET和CCC的玉米叶片中,MDA含量则减少了63.6%~76.0%。
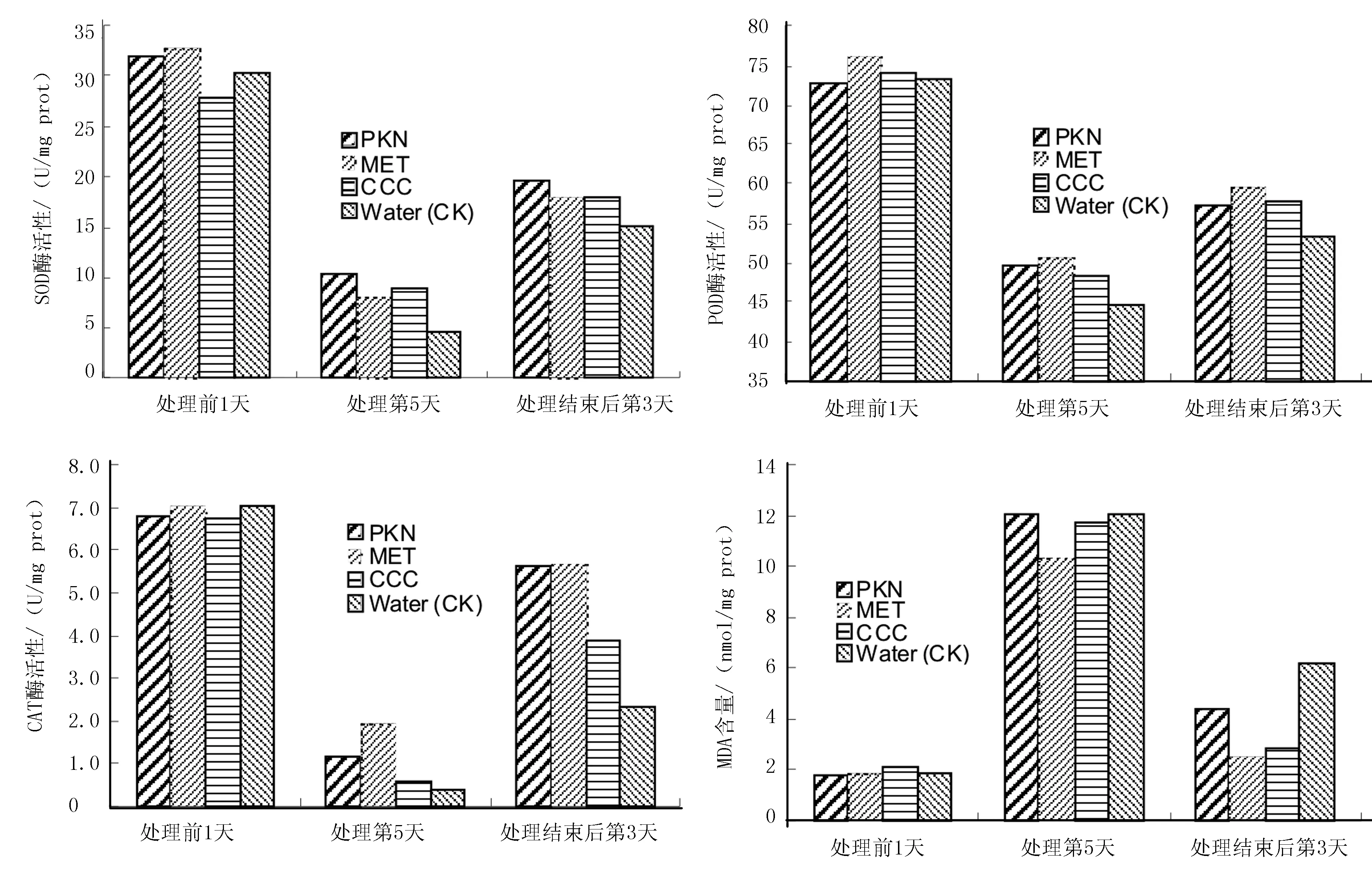
图4 低温处理前、中、后玉米苗期叶片中SOD、POD和CAT的酶活性及MDA含量
虽然在低温处理前,在玉米叶片上喷施聚糠奈(PKN)、多效唑(MET)和矮壮素(CCC)等植物生长调节剂,有助于减轻低温对玉米叶片不同抗氧化酶活性和MDA含量的不利影响,而且有助于低温影响结束后玉米叶片中抗氧化酶活性的恢复和MDA含量的降低;但不同植物生长调节剂的效果不同。与对照相比,到低温处理第5天时,喷施PKN的玉米叶片中,SOD、CAT和POD酶活性分别比对照高126.1%、185.4%和10.7%,MDA含量低0.2%;喷施MET的玉米叶片中,SOD、CAT和POD酶活性分别比对照高76.1%、373.2%和13.2%,MDA含量低14.2%;喷施CCC的玉米叶片中,SOD、CAT和POD酶活性分别比对照高93.5%、36.6%和7.8%,MDA含量低3.2%。在低温处理结束后第3天时,喷施PKN的玉米叶片中,SOD、CAT和POD酶活性分别比对照高29.8%、142.2%和7.1%,MDA含量低28.5%;喷施MET的玉米叶片中,SOD、CAT和POD酶活性分别比对照高19.9%、144.4%和11.8%,MDA含量低58.8%;喷施CCC的玉米叶片中,SOD、CAT和POD酶活性分别比对照高19.2%、67.2%和9.1%,MDA含量低53.3%(表2)。
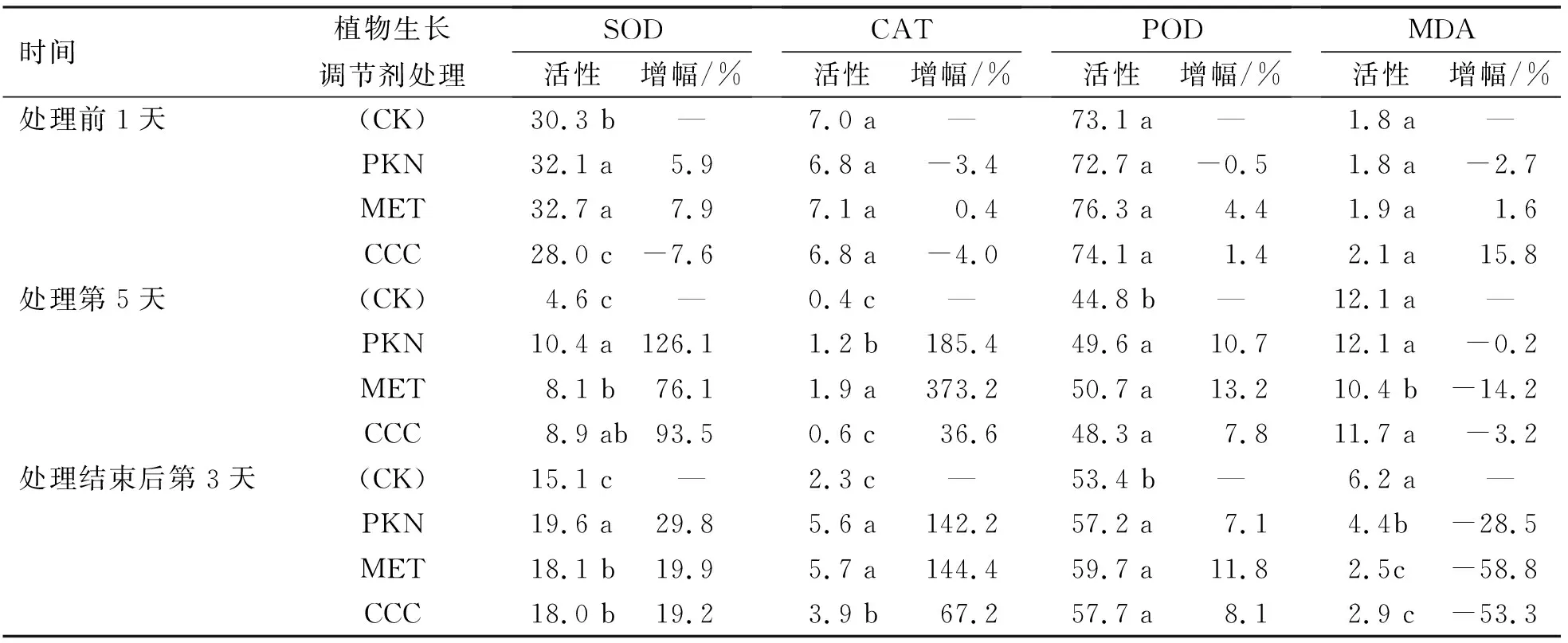
表2 低温胁迫下不同植物生长调节剂对玉米叶片抗氧化酶活性及MDA含量增幅的影响
注:同一列中的相同字母表示在0.05水平上差异显著。
3 讨论与结论
作物产量的形成需要有稳定强劲的光合作用[26-27],然而植株的光合作用容易受到低温、干旱等逆境胁迫因素的影响。对玉米而言,苗期是最易受低温冷害影响的时期之一。前人的研究表明,3叶期玉米在低温胁迫条件下,叶绿素值会明显下降[28-29];这与本试验的结果(图3)基本一致。叶绿素是植物捕获光能、进行光合作用的重要物质,叶绿素值的下降势必会对植物光合作用产生严重负面影响。光合系统II的潜在活性(Fv/F0)和最大光化学量子产率(Fv/Fm)是植物受到环境胁迫的重要指标,在非环境胁迫条件下几乎很少会发生变化。本试验中,苗期低温使Fv/F0和Fv/Fm均大幅下降,说明光合作用受到明显抑制。低温不仅会造成光合系统II的电子传递活性降低,导致植物光猝灭激发能力及能量捕获能力下降,而且即使是低强度的光照射,也会造成能量过剩和过氧化损伤[10-11]。植物为消除过氧化物带来的损害,在低温初期或轻度冷害条件下,会激发SOD、POD和CAT等抗氧化酶活性的提高[30-31],但随着低温时间的延长,抗氧化酶的活性也会逐渐下降。本试验中,随着低温冷害时间的延长,玉米叶片SOD、POD和CAT等抗氧化酶活性显著下降;相对而言,SOD和CAT酶活性的下降比POD更加剧烈,而POD受低温的影响比SOD和CAT小得多。
聚糠奈(PKN)、多效唑(MET)和矮壮素(CCC)处理有助于提高植物抗寒性。高娇等[6]和徐田军等[32]的研究表明,PKN水剂能够有效延缓玉米幼苗叶片光和指标和抗氧化酶活性,在低温条件下的下降幅度、显著提高幼苗抗寒性。徐秋曼等[33]用MET处理水稻幼苗,使水稻叶片在低温胁迫条件下维持较高的SOD活性,并降低电导率、显著提高水稻幼苗的抗寒能力[33];张智等[34]的研究也表明,MET处理可显著延缓油菜叶片叶绿素值及净光合速率在低温条件下的下降幅度。毛秀杰等[35]用CCC处理厚皮甜瓜,使其在低温条件下降低膜脂质过氧化程度和细胞通透性,抗寒性有了一定的提高。然而,不同的研究者在不同的研究中不仅所用植物生长调节剂不同,而且所研究的作物也不同。
本试验中,在玉米上,在苗期低温胁迫前,分别喷施PKN、MET和CCC等不同植物生长调节剂后,再进行低温处理,以期了解不同植物生长调节剂对提高玉米耐冷性的效果。结果表明,虽然PKN、MET和CCC等不同植物生长调节剂都能减轻玉米叶片受低温冷害的影响,尤其是都有助于低温胁迫结束后玉米光合指标和抗氧化酶活性的快速恢复,但这3种植物生长调节剂,在减轻玉米叶片Fv/F0、Fv/Fm和SPAD值的降低、减轻SOD、CAT和POD等抗氧化酶酶活性的下降以及抑制叶片中MDA积累等方面的具体效果有所差异。在低温处理前,在玉米叶片上喷施MET不仅能有效减缓Fv/F0、Fv/Fm和SPAD值的降低,并能有效减轻玉米叶片中SOD、CAT和POD等抗氧化酶活性的降低、有效降低玉米叶片中MDA的积累,而且低温胁迫结束后各项耐冷指标的快速恢复效果最为明显。喷施 PKN后,虽然能有效提高玉米叶片SOD和CAT的酶活性,但不能有效抑制低温下MDA的积累。而喷施CCC后,在提高SOD、CAT和POD的酶活性和减缓Fv/F0、Fv/Fm和SPAD值的降低的效果方面不如MET和PKN,但低温处理结束后玉米叶片中MDA含量的降低速度却与MET处理相近,显著快于PKN处理。总体上,MET提高玉米苗期耐冷性的效果显著优于PKN和CCC,而PKN的总体效果略好于CCC。
参考文献:
[1] 李正国,杨鹏,唐华俊,等.近20年来东北三省春玉米物候期变化趋势及其对温度的时空响应[J].生态学报,2016,33(18):5818-5827.
[2] 张建平,王春乙,赵艳霞,等.基于作物模型的低温冷害对我国东北三省玉米产量影响评估[J].生态学报,2012,32(13):4132-4138.
[3] 董志强,解振兴,薛金涛,等.苗期叶面喷施6-BA对玉米硝酸还原酶活力的影响[J].玉米科学,2008,16(5):54-57.
[4] 曹振木,牛玉,刘子记,等.矮壮素及烯效唑对甜椒幼苗质量的影响[J].热带作物学报,2012,33(12):2156-2160.
[5] 陈传晓,董志强,高娇,等.聚糠萘水剂对不同积温带春玉米灌浆期光合性能的影响[J].玉米科学,2013,21(3):66-70.
[6] 高娇,董志强,徐田军,等.聚糠奈水剂对低温胁迫玉米幼苗氮代谢酶活的调控效应[J].玉米科学,2013,21(4):48-54.
[7] 冯立娟,苑兆和,尹燕雷,等.多效唑对大丽花叶片光合特性和超微结构的影响[J].草业学报,2014,23(4):114-121.
[8] 赵晶晶,冯乃杰,郑殿峰,等.叶面喷施调节剂和微量元素对马铃薯块茎品质及产量的影响[J].黑龙江八一农垦大学学报,2016,28(4):12-17.
[9] 解美佳,殷丽华,刘涛,等.植物生长调节剂对寒地春玉米形态指标和产量的影响[J].黑龙江八一农垦大学学报,2016,28(3):17-22.
[10] Mauro S,Dainese P,Lannoye R,et al.Cold resistant and cold susceptible maize lines differ in the phosphorylation of the photosystem II, subunit, CP29[J].Plant Physiology,1997,115(1):171-177.
[11] Powles S B,Berry J A,Bjorkman O.Interaction between light and chilling temperature on the inhibition of photosynthesis in chilling-sensitive plants[J].Plant Cell & Environment,1983,6(2):117-123.
[12] 刘琳,毛凯,干友民,等.抗寒锻炼对假俭草SOD、POD活性及MDA含量的影响[J].湖北农业科学,2005(6):87-89.
[13] 王敏,陈秋芳,石美娟,等.低温胁迫对甜樱桃品种枝条SOD、POD活性和脯氨酸含量的影响[J].山西果树,2011,144(6):3-5.
[14] 高俊杰,秦爱国,于贤昌.低温胁迫下嫁接对黄瓜叶片SOD和CAT基因表达与活性变化的影响[J].应用生态学报,2009,20(1):213-217.
[15] 吴跃红.低温对法国梧桐种子萌发的影响[J].河南科技学院学报(自然科学版),2016,44(2):32-35.
[16] 李婷,张玉霞,王显国,等.低温胁迫下紫花苜蓿根颈抗氧化酶对不同水平磷钾肥处理的响应[J].内蒙古民族大学学报(自然科学版),2017,32(3):243-247.
[17] 苏日古嘎,张玉霞,朱爱民.干旱胁迫对3种野生豆科牧草生长发育和抗旱生理机制的影响[J].内蒙古民族大学学报(自然科学版),2017,32(5):425-441.
[18] 刘志萍,巴图,吕二锁,等.利用SPAD-502叶绿素计筛选大麦高光效新种质[J].内蒙古民族大学学报(自然科学版),2017,32(6):510-515.
[19] 何丽斯,苏家乐,刘晓青,等.高山杜鹃叶片叶绿素含量测定及其与SPAD值的关系[J].江苏农业科学,2012,40(11):190-191.
[20] 陈梅唐,唐运来.低温胁迫对玉米幼苗叶片叶绿素荧光参数的影响[J].内蒙古农业大学学报(自然科学版),2012,33(3):20-24.
[21] 刘志萍,巴图,吕二锁,等.利用SPAD-502叶绿素计筛选大麦高光效新种质[J].内蒙古民族大学学报(自然科学版),2017,32(6):510-515.
[22] 南京建成生物工程研究所.总超氧化物歧化酶(T-SOD)测试盒(羟胺法)说明书:http://www.njjcbio.com/products.asp?id=284
[23] 南京建成生物工程研究所.过氧化物酶(POD)测试盒(比色法)说明书:http://www.njjcbio.com/products.asp?id=423
[24] 南京建成生物工程研究所.过氧化氢酶(CAT)测试盒(可见光法)说明书:http://www.njjcbio.com/products.asp?id=299
[25] 南京建成生物工程研究所.丙二醛(MDA)测试盒(TBA法)说明书:http://www.njjcbio.com/products.asp?id=287
[26] 刘贤赵,康绍忠.番茄不同生育阶段遮荫对光合作用与产量的影响[J].园艺学报,2002,29(5):427-432.
[27] Nelson C J.Genetic association between photosynthetic characteristics and yield: review of the evidence[J].Plant Physiology & Biochemistry,1988,26(4):543-554.
[][]
[28] 高素华,张国民.低温对玉米幼苗生理反应的影响[J].应用气象学报,1999(2):238-242.
[29] 孙阳,王燚,梦瑶,等.外源5-氨基乙酰丙酸对低温胁迫下玉米幼苗生长及光合特性的影响[J].作物杂志,2016(5):87-93.
[30] 张敬贤,李俊明,崔四平,等.低温对玉米幼苗细胞保护酶活性及胞质质量参数的影响[J].华北农学报,1993,8(3):9-12.
[31] 熊冬金,林志红,杨柏云,等.玉米在涝渍和低温胁迫过程中四种酶同工酶分析及丙二醛的变化[J].南昌大学学报(理科版),1996,2(4):314-319.
[32] 徐田军,董志强,兰宏亮,等.低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J].作物学报,2012,38(2):352-359.
[33] 徐秋曼,陈宏,高虹,等.多效唑提高水稻幼苗抗低温能力的机理初探[J].西北植物学报,2002,22(5):1236-1241.
[34] 张智,张耀文,任军荣,等.多效唑处理后油菜苗在低温胁迫下的光合及生理特性[J].西北农业学报,2013,22(10):103-107.
[35] 毛秀杰,孙中峰.叶面喷施矮壮素(CCC)对厚皮甜瓜幼苗抗寒性的影响[J].辽宁农业职业技术学院学报,2000,2(4):13-15.
