Tim3水平对非小细胞肺癌临床进展及预后的影响
2018-06-19朱文良李靖梁新强赖林梁艳艳陆运鑫侯恩存
朱文良,李靖,梁新强,赖林,梁艳艳,陆运鑫,侯恩存
(1.广西中医药大学附属瑞康医院 肿瘤内科二病区,广西 南宁 530011;2.郑州大学附属肿瘤医院 微创介入科,河南 郑州 450008;3.广西医科大学附属肿瘤医院基础实验部,广西 南宁 530021)
肺癌的发展与T细胞免疫功能紊乱及T细胞亚群比例失衡有关[1-2]。T细胞免疫球蛋白黏蛋白分子3(T cell immunoglobulin domain and mucin domain 3, Tim3)可与其配体半乳糖凝集素9结合并抑制辅助性T细胞1(T helper 1 cell, Th1)的活性,下调Th1免疫应答[3]。研究显示Tim3在多种癌症患者外周血CD4+和CD8+T细胞中高表达,且与癌症发展及预后相关[4-6]。提示从外周血中探索Tim3与癌症预后的关系成为一种思路。本研究初步探讨非小细胞肺癌(non-small cell lung cancer, NSCLC)中Tim3的表达,及其与患者临床病理特征及预后的关系。
1 资料与方法
1.1 一般资料
选取2013年9月-2014年9月于广西中医药大学附属瑞康医院医院肿瘤内科住院的69例NSCLC患者。其中,男性43例,女性26例;年龄27~79岁,平均56.8岁;TNM分期Ⅰ﹑Ⅱ期患者36例(52.2%),Ⅲ﹑Ⅳ期患者33例(47.8%);鳞癌33例(47.83%),腺癌31例(44.93%),其他5例(7.24%);肿瘤直径<3 cm者45例(65.2%),肿瘤直径≥3 cm者24例(34.8%)。所有患者均经组织病理学或影像学检测确诊。纳入标准:①符合原发性肺癌的诊断标准;②无放疗和化疗史。排除标准:①转移性肺癌患者;②正在使用抗凝剂或抗血小板聚集药物治疗的患者;③伴有自身免疫性疾病。同时选择本院体检的65例健康人群(无肿瘤病史,年龄﹑性别匹配)作为对照组。其中,男性41例,女性24例。本研究经广西中医药大学附属瑞康医院伦理委员会批准,患者均签署知情同意书。
1.2 外周血CD4+T细胞表面Tim3表达水平检测
清晨空腹条件下采集受试者静脉血于肝素抗凝管抗凝。Ficoll密度梯度离心法分离外周血单个核细 胞(peripheral blood mononuclearcells, PBMC)。 清洗后将PBMC重悬于磷酸盐缓冲液中。然后于流式管中加入100μl PBMC细胞悬液,并加入藻红素(Phycoerythrin, PE)-抗人Tim3抗体(1∶1 000稀释)﹑别藻蓝素(Allophycocyanin, APC)-抗人CD3抗体(1∶1 000稀释)及异硫氰酸荧光素(fluorescein isothiocyanate, FITC)-抗人CD4抗体(1∶1 000稀释),4℃避光孵育30min。流式细胞仪进行检测,每例至少有10 000个细胞用于分析。抗体均购自美国eBioscience公司。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率表示,比较用χ2检验,Kaplan-Meier法制做生存曲线,比较用Log-rank检验;影响因素的分析采用Cox比例风险模型,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者外周血CD4+T细胞表面Tim3表达水平比较
对照组患者外周血CD4+T细胞表面Tim3表达水平[(2.71±1.30)%]与NSCLC组患者外周血CD4+T细胞表面Tim3表达水平[(7.10±2.53)%]比较,差异有统计学意义(t=3.231,P=0.000),NSCLC组高于对照组。见图1。
2.2 NSCLC组患者Tim3高表达与NSCLC临床病理的相关性
以NSCLC组患者CD4+T细胞表面Tim3百分比的中位数(7.16%)为截点分为Tim3高表达组和Tim3低表达组。Tim3高表达与TNM分期及淋巴结转移有相关性(P<0.05),与年龄﹑性别﹑吸烟史﹑肿瘤直径及组织类型无相关性(P>0.05)。见表1。
2.3 NSCLC组患者Tim3表达水平与NSCLC患者预后的关系

图1 两组患者外周血CD4+T细胞表面Tim3表达水平比较

表1 NSCLC组患者Tim3高表达与NSCLC临床病理因素的相关性
Kaplan-Meier生存曲线分析结果表明,NSCLC组患者中位总生存期(overall survival, OS)为13.4个月。其中,Tim3高表达组35例,Tim3低表达组34例。Tim3高表达组和Tim3低表达组中位OS分别为11.7和16.2个月,Log-rank检验结果显示:Tim3高表达组和Tim3低表达组的OS比较,差异有统计学意义(χ2=6.545,P=0.011),Tim3低表达组患者高于Tim3高表达组患者。见图2。

图2 不同Tim3表达水平NSCLC患者生存曲线图
2.4 NSCLC组患者预后的Cox风险回归模型单因素及多因素分析
将年龄﹑性别﹑吸烟史﹑肿瘤直径﹑淋巴结转移﹑TNM分期及CD4+T细胞表面Tim3表达等因素纳入Cox比例风险回归模型进行分析。单因素Cox生存分析结果表明,男性﹑吸烟﹑肿瘤直径<3 cm﹑淋巴结转移N0﹑TNM分期Ⅰ﹑Ⅱ期及CD4+T细胞表面Tim3高表达与患者生存不良预后相关(P<0.05)。进一步多因素Cox比例风险模型分析结果提示Tim3高表达为患者OS的独立危险因素(P<0.05)。见表2。
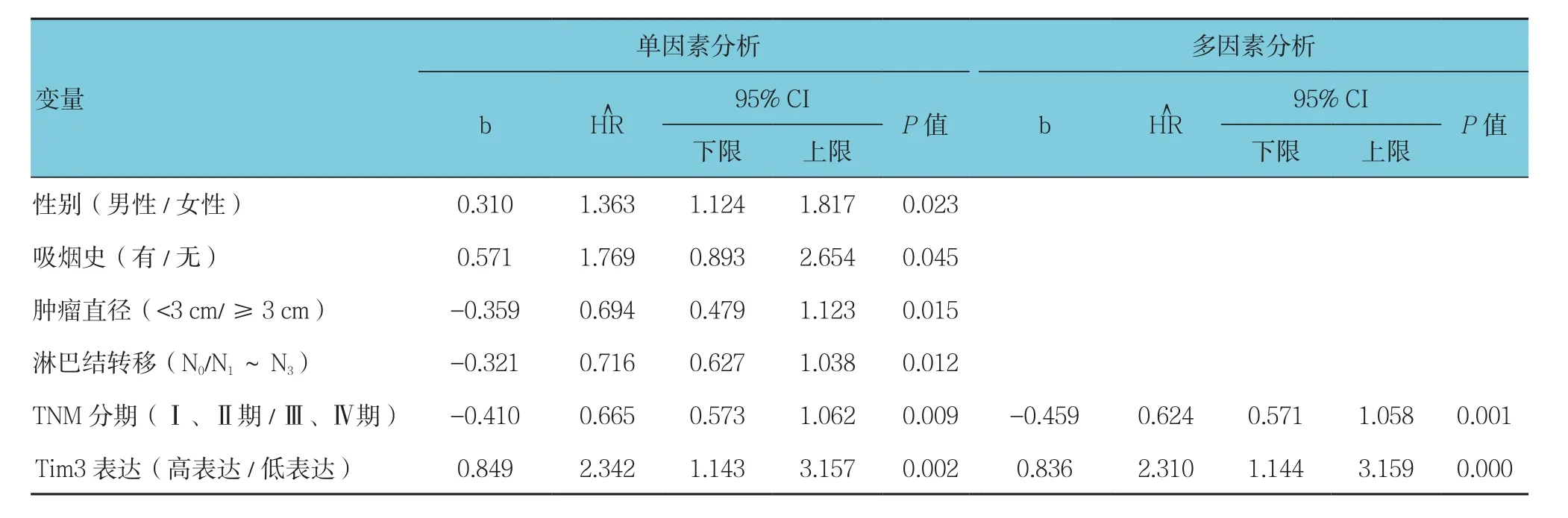
表2 NSCLC组患者预后的Cox比例风险模型单因素及多因素分析
3 讨论
肺癌,尤其是NSCLC是对人类健康和生命威胁最大的恶性肿瘤之一,具有易复发﹑易转移的特点。近年来,随着免疫机制研究的深入,肿瘤免疫治疗引起越来越多的重视。美国食品药品管理局已批准阻断名为程序性细胞死亡蛋白1/程序性死亡受体-配体1免疫检查点的新免疫疗法用于晚期肺癌和肾癌的治疗。本研究发现NSCLC患者外周血CD4+T细胞表面Tim3百分比升高,且与NSCLC生存期相关,提示Tim3可能是预测晚期NSCLC预后的生物指标。
T细胞免疫球蛋白黏蛋白分子家族最早发现于克隆哮喘小鼠模型中,目前在人体中只发现3种家族成员(Tim1﹑Tim3及Tim4)[4-6]。Tim广泛参与Th1和Th2介导的免疫反应,如Tim1可促进细胞因子的产生,Tim4持续表达于成熟的树突细胞[7]。研究显示Tim3与自身免疫疾病及多种癌症相关。在类风湿性关节炎患者外周血中,CD4+和CD8+T细胞表面Tim3升高并与疾病活动性评分﹑血浆肿瘤坏死因子α表达及疾病恶化程度呈负相关[8-9];在卵巢癌﹑胶质瘤及骨肉瘤患者外周血CD4+和CD8+T细胞中Tim3高表达,且CD4+T细胞表面Tim3异常高表达与肿瘤的发生发展密切相关。提示外周血Tim3表达水平可以作为癌症潜在的诊断和预后指标。ZHUANG等[10]对30例NSCLC患者肺癌组织样本进行免疫组织化学检测发现,Tim3在86.7%的NSCLC患者组织中呈阳性,且与患者预后有关。然而,外周血Tim3表达水平是否与NSCLC患者预后有关尚未见报道。同时,由于肿瘤组织的提取过程具有创伤性大,难以获得等缺点,寻找创伤性小,易操作的预测指标有重要的临床意义。本研究发现,NSCLC患者外周血CD4+T细胞表面Tim3水平高于对照组(P<0.05),且TNM分期Ⅲ﹑Ⅳ期患者血清Tim3高表达水平高于Ⅰ﹑Ⅱ期患者,提示CD4+T细胞表面Tim3的表达增高可能促进NSCLC的发生发展和转移,其异常表达可能与晚期肺癌局部侵袭有关。
对69例NSCLC患者Kaplan-Meier生存曲线的结果显示,Tim3低表达组中位OS高于Tim3高表达组(P<0.05),提示Tim3表达量升高与预后较差有关。这与Tim3在其他癌症的作用相同,即在卵巢癌和骨肉瘤患者外周血CD4+T细胞中,Tim3的高水平表达预示着预后不良[4﹑6]。Cox比例风险模型分析结果提示Tim3高表达是NSCLC患者OS的独立危险因素。研究表明Tim3可以通过活化白介素-6(Interleukin-6,IL-6)/信号转导和转录激活因子3通路抑制CD4+T细胞活化和Th1细胞极化,促进淋巴瘤的发生[11]。另一方面,Th1细胞可以释放IL-6等细胞因子。因此,笔者推测一些炎症通路可能参与了Tim3介导的肺癌的发生与发展。
综上所述,CD4+T细胞表面Tim3在NSCLC患者外周血中的高表达与TNM分期及淋巴结转移有相关性,可作为评估NSCLC患者预后的重要指标。利用Tim3水平来判定晚期NSCLC患者的生存结局将为临床实践提供了具有新意的指导思路。然而,在外周血CD4+T细胞表面Tim3水平在被纳入临床检测之前,仍需要大样本的前瞻性研究进一步评估其应用价值。
参 考 文 献:
[1]WANG W J, TAO Z, GU W, et al. Variation of blood T lymphocyte subgroups in patients with non- small cell lung cancer[J]. Asian Pac J Cancer Prev, 2013, 14(8): 4671-4673.
[2]DUAN M C, ZHONG X N, LIU G N, et al. The Treg/Th17 paradigm in lung cancer[J]. J Immunol Res, 2014, 2014: DOI:10.1155/2014/730380.
[3]ZHU C, ANDERSON A C, SCHUBART A, et al. The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity[J]. Nat Immunol, 2005, 6(12): 1245-1252.
[4]WU J, LIU C, QIAN S, et al. The expression of Tim-3 in peripheral blood of ovarian cancer[J]. DNA Cell Biol, 2013, 32(11): 648-653.
[5]HAN S, FENG S, XU L, et al. Tim-3 on peripheral CD4(+) and CD8(+) T cells is involved in the development of glioma[J]. DNA Cell Biol, 2014, 33(4): 245-250.
[6]LIU H, ZHI L, DUAN N, et al. Abnormal expression of Tim-3 antigen on peripheral blood T cells is associated with progressive disease in osteosarcoma patients[J]. FEBS Open Bio, 2016, 6(8):807-815.
[7]MEYERS J H, SABATOS C A, CHAKRAVARTI S, et al. The TIM gene family regulates autoimmune and allergic diseases[J]. Trends Mol Med, 2005, 11(8): 362-369.
[8]LIU Y, SHU Q, GAO L, et al. Increased Tim-3 expression on peripheral lymphocytes from patients with rheumatoid arthritis negatively correlates with disease activity[J]. Clin Immunol, 2010,137(2): 288-295.
[9]LI S, PENG D, HE Y, et al. Expression of TIM-3 on CD4+and CD8+ T cells in the peripheral blood and synovial fluid of rheumatoid arthritis[J]. APMIS, 2014, 122(10): 899-904.
[10]ZHUANG X, ZHANG X, XIA X, et al. Ectopic expression of TIM-3 in lung cancers: a potential independent prognostic factor for patients with NSCLC[J]. Am J Clin Pathol, 2012, 137(6): 978-985.
[11]HUANG X, BAI X, CAO Y, et al. Lymphoma endothelium preferentially expresses Tim-3 and facilitates the progression of lymphoma by mediating immune evasion[J]. J Exp Med, 2010,207(3): 505-520.
