模拟氮沉降对油松土壤热水浸提有机物的影响
2018-06-15艾泽民梁楚涛刘国彬1
艾泽民, 梁楚涛, 辛 奇, 薛 萐, 刘国彬1,
(1.中国科学院 水利部 水土保持研究所, 黄土高原土壤侵蚀与旱地农业国家重点实验室, 陕西 杨凌 712100; 2.中国科学院大学, 北京 100049; 3.西北农林科技大学 水土保持研究所, 陕西 杨凌 712100)
随着我国工农业的发展,活性氮排放持续增加,氮沉降已经成为我国所面临主要环境问题之一,而且近年来氮沉降量还在不断增高[1-3]。尽管较低的氮沉降增加森林生态系统生产力,但长期、大量的氮沉降对生态系统的负面影响也引起了广泛关注[4-6]。已有的研究普遍认为,氮沉降会对土壤有机质分解、转移产生影响[7]。
热水浸提有机物是土壤有机质中的主要活性组分,它包括大部分土壤微生物量和简单的有机化合物,在土壤营养元素迁移转化过程中有着非常重要的作用,是土壤碳库对环境变化响应的敏感指标[7-8]。通常用热水浸提有机物碳、氮含量反映热水浸提有机物含量[8-9],并用紫外特征值反映其官能团特征和生物降解性[11-12]。目前,关于黄土丘陵区氮沉降对森林生态系统的研究对土壤有机质的研究多集中于碳储量研究,对活性组分关注较少。
本研究选取中国北方温带针叶林常见树种,暖温带湿润半湿润气候区地带性植被油松[13-14],参照黄土高原氮沉降量[3.0~7.3 g/(m2·a)][15],喷施无机氮肥尿素,研究氮沉降对油松根际、非根际热水浸提有机物影响,分析氮沉降对森林土壤碳库的潜在作用。
1 材料与方法
1.1 研究区概况
试验地设在中国科学院教育部水土保持与生态环境研究中心试验田,位于杨凌农业高新技术产业示范区。该区属温带大陆性季风气候。年平均气温13.2℃,降水量674.3 mm,日照时数1 993.7 h,无霜期225 d。试验用土取自中国科学院水利部水土保持研究所安塞水土保持综合试验站,延安北部油松林地主要土壤为黄绵土,为黄土高原典型土壤,含氮量约为0.724 mg/kg。
1.2 试验设计
2007年3月将油松的种子播种于5 m×10 m的苗床上培育。2008年3月,将一年生油松幼苗移栽于直径35 cm、深度40 cm的PVC试验盆中。本研究设置6个处理[CK,N1,N2,N3,N4,N5依次为0,2.8,5.6,11.2,22.4,44.8 g/(m2·a)],该水平从黄土高原当前N沉降强度[约2.06 g/(m2·a)]到严重过量。采用单因素区组设计,每个处理设置68盆。从2008—2014年,每年的3月20日—4月10日间任意1次下雨前将不同氮处理的尿素用量溶于1 000 ml蒸馏水中,并均匀施入试验盆内。
1.3 试验方法
(1) 取样方法。2014年7月,在每个施氮水平选择有代表性的盆栽6盆,破盆取土。用抖根法区分根际土与非根际土,并用四分法取适量土样,过2 mm筛以除去土壤中残留的根与其他残留,取适量土样风干分别过1 mm筛和0.25 mm筛。
(2) 土壤碳氮含量测定。采用重铬酸钾外加热法测定土壤有机碳(SOC)含量,采用半微量凯氏定氮法测定土壤全氮(TN)含量[16]。土壤硝态氮、铵态氮采用1 mol/L氯化钾以水土比10∶1浸提,用流动分析仪测定[16]。结果见表1。
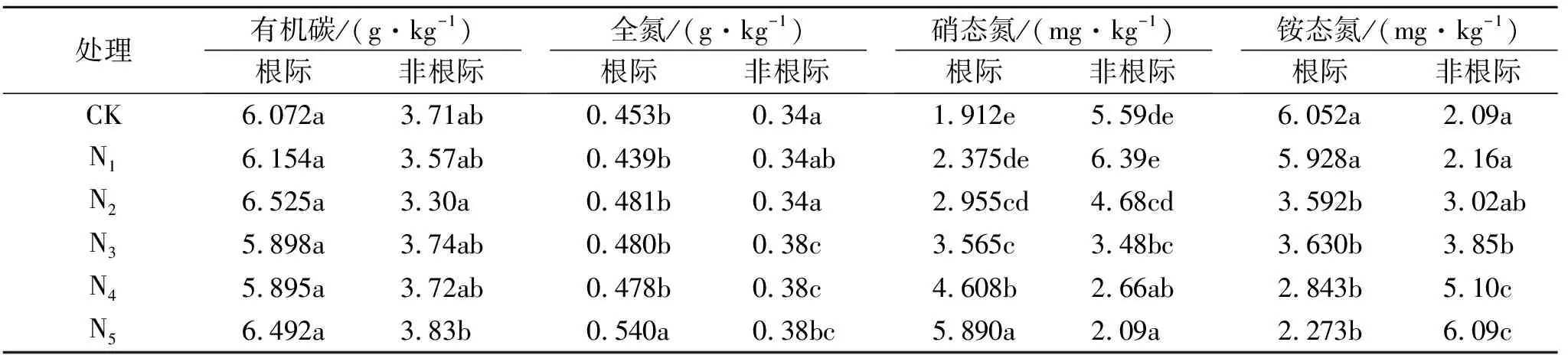
表1 不同氮沉降水平下土壤碳、氮含量
注:字母不同代表有显著性差异。
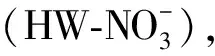
(4) 水溶性有机物紫外特征值测定。吸光度斜率指数(absorbance slope index,ASI)[17]被用来反映分子量的大小及羧基芳香基含量,SUVA254和UV280则被用来反映水溶性有机物芳化程度[18-20]。E4/E6在UV/Vis光谱分析中是被认为与DOM芳香性、缩聚程度和分子量呈负相关[21]。采用UV-1601紫外—可见分光光度计测定水样在220~700 nm处波长,记录220,230,254,272,280,465,665 nm处的吸光值为UV220,UV230,UV254,UV272,UV280,UV465,UV665。分别计算ASI[17],SUVA254[20-22],E4/E6[23]。计算公式如下:
ASI=0.56(UV254-UV272)/(UV220-UV230)
(1)
SUVA254=UV254/Ctoc
(2)
E4/E6=UV465/UV665
(3)
式中:Ctoc为提取液有机碳浓度(mg/L)。
1.4 数据处理
采用Excel 2010绘制条形图,使用SPSS 20进行多重比较(Duncan法)和相关性分析(Pearson法)。
2 结果与分析
2.1 氮沉降对热水浸提有机碳(HWOC)的影响
氮沉降在一定范围内可以增加根际HWOC含量(不超过N3水平),但过量的氮沉降并不能继续增加根际HWOC含量,而氮沉降并未对非根际HWOC含量产生显著影响(图1)。HWOC具有明显的根际效应,根际HWOC显著高于非根际。
根际HWOC占SOC的比例,随着氮沉降量的增加从CK处约2.5%逐渐升高,在N3处达到最高.5%,随后趋于稳定(图2)。非根际HWOC占SOC的比例随氮沉降增加而增加,在N2处达到最高值约3.4%,随后稳定在3%。根际HWOC/SOC均高于非根际,但未见显著差异。
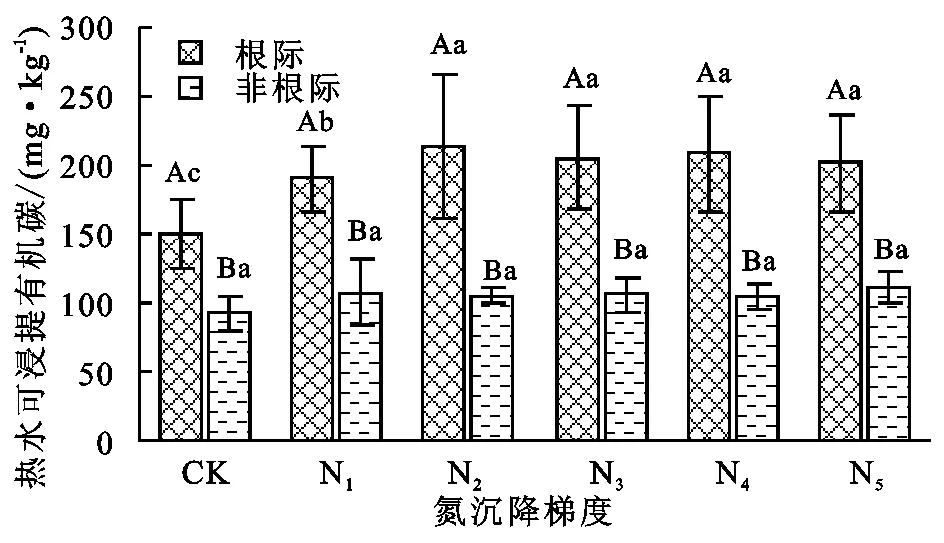
注:不同大写字母表示同一施氮水平下,根际与非根际差异显著。不同小写字母表示不同施氮水平下,根际或非根际的差异显著性,下图同。
图1氮沉降对热水浸提有机碳的影响
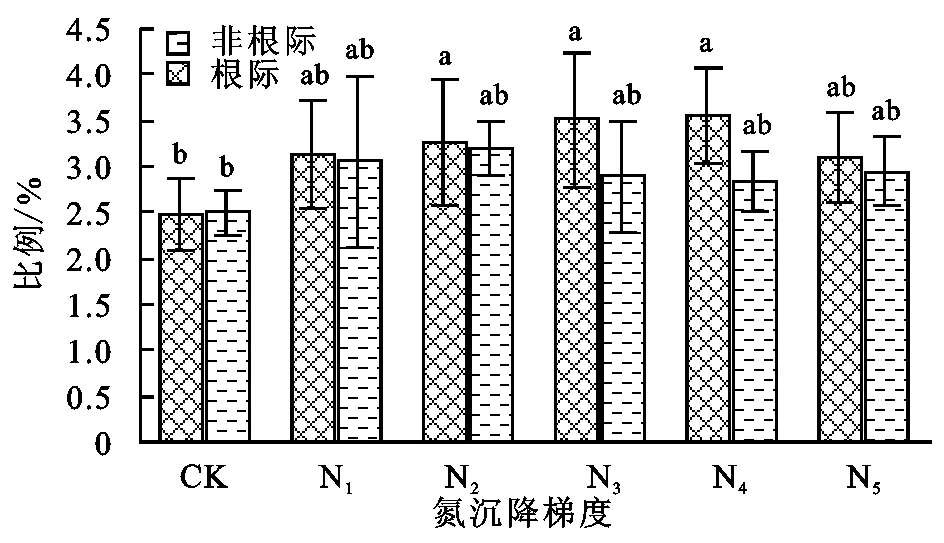
图2 热水浸提有机碳占土壤有机碳中的比例
2.2 氮沉降对热水浸提氮(HWTN)及其组分的影响
HWTN的测定结果见图3,HWTN含量随氮沉降的增加而增加,根际HWTN从25 mg/kg增加至80 mg/kg,非根际HWTN从18 mg/kg增加至60 mg/kg,根际显著高于非根际。而对HWTN组分的分析发现,氮沉降和根系都会增加HWTN中有机氮(HWON)含量,可溶性氮中铵态氮的比例随氮沉降的增加而降低,并且根系比例低于非根际。
热水浸提总氮与氮沉降量较为明显的线性关系(根际r2=0.9670,非根际r2=0.9335),热水浸提有机氮与施氮量也有较好的线性关系(根际r2=0.9884,非根际r2=0.9448)。
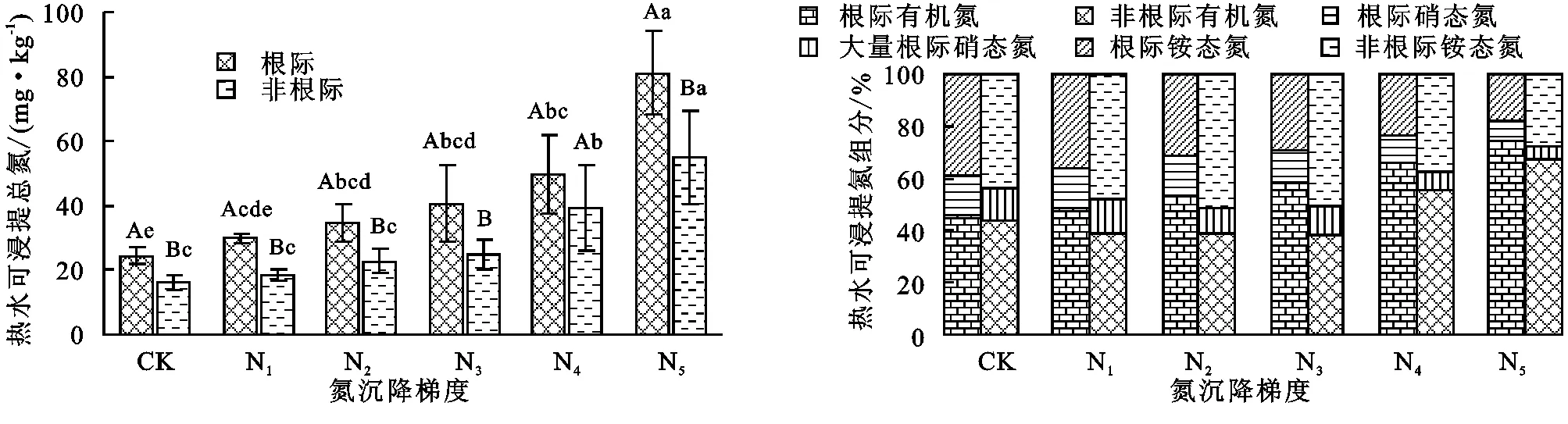
图3 氮沉降对热水浸提氮及其组分的影响
根际HWTN/TN与HWON/TN显著高于非根际(图4)。其中根际HWTN/TN随氮沉降增加,由7.5%升高至25%,非根际HWTN/TN由3%升高至10%,根际HWON/TN由3%升高至11%,非根际HWON/TN由1.8%上升至6%。HWTN/TN与HWON/TN均随氮沉降增加而升高。
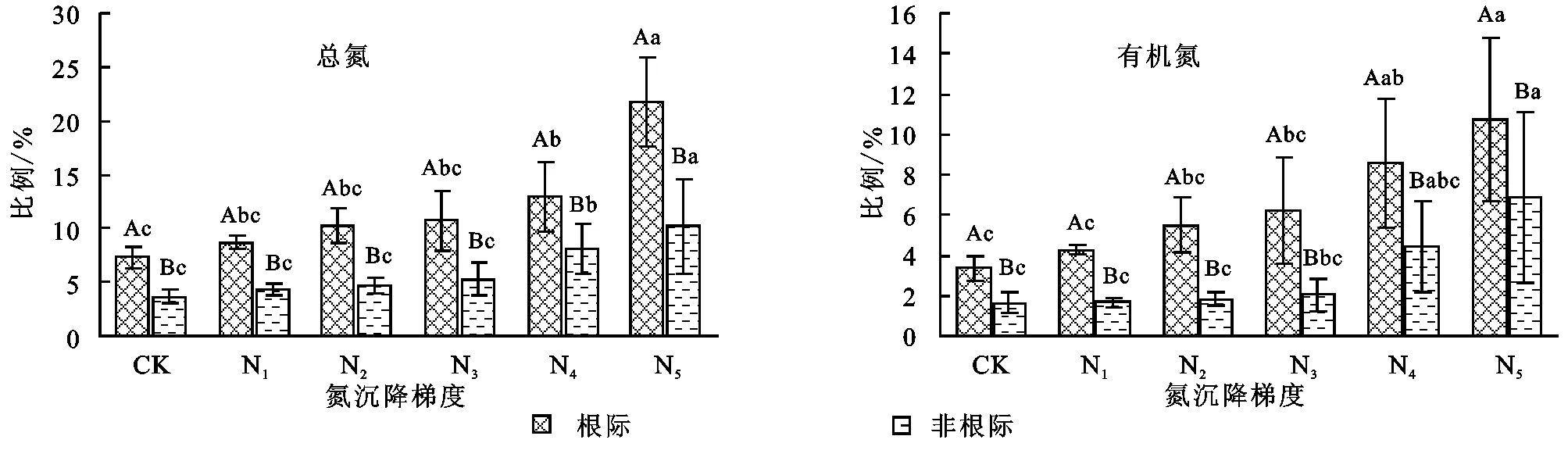
图4 氮沉降对热水浸提总氮与有机氮在土壤全氮中比例的影响
2.3 氮沉降对热水浸提有机物紫外特征值的影响
由图5可见,ASI指数随氮沉降的增加而降低,且根际均高于非根际,SUVA254与UV280均在N3水平出现一个峰值,N4水平出现谷值。E4/E6根际的结果也出现了拐点,但根际、非根际并未出现于SUVA254和UV280相似的富集现象。
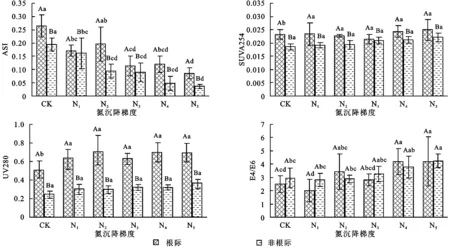
图5 氮沉降对紫外特征值ASI,SUVA254,UV280,E4/E6的影响
2.4 热浸提有机物碳氮含量与特征值相关性
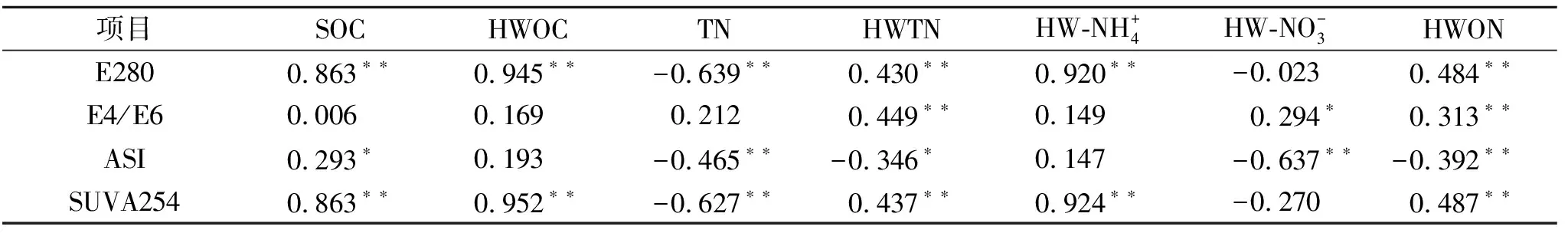
表2 热水浸提有机物组分与其官能团特征的相关性分析
注:*表示显著相关(p<0.05),**表示极显著相关(p<0.01)。
3 讨 论
3.1 氮沉降和根际对HWOC的影响
HWOC被认为是土壤碳库的重要组成成分,是土壤肥力的重要指标[9]。它主要来源于枯落物的分解、微生物及根系分泌物。文中所用植物油松属多年生常绿乔木,且均处在生长期,几乎没有枯落物产生,因而可以不考虑植物枯落物分解对HWOC的影响[22]。较低的氮沉降增加了根际土壤HWOC含量,也增加了HWOC在SOC中的比例,而与之对应的非根际土壤却没有表现出相似的增加趋势。说明氮沉降促进植物根际生物活动的增加[21],且对有机质分解、分泌产生热水浸提有机碳的速率影响大于其矿化速率影响[24-25]。较高水平的氮沉降不再增加HWOC及HWOC/SOC,可能与氮素饱和,其他因子成为HWOC积累的限制因子有关。
3.2 氮沉降对热水浸提氮的影响
外源氮素进入土壤,被植物吸收利用,又通过根系分泌进入土壤,植物根际的热水浸提氮素含量随氮沉降量增加而增加[26],氮沉降增加热水浸提氮中有机氮的比重,降低了无机氮比重[27],说明土壤可溶性有机物氮含量并未饱和。
非根际热水浸提氮随氮沉降增加而增加,但热水浸提有机氮占热水浸提氮的比重变化与根际并不一致,在较低的氮沉降的水平,HWON/HWTN随氮沉降升高降低。非根际土壤中,热水浸提有机氮主要受微生物活动及根际可溶性有机物随土壤水分的迁移影响,较低的氮沉降水平下,迁移速率小于矿化速率,无机氮素比例增加,较高的氮沉降水平下,因为根际可溶性有机氮增加,根际向非根际的迁移速率也随之增加,非根际可溶性有机氮在氮素中的比例升高。
3.3 氮沉降对紫外特征值的影响
土壤不同碳氮组分往往具有较大的周转差异。热水浸提有机物中,有一些难分解的部分,如芳香性、高分子量化合物,是土壤中相对惰性的组分,对土壤碳库的周转时间有着较大影响。
氮沉降对ASI与E4/E6有较大影响,而只有较低的氮沉降会对SUVA254和E260产生影响,尽管这4个官能团特征值均可反映芳香化程度、分子量大小,但结果并不完全一致,这可能与不同指标所表征的物质结构并不完全一致,不同氮沉降水平下,微生物代谢功能发生变化有关[30],热水浸提有机物官能团特征发生改变且变化并不一致。
3.4 碳氮含量与官能团特征值相关性关系
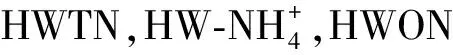
4 结 论
较低的氮沉降增加了根际HWOC含量及HWOC/SOC,较高水平的氮沉降不再增加,这可能与氮素饱和,其他因子成为HWOC积累的限制因子有关,非根际土壤却没有表现出相似的增加趋势,没有明显变化。非根际热水浸提氮随氮沉降增加而增加,但HWON占热水浸提氮的比重变化与根际并不一致,在较低的氮沉降的水平,HWON/HWTN随氮沉降升高降低。热水浸提有机物官能团特征发生改变且变化并不一致。SUVA254与E280(与铵态氮相关),ASI(与硝态氮相关):两组指标或许可用以指征代谢类型对氮沉降的响应的差异。
参考文献:
[1] Bai Y, Wu Jianguo, Clark C M, et al. Tradeoffs and thresholds in the effects of nitrogen addition on biodiversity and ecosystem functioning: evidence from inner Mongolia Grasslands[J]. Global Change Biology, 2009,16(1):358-372.
[2] Galloway J N, Cowling E B. Reactive nitrogen and the world: 200 years of change[J]. Ambio,2002,31(31):64-71.
[3] 段雷,马萧萧,余德祥,等.模拟氮沉降对森林土壤有机物淋溶的影响[J].环境科学,2013,34(6):2422-2427.
[4] Gundersen P, Emmett B A, Kjnaas O J, et al. Impact of nitrogen deposition on nitrogen cycling in forests: a synthesis of NITREX data[J]. Forest Ecology and Management, 1998,101(1):37-55.
[5] Aber J D, Nadelhoffer K J, Steudler P, et al. Nitrogen saturation in northern forest ecosystems[J]. Bioscience,1989,39(6):378-286.
[6] Bahr A, Ellström M, Akselsson C, et al. Growth of ectomycorrhizal fungal mycelium along a Norway spruce forest nitrogen deposition gradient and its effect on nitrogen leakage[J]. Soil Biology and Biochemistry, 2013,59(2):38-48.
[7] Vestgarden L S, Abrahamsen G, Stuanes A O. Soil solution response to nitrogen and magnesium application in a Scots pine forest[J]. Soil Science Society of America Journal, 2001,65(6):1812-1823.
[8] Sparling G, Vojvodicvukovic M, Schipper L A. Hot-water-soluble C as a simple measure of labile soil organic matter: the relationship with microbial biomass C[J]. Soil Biology & Biochemistry, 1998, 30(10/11):1469-1472.
[9] Xue S, Li P, Liu G B, et al. Changes in soil hot-water extractable C, N and P fractions during vegetative restoration in Zhifanggou watershed on the Loess Plateau[J]. Journal of Integrative Agriculture, 2013,12(12):2250-2259.
[10] Ghani A, Dexter M, Perrott K W. Hot-water extractable carbon in soils: a sensitive measurement for determining impacts of fertilisation, grazing and cultivation[J]. Soil Biology & Biochemistry, 2003,35(9):1231-1243.
[11] Marschner B, Kalbitz K. Controls of bioavailability and biodegradability of dissolved organic matter in soils[J]. Geoderma, 2003,113(3):211-235.
[12] Bu X, Wang L, Ma W, et al. Spectroscopic characterization of hot-water extractable organic matter from soils under four different vegetation types along an elevation gradient in the Wuyi Mountains[J]. Geoderma, 2010,159(1):139-146.
[13] 陈云明,梁一民,程积民.黄土高原林草植被建设的地带性特征[J].植物生态学报,2002,26(3):339-345.
[14] 申家朋,张文辉,李彦华,等.陇东黄土高原沟壑区刺槐和油松人工林的生物量和碳密度及其分配规律[J].林业科学,2015,51(4):1-7.
[15] 文海燕,傅华,牛得草,等.大气氮沉降对黄土高原土壤氮特征的影响[J].草业科学,2013,30(5):694-698.
[16] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.
[17] Korshin G, Chow C W K, Fabris R, et al. Absorbance spectroscopy-based examination of effects of coagulation on the reactivity of fractions of natural organic matter with varying apparent molecular weights[J]. Water Research, 2009,43(6):1541-1548.
[18] Kalbitz K, Schmerwitz J, Schwesig D, et al. Biodegradation of soil-derived dissolved organic matter as related to its properties[J]. Geoderma, 2003,113(3):273-291.
[19] Kalbitz K, Schwesig D, Schmerwitz J, et al. Changes in properties of soil-derived dissolved organic matter induced by biodegradation[J]. Soil Biology and Biochemistry, 2003,35(8):1129-1142.
[20] Akagi J, Zsolnayá, Bastida F. Quantity and spectroscopic properties of soil dissolved organic matter (DOM) as a function of soil sample treatments: Air-drying and pre-incubation[J]. Chemosphere, 2007,69(7):1040-1046.
[21] Traversa A, D′Orazio V, Senesi N. Properties of dissolved organic matter in forest soils: influence of different plant covering[J]. Forest Ecology and Management, 2008,256(12):2018-2028.
[22] Pregitzer K S, Burton A J, Zak D R, et al. Simulated chronic nitrogen deposition increases carbon storage in Northern Temperate forests[J]. Global Change Biology, 2008,14(1):142-153.
[23] Berg B, Matzner E. Effect of N deposition on decomposition of plant litter and soil organic matter in forest systems[J]. Environmental Reviews, 1997,5(1):1-25.
[24] 沈芳芳,袁颖红,樊后保,等.氮沉降对杉木人工林土壤有机碳矿化和土壤酶活性的影响[J].生态学报,2012,32(2):517-527.
[25] Fujita Y, Wassen M J. Increased N affects P uptake of eight grassland species: the role of root surface phosphatase activity[J]. Oikos,2010,119(10):1665-1673.
[26] 庞丽,张一,周志春,等.模拟氮沉降对低磷胁迫下马尾松不同家系根系分泌和磷效率的影响[J].植物生态学报,2014,38(1):27-35.
[27] 闫聪微,马红亮,高人,等.模拟氮沉降对中亚热带森林土壤中可溶性氮含量的影响[J].环境科学研究,2012,25(6):678-384.
[28] 薛萐,刘国彬,张超.黄土丘陵区不同植被对根际土壤微生物特性的影响[J].草地学报,2011,19(4):577-583.
[29] 彭琴,董云社,齐玉春.氮输入对陆地生态系统碳循环关键过程的影响[J].地球科学进展,2008,23(8):874-883.
[30] 郁培义,朱凡,王志勇,等.氮添加对樟树林红壤微生物群落代谢功能的影响[J].中南林业科技大学学报,2013,33(3):70-74.
[31] 李辉,徐新阳,李培军,等.人工湿地中氨化细菌去除有机氮的效果[J].环境工程学报,2008,2(8):1044-1047.
[32] 蔡元锋,吴宇澄,王书伟,等.典型淹水稻田土壤微生物群落的基因转录活性及其主要生理代谢过程[J].微生物学报,2014,54(9):1033-1044.
