利用体外瘤胃发酵法评价桑叶与羊草的组合效应
2018-06-14王洪荣侯启瑞
罗 阳 王洪荣* 侯启瑞
(1.扬州大学动物科学与技术学院,扬州 225009;2.中国农业科学院蚕业研究所,镇江 212018)
桑(MorusalbaL.)是我国传统的药食兼用植物[1]。桑叶(mulberry leaves,ML)以其蛋白质含量高[占干物质(DM)含量的20%左右]、适口性好、消化率高,并且还含有丰富的微量元素、维生素和比例适宜的氨基酸的特点,可以被用作一种优质的畜禽饲料。此外,桑叶中还含有黄酮、多糖、植物甾醇、γ-氨基丁酸等生物活性物质,以及三萜类和香豆素等功能性营养成分,这些物质有利于瘤胃微生物的生长繁殖,能维持瘤胃内环境的健康稳定,使瘤胃能够更有效地分解利用饲粮中的各种成分。桑树在我国大部分地区都有种植,而南方地区的许多桑叶园由于雇工成本的提高和桑蚕工业的没落都被荒弃,造成了桑叶资源的浪费。羊草(Leymuschinensis,LC),又称碱草,用其调制出的干草具有颜色浓绿、气味芳香、营养丰富的特点,是一种优良的禾本科饲草[2]。饲粮的组合效应实质上是指来自不同饲料源的营养性物质、非营养性物质以及抗营养物质之间互作的整体效应[3]。增加饲粮之间的正组合效应可以提高饲粮的利用率,节约养殖成本。德国霍恩海姆大学的Menke等[4]首先利用体外注射器内发酵产气的方法来评价饲粮的营养价值,这种方法具有简便、经济、快速的特点,被广泛应用于饲粮的营养价值评定。目前,人们对桑叶的研究多集中在用其替代蛋白质饲料[5]和提取、利用它的活性成分[6]上,缺少将桑叶直接作为粗饲料利用并且是否与羊草之间存在组合效应的研究。因此,本试验拟采用人工瘤胃技术,将桑叶与羊草以不同比例混合作为发酵底物,测定产气参数和发酵指标,进而评价两者之间的组合效应,旨在探究桑叶作为反刍动物粗饲料的饲用价值以及与羊草之间的最佳组合比例。
1 材料与方法
1.1 试验材料
本试验所用桑叶和羊草分别由中国农业科学院蚕业研究所和扬州大学试验农牧场提供。桑叶和羊草采集后,经65 ℃烘干制成风干样并粉碎过40目筛保存,参照张丽英[7]主编的《饲料分析及饲料质量检测技术》测定样品中的DM和粗灰分(Ash)含量,参照GB/T 6433—2006《饲料中粗脂肪的测定》[7]测定样品中的粗脂肪(EE)含量,应用凯氏定氮法测定样品中的粗蛋白质(crude protein,CP)含量,利用Van Soest氏法测定样品中的中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)含量。
1.2 试验动物及瘤胃液的采集
本试验选取4头健康状况良好、体重相近、装有永久性瘤胃瘘管的萨能山羊为瘤胃液供体。山羊的饲粮为燕麦草,同时补饲精料(玉米∶豆粕=6∶4),日喂2次(08:00和17:00),自由饮水。试验当天于晨饲前,利用自制真空负压装置,从3只瘘管羊瘤胃中抽取瘤胃液,混匀后迅速经4层纱布过滤,装入39 ℃预热并充满二氧化碳(CO2)的保温瓶中,带回实验室后置于39 ℃水浴锅中保温,并持续通入CO2以待接种。
1.3 人工唾液的配制
参照Cone等[8]的方法配制人工唾液,将8.75 g碳酸氢钠(NaHCO3)、1.00 g碳酸氢铵(NH4HCO3)、1.43 g磷酸氢二钠(Na2HPO4)、1.55 g磷酸二氢钾(KH2PO4)、0.15 g七水合硫酸锰(MgSO4·7H2O)、0.52 g硫化钠(Na2S)、0.015 g四水合氯化锰(MnCl2·4H2O)、0.002 g六水合氯化钴(CoCl2·6H2O)、0.012 g六水合氯化铁(FeCl3·6H2O)、0.017 g二水合氯化钙(CaCl2·2H2O)和1.25 mg刃天青溶解在1 L蒸馏水中,接种前在39 ℃水浴锅中预热并持续缓慢通入高纯CO2直至pH为6.8。
1.4 试验设计
1.4.1 体外发酵产气试验
将桑叶与羊草分别按0∶100(T0组)、20∶80(T20组)、40∶60(T40组)、60∶40(T60组)、80∶20(T80组)、100∶0(T100组)的比例混合均匀作为发酵底物,营养水平见表1。称取0.5 g混合后的发酵底物于不同的100 mL发酵瓶中,每组7个重复。将50 mL人工唾液和25 mL瘤胃液迅速注入培养瓶中,并向瓶内持续通入CO2约5 s,后立即旋紧橡皮塞,将培养瓶与64路AGRS-Ⅲ型体外发酵产气自动记录装置的气路相连接,在39 ℃恒温下连续培养72 h。

表1 不同比例桑叶与羊草组合发酵底物的营养水平(干物质基础)
1.4.2 体外发酵批次培养试验
同上配制人工唾液和称取底物,再添加1个空白组,即发酵瓶中只有瘤胃液与人工唾液,每组设18个重复,在SHA-A型恒温振荡水浴锅中进行72 h的体外发酵培养。分别在培养开始后0、3、6、12、24、48、72 h进行取样[9],每次取出各组3个发酵瓶,用滤袋过滤出全部残渣并收集过滤出的培养液。将培养液分装至2个10 mL离心管和3个2 mL离心管中,置于-80 ℃冰箱保存,用于挥发性脂肪酸(VFA)、氨氮(NH3-N)和微生物蛋白(MCP)浓度等指标的测定。将残渣经洗涤、烘干后用于测定体外有机物消化率(IVDOM)。
1.5 体外发酵指标的测定
1.5.1 产气量和产气参数的计算
参照Ørskov等[10]提出的公式数据模型对各组的产气量数据进行非线性回归拟合:
GPt=a+b×(1-e-ct)。
式中:GPt为t时间点的累积产气量(mL/g DM);a为快速产气部分,即发酵初始时间点的产气量(mL/g DM);b为缓慢产气部分,即理论最大产气量(mL/g DM);c为体外发酵产气速率常数(mL/h),a+b表示潜在产气量(mL/g DM)。
1.5.2 VFA浓度的测定
VFA浓度参照Khorasani等[11]的方法用气相色谱测定。培养液经10 000×g离心10 min后取上清液1 mL,加入0.2 mL 20%的含60 mmol/L巴豆酸的偏磷酸溶液,混匀后经10 000×g离心,取0.4 μL上清液用于气相色谱仪(GC-9A,日本岛津公司)测定。总挥发性脂肪酸(TVFA)浓度为乙酸、丙酸和丁酸的浓度之和。
1.5.3 NH3-N浓度的测定
利用比色法测定NH3-N的浓度。取培养液4 mL经400×g离心10 min后取上清50 μL于10mL试管,依次加苯酚试剂(准确称取苯酚9.975 7 g,亚硝基铁氰化钾50.65 mg加水溶解并定容至1 000 mL)和次氯酸钠试剂(称取氢氧化钠5 g,加少量蒸馏水,冷却后加20 mL次氯酸钠混匀,定容至1 000 mL)各3 mL,混匀后经60 ℃水浴10 min后立即冷水冷却,用756型可见紫外分光光度计测定546 nm的吸光度值(OD546 nm)。
1.5.4 MCP浓度的测定
参照苏海涯[12]的方法测定培养液中MCP的浓度。标准曲线的制作:1)分别称取5、15、25、35、45和55 mg的酵母RNA于10 mL离心管中,并加入2 mL 0.6 mol/L的高氯酸(HClO4)于90~95 ℃水浴1 h,冷却;2)再分别加入6 mL 28.5 mmol/L磷酸二氢铵(NH4H2PO4)溶液,于90~95 ℃15 min,冷却后在3 000×g离心10 min;3)取1.6 mL上清液,向上清液中加入6 mL 0.2 mol/L NH4H2PO4溶液,并用浓硫酸调整溶液pH为2~3;4)取调整pH后的溶液3.8 mL,并向其中加入0.2 mL 0.4 mol/L 硝酸银(AgNO3)溶液,混合后
于5 ℃条件下避光过夜;5)过夜后于3 000×g离心10 min,弃上清液,用4.5 mL蒸馏水(用浓硫酸调pH为2)冲洗沉淀,再于3 000×g离心10 min,弃上清液;6)向沉淀中加入5 mL 0.5 mol/L HCl,混匀在90~95 ℃条件下水浴30 min,以3 000×g离心10 min;7)上清液用0.5 mol/L HCl稀释40倍后,以0.5 mol/L HCl作参比,在260 nm下比色,根据吸光度值作标准曲线。
培养液中MCP浓度的测定:取8 mL培养液于3个10 mL离心管,在20 000×g条件下离心20 min,弃上清液后加入2.104 mL 0.6 mol/L HClO4,于90~95 ℃水浴1 h,冷却;按标准曲线制作的步骤2~6进行操作;以0.5 mol/L HCl作参比,在260 nm下比色,根据吸光度值和标准曲线求出RNA测定值,再根据以下公式计算MCP浓度:
MCP浓度(mg/mL)=RNA测定值(mg/mL)× RNA含氮量(17.83%)×稀释倍数×6.25/ 细菌中RNA含氮量(10%)。
1.5.5 IVDOM和培养液pH的测定
IVDOM的测定参照张丽英[7]主编的《饲料分析及饲料质量检测技术》中的方法,计算公式如下:
IVDOM(%)=100×[m1-(m2-m3)]/m1。
式中:m1为底物有机物含量(g);m2为残渣的有机物含量(g);m3为空白组残渣有机物含量(g)。
使用pHS-3C型pH计测定培养液的pH。
1.5.6 组合效应的评估公式
加权估算值=T0组测定值×羊草的比例+ T100组测定值×桑叶的比例[13]; 单项组合效应指数(SFAEI,%)=100×(实测值- 加权估算值)/加权估算值[13]; 组合效应综合指数(MFAEI,%)=∑SFAEI= SFAEI累积产气量+SFAEIIVDOM+SFAEIMCP+ SFAEINH3-N+SFAEITVFA[14]。
1.6 数据统计分析
各试验数据经Excel 2016进行整理,利用SPSS 22.0统计软件的one-way ANOVA进行单因素方差分析,使用LSD法进行多重比较,P<0.05为显著差异。
2 结 果
2.1 不同比例桑叶与羊草组合对72 h体外发酵产气参数的影响
由表2可知,随着桑叶比例的提高,理论最大产气量、潜在产气量和累积产气量呈现逐渐升高的趋势。T100组的理论最大产气量、潜在产气量和累积产气量都显著高于其他各组(P<0.05),T0、T20和T40组之间的这3个指标没有显著差异(P>0.05)。
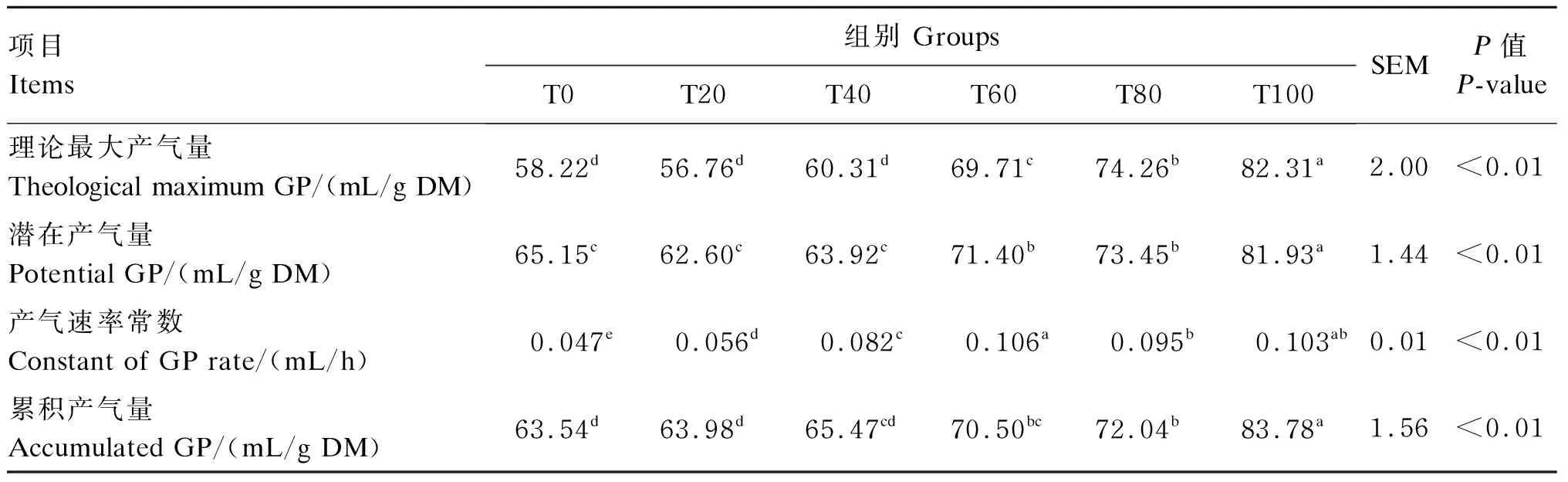
表2 不同比例桑叶与羊草组合对72 h体外发酵产气参数的影响
同行数据肩标无字母或相同字母时表示差异不显著(P>0.05),肩标不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2 不同比例桑叶与羊草组合对72 h体外发酵培养液pH的影响
由表3可知,随着时间的延长,培养液pH呈现下降趋势。在3、6和12 h时,各组培养液pH没有显著差异(P>0.05);在24 h时,T100组的培养液pH显著低于T0、T20和T40组(P<0.05);在48和72 h时,T60、T80和T100组的培养液pH都显著低于T0、T20和T40组(P<0.05)。
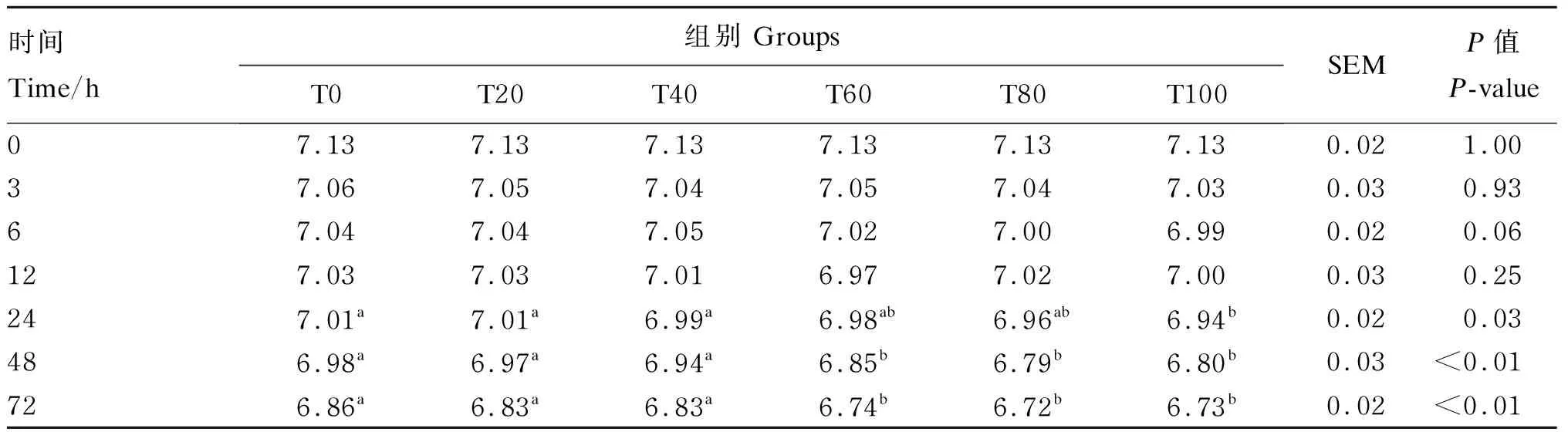
表3 不同比例桑叶与羊草组合对72 h体外发酵培养液pH的影响
2.3 不同比例桑叶与羊草组合对72 h体外发酵培养液VFA浓度的影响
由表4可知,随着时间的延长,各组培养液乙酸和丙酸的浓度总体呈现先升高趋势。在12和48 h时,T80组的培养液乙酸和TVFA的浓度显著高于其他各组(P<0.05)。在72 h时,T60、T80和T100组的培养液乙酸和TVFA的浓度没有显著差异(P>0.05),但均显著高于其他各组(P<0.05)。在12和48 h时,T80和T100组的培养液丙酸浓度显著高于其他各组(P<0.05)。在12、72 h时,T60、T80组的培养液乙酸/丙酸显著高于其他各组(P<0.05)。

表4 不同比例桑叶与羊草组合对72 h体外发酵培养液VFA浓度的影响
2.4 不同比例桑叶与羊草组合对72 h体外发酵培养液NH3-N浓度的影响
由表5可知,随着时间的延长,各组培养液NH3-N的浓度呈上升趋势。在3 h时,T40、T60、T80和T100组的NH3-N浓度要显著高于T0组(P<0.05);在6、12和72 h时,T60、T80和T100组的培养液NH3-N浓度显著高于T0、T20和T40组(P<0.05);在24 h时,T60组的NH3-N浓度显著高于其他各组(P<0.05);在48 h时,T80组NH3-N浓度显著高于T0、T20、T40和T60组(P<0.05)。

表5 不同比例桑叶与羊草组合对72 h体外发酵NH3-N浓度的影响
2.5 不同比例桑叶与羊草组合对72 h体外发酵培养液MCP浓度的影响
由表6可知,在12和48 h时,T60、T80和T100组的培养液MCP浓度没有显著差异(P>0.05),在72 h时,T60和T100组的培养液MCP浓度没有显著差异(P>0.05),但都显著高于其他各组(P<0.05)。在6和24 h时,T100组的培养液MCP浓度显著高于其他各组(P<0.05)。
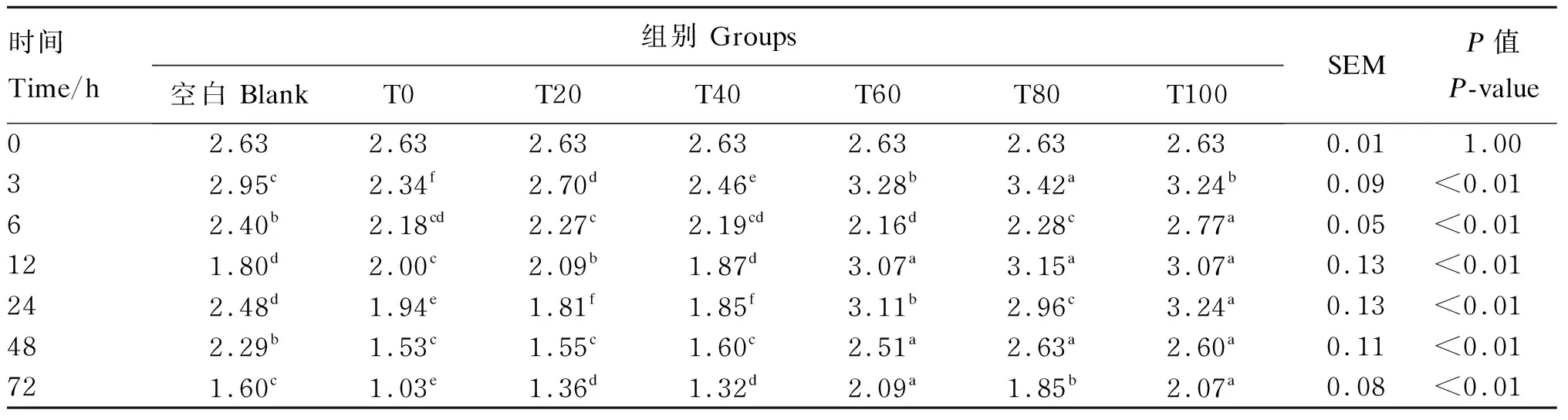
表6 不同比例桑叶与羊草组合对72 h体外发酵培养液MCP浓度的影响
2.6 不同比例桑叶与羊草组合对72 h体外发酵IVDOM的影响
由表7可知,随着时间的延长和桑叶比例的提高,IVDOM呈现升高的趋势。在6、24、48和72 h时,T100组的IVDOM显著高于其他各组(P<0.05)。

表7 不同比例桑叶与羊草组合对72 h体外发酵IVDOM的影响
2.7 不同比例桑叶与羊草的组合效应指数
由表8可知,T40组累积产气量、TVFA、MCP和NH3-N的SFAEI和MFAEI,以及T20和T80组累积产气量、T20组NH3-N的SFAEI存在负组合效应,而其他各组指标则都是正组合效应或不存在组和效应。T60组MCP、TVFA和NH3-N的SFAEI高于其他各组,IVDOM的SFAEI随着桑叶比例的提高有降低的趋势。T60组的MFAEI高于其他各组。
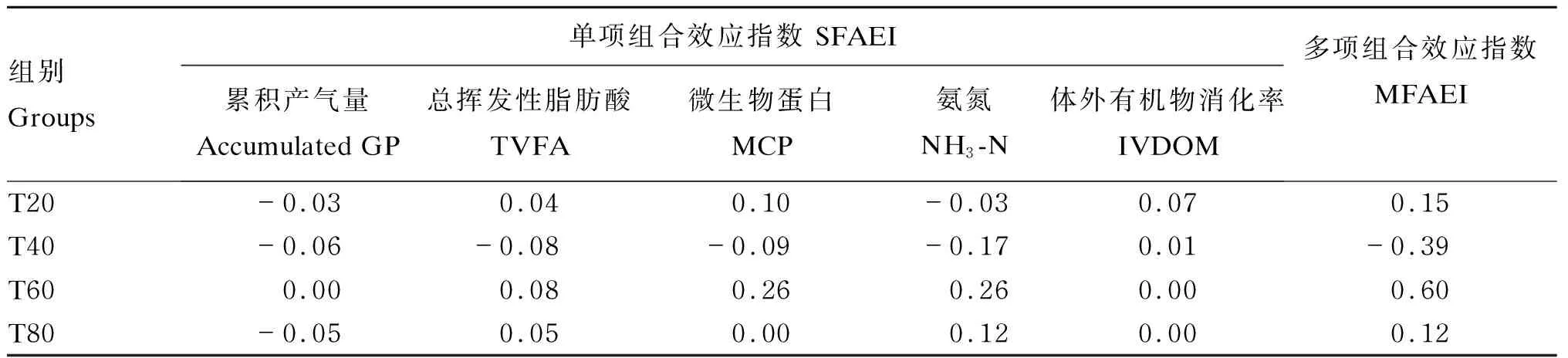
表8 不同比例桑叶与羊草的组合效应指数
3 讨 论
3.1 桑叶与羊草组合对产气参数的影响
产气量的多少可以反映饲料的可发酵程度的高低,它由瘤胃微生物的降解能力与发酵底物的自身特性共同决定[15],其中底物中的CP较容易被发酵,NDF则不易被发酵。Nsahlai等[16]研究发现,体外发酵的累积产气量与发酵底物的CP含量呈正相关,而与底物的NDF含量呈负相关关系。在本试验中,桑叶的CP含量高于羊草,而NDF含量则低于羊草,随着桑叶比例的提高,底物中CP含量提高,NDF含量降低,累积产气量也随之升高。此外,Liu等[17]将稻草与桑叶以不同比例混合作为底物进行体外发酵产气试验,发现随着桑叶比例的提高,累积产气量也随之提高,与本试验的结果一致。
3.2 桑叶与羊草组合对培养液pH的影响
pH的高低可以在一定程度上反映瘤胃的发酵情况,瘤胃微生物适宜生长繁殖的pH范围是6~7。在本试验中,由于体外发酵会导致VFA的积累,从而使培养液的pH随着时间的延长呈现下降的趋势,但均在适宜范围内,不会影响瘤胃微生物的活性。
3.3 桑叶与羊草组合对培养液VFA浓度的影响
饲粮中的多糖分解产生的单糖被瘤胃微生物摄取后,在细胞内酶的作用下迅速地被降解为VFA,它们是反刍动物主要的能量来源。瘤胃液中VFA的比例和浓度与饲粮的组成有关,当饲粮中的纤维含量提高时,瘤胃液中TVFA浓度降低,但其中乙酸比例会有所提高[18]。Allen[19]和韩继福等[20]都发现,瘤胃液中乙酸浓度与饲粮中NDF含量间具有高度的正相关。本试验中,随着桑叶比例的提高,底物中NDF的含量降低,而乙酸和丙酸的浓度都呈现先上升后下降的趋势,其中T60和T80组的乙酸和丙酸浓度要高于其他各组。这可能是由于桑叶的可发酵性高于羊草,更容易被微生物分解利用,所以桑叶能快速发酵产生乙酸、丙酸等VFA,从而使乙酸和丙酸的浓度随着桑叶比例的增加而提高,且桑叶与羊草存在组合效应使T60和T80组乙酸和丙酸浓度要高于T0和T100组的乙酸和丙酸的浓度,这与孙丽莎[21]研究蚕沙和稻秸的组合效应的试验结果一致。
3.4 桑叶与羊草组合对培养液NH3-N浓度的影响
瘤胃中的NH3-N是瘤胃微生物的主要氮源,适宜的NH3-N浓度可以促进瘤胃微生物的生长繁殖,而NH3-N浓度过高会造成氮源浪费,过低则会限制瘤胃微生物的活力。在本试验第6、12和72 h时,T60、T80和T100组的NH3-N浓度都要显著的高于其他3组,由于培养液中的NH3-N主要来自瘤胃微生物对底物中含氮物质的降解所产生,而这3组底物中的蛋白质含量要高于其他3组,从而可能造成了NH3-N浓度的升高。
3.5 桑叶与羊草组合对培养液MCP浓度的影响
MCP是反刍动物最主要的蛋白质供应者,它能提供反刍动物蛋白质需要的40%~80%。饲粮的类型对MCP的合成有显著影响。Stern等[22]研究发现,饲粮的碳水化合物和蛋白质以及两者的同步分解水平决定着瘤胃微生物的生长,从而能改变MCP的合成效率。本试验中,随着桑叶比例的提高,底物中优质蛋白质的含量提高,MCP浓度有着升高的趋势,这与李妍等[23]的研究结果相一致。
3.6 桑叶与羊草组合对IVDOM的影响
饲粮中粗纤维含量越高,消化率越低,而CP含量越高,消化率则越高。刘洁等[24]研究发现IVDOM和饲料中的CP和NDF含量显著相关。Menke等[25]研究发现IVDOM与累积产气量存在高度正相关的关系。本试验中,随着桑叶比例的提高,CP含量升高,NDF含量降低,累积产气量和IVDOM都随之提高,与前人的研究结果一致。
3.7 桑叶与羊草的组合效应
卢德勋[26]针对体外培养中多时间点、多指标组合效应进行评估,提出用MFAEI将体外发酵所测得的各项指标进行综合量化,再来评定饲粮间的组合效应。因此,本试验综合考虑累积产气量、VFA、NH3-N、MCP和IVDOM几个因素进行计算分析,发现72 h时组合效应最大的组合是T60组,而T40组出现了负组合效应,这可能是由于本试验只考虑了72 h这1个时间点的MFAEI,存在时间上一定的片面性,从而出现了暂时的负组合效应,对总体的试验结果并没有影响。在实际生产中,羊的饲粮中添加了精料,由于精料更容易被瘤胃微生物分解利用,在饲粮进入在羊的瘤胃后,精料会迅速发酵成短链脂肪酸等物质,期间伴随着极少部分的粗料被降解,而在精料快被利用完全时,瘤胃微生物才会去利用较难分解的粗料,所以体外桑叶与羊草的最佳比例在实际生产中也具有一定的参考价值。
4 结 论
桑叶与羊草的组合能够改善体外瘤胃发酵特性,即存在正组合效应,其中桑叶与羊草的最佳比例为60∶40。
[1] 侯启瑞,赵卫国,王梦芝,等.桑叶粉添加量对獭兔脂质代谢和肝脏抗氧化能力的影响[J].江苏科技大学学报(自然科学版),2017,31(4):550-554.
[2] 赵鹤.羊草对奶牛营养价值及其日粮组合效应的研究[D].硕士学位论文.大庆:黑龙江八一农垦大学,2008.
[3] 张子仪.中国饲料学[M].北京:中国农业出版社,2000:289-290.
[4] MENKE K H,RAAB L,SALEWSKI A,et al.The estimation of the digestibility and metabolizable energy content of ruminant feeding stuffs from the gas production when they are incubated with rumen liquorinvitro[J].The Journal of Agricultural Science,1979,93(1):217-222.
[5] HUYEN N T,WANAPAT M,NAVANUKRAW C.Effect of mulberry leaf pellet (MUP) supplementation on rumen fermentation and nutrient digestibility in beef cattle fed on rice straw-based diets[J].Animal Feed Science and Technology,2012,175(1):8-15.
[6] JESZKA-SKOWRON M,FLACZYK E,JESZKA J,et al.Mulberry leaf extract intake reduces hyperglycaemia in streptozotocin (STZ)-induced diabetic rats fed high-fat diet[J].Journal of Functional Foods,2014,8:9-17.
[7] 张丽英.饲料分析及饲料质量检测技术[M].2版.北京:中国农业大学出版社,2003.
[8] CONE J W,VAN GELDER A H,VISSCHER G J W,et al.Influence of rumen fluid and substrate concentration on fermentation kinetics measured with a fully automated time related gas production apparatus[J].Animal Feed Science and Technology,1996,61(1/2/3/4):113-128.
[9] YANG H J,TAMMINGA S,WILLIAMS B A,et al.Invitrogas and volatile fatty acids production profiles of barley and maize and their soluble and washout fractions after feed processing[J].Animal Feed Science and Technology,2005,120(1/2):125-140.
[10] ØRSKOV E R,MCDONALD I.The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J].The Journal of Agricultural Science,1979,92(2):499-503.
[11] KHORASANI G R,OKINE E K,KENNELLY J J.Forage source alters nutrient supply to the intestine without influencing milk yield[J].Journal of Dairy Science,1996,79(5):862-872.
[12] 苏海涯.反刍动物日粮中桑叶与饼粕类饲料间组合效应的研究[D].硕士学位论文.杭州:浙江大学,2002.
[13] 闫伟杰.饼粕蛋白与羊草NDF/玉米淀粉混合料的组合效应研究[D]硕士学位论文.杭州:浙江大学,2005.
[14] 王旭.利用GI技术对粗饲料进行科学搭配及绵羊日粮配方系统优化技术的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2003.
[15] 杨红建,黎大洪,谢春元,等.阿魏酸酯酶处理对羊草、玉米秸、稻秸及麦秸瘤胃体外发酵特性的影响[J].动物营养学报,2010,22(1):207-211.
[16] NSAHLAI I V,SIAW D,OSUJI P O.The relationships between gas production and chemical composition of 23 browses of the genusSesbania[J].Journal of the Science of Food and Agriculture,1994,65(1):13-20.
[17] LIU J X,SUSENBETH A,SÜDEKUM K H.Invitrogas production measurements to evaluate interactions between untreated and chemically treated rice straws,grass hay,and mulberry leaves[J].Journal of Animal Science,2002,80(2):517-524.
[18] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004:340-360.
[19] ALLEN M S.Relationship between fermentation acid production in the rumen and the requirement for physically effective fiber[J].Journal of Dairy Science,1997,80(7):1447-1462.
[20] 韩继福,冯仰廉,张晓明,等.日粮类型和羊草细度对肉牛瘤胃挥发性脂肪酸比例及能量转化效率的影响[J].畜牧兽医学报,1998,28(2):97-104.
[21] 孙丽莎.蚕沙的饲用价值评定及其在肉羊饲养中的利用[D].硕士学位论文.扬州:扬州大学,2015.
[22] STERN M D,VARGA G A,CLARK J H,et al.Evaluation of chemical and physical properties of feeds that affect protein metabolism in the rumen[J].Journal of Dairy Science,1994,77(9):2762-2786.
[23] 李妍,韩肖敏,李建国,等.体外法评价玉米秸秆、谷草和玉米秸秆青贮饲料组合效应研究[J].草业学报,2017,26(5):213-223.
[24] 刘洁,刁其玉,屠焰,等.肉用绵羊饲料有机物体外消化率预测模型的研究[C]//中国畜牧兽医学会养羊学分会2012全国养羊生产与学术研讨会议论文集.横山:中国畜牧兽医学会,2012:299-302.
[25] MENKE K H,STEINGASS H.Estimation of the energetic feed value obtained from chemical analysis andinvitrogas production using rumen fluid[J].Animal Research and Development,1988,28:7-55.
[26] 卢德勋.系统动物营养学导论[M].北京:中国农业出版社,2004.
