颅脑超声联合血清神经元特异性烯醇化酶、S100B及白细胞介素-6检测对早产儿脑白质损伤的诊断价值
2018-06-14李宏伟王洁翡
李宏伟,王洁翡,艾 亮,张 静
(1.郑州市妇幼保健院超声科,河南 郑州 450012;2.郑州市妇幼保健院新生儿科,河南 郑州 450012;3.郑州市妇幼保健院检验科,河南 郑州 450012;4.郑州市妇幼保健院女性康复科,河南 郑州 450012)
随着新生儿科医疗水平的不断提高,早产儿死亡率得以控制,但早产儿脑损伤发病率却逐年上升[1]。脑损伤中最常见的为脑白质损伤,其为大脑白质细胞受到缺氧和感染等因素影响而导致功能损伤,且主要侵犯发育尚不成熟早产儿的一类神经系统疾病[2]。研究显示,极低体质量出生儿中脑白质损伤发病率高达50%,且极易形成脑瘫[3]。早产儿脑白质损伤的预后与早期诊断和早期干预密切相关,但脑白质损伤临床症状不显著,目前主要依赖颅脑超声作为筛查方案,而其对于直径较小的囊性病灶和非囊性病灶诊断价值有限,且易受仪器、操作和前囟门大小等因素影响,因而其应用受到限制[4]。CT多用于新生儿晚期脑白质损伤的诊断评价,磁共振成像(magnetic resonance imaging,MRI)则不便于长期监测且费用较高[5]。近年来研究发现,血清生物化学标志物如神经元特异性烯醇化酶(neuron-specific enolase,NSE)、S100B及白细胞介素-6(interleukin-6,IL-6)可在脑白质受损的24 h内显著升高且与神经受损程度密切相关[6-7],可能成为脑白质受损早期诊断的血清标志物,但其无法获取病灶位置和大小等影像学资料。因此,本研究旨在探讨颅脑超声联合血清NSE、S100B及IL-6检测对早产儿脑白质损伤的早期诊断价值。
1 资料与方法
1.1一般资料选择2016年8月至2017年7月郑州市妇幼保健院新生儿科收治的出生当日经颅脑MRI诊断为脑白质损伤的早产儿39例为观察组,其中男25例,女14例,胎龄30~34(32.5±1.7)周;脑白质损伤诊断均符合中国医师协会新生儿专业委员会制定的早产儿脑损伤诊断标准[8]。另选择同期出生当日经颅脑MRI诊断为无脑白质损伤的早产儿30例为对照组,其中男19例,女11例,胎龄30~34(32.9±1.5)周。入选标准:(1)胎龄低于35周;(2)排除神经系统畸形、胆红素脑病、坏死性结肠炎、蛛网膜下腔出血、脑实质出血以及产前母体存在影响妊娠结局的严重疾患;(3)患儿家属均签署了知情同意书。2组患儿的性别、胎龄比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。
1.22组患儿血清NSE、S100B及IL-6水平检测分别于出生后1、3、7 d采集2组患儿的静脉血3 mL,3 000 r·min-1离心5 min,分离血清,-80 ℃冰箱保存,采用全自动时间分辨荧光免疫分析系统(美国雅培公司)及其配套试剂和定标品检测血清NSE水平;采用双抗体夹心酶联免疫吸附试验测定血清S100B、IL-6水平,实验操作严格按照试剂盒(美国ADL公司)说明进行。
1.3颅脑超声检查2组患儿分别于出生后1、3、7 d,采用迈瑞M9超声诊断仪(深圳迈瑞生物医疗电子股份有限公司)行颅脑超声检查,使用扇形小凸阵式扫描探头,采用4~10 MHz频率工作,选取侧脑室中央部矢状及冠状切面图像资料观测双侧脑白质,回声增强、粗糙、不均匀为异常,弥散性损伤则呈现自脑室周围向外辐射性弥散至皮下层。观察脑白质回声与周围组织的灰度值变化差异,使用灰度值分析软件获取异常影像图的灰度值数值。
1.4出生后1d时颅脑超声、IL-6、NSE和S100B检测脑白质损伤的灵敏度和特异度以灵敏度为纵坐标,1-特异性为横坐标,绘制受试者工作特征(receiver operating characteristic,ROC)曲线。灵敏度=真阳性人数/(真阳性人数+假阴性人数)×100%,特异度=真阴性人数/(真阴性人数+假阳性人数)×100%。计算颅脑超声、IL-6、NSE和S100B单一指标及联合检测时诊断脑白质损伤的灵敏度和特异度。

2 结果
2.12组患儿颅脑超声检查结果出生后1、3、7 d,对照组患儿脑白质损伤检出率分别为6.45%(2/31)、3.23%(1/31)和0.00%(0/31),观察组患儿脑白质损伤检出率分别为92.31%(36/39)、87.18%(34/39)和84.62%(33/39);出生后1、3、7 d 观察组患儿脑白质损伤的检出率均显著高于对照组,差异有统计学意义(χ2=51.30、48.69、49.63,P<0.05)。对照组、观察组患儿出生后1、3、7 d脑白质的灰度值组内比较差异均无统计学意义(P>0.05);出生后1、3、7 d,观察组患儿脑白质的灰度值与对照组比较均显著增高,差异有统计学意义(P<0.05);见表1。
表12组患儿出生后1、3、7d脑白质灰度值比较
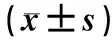
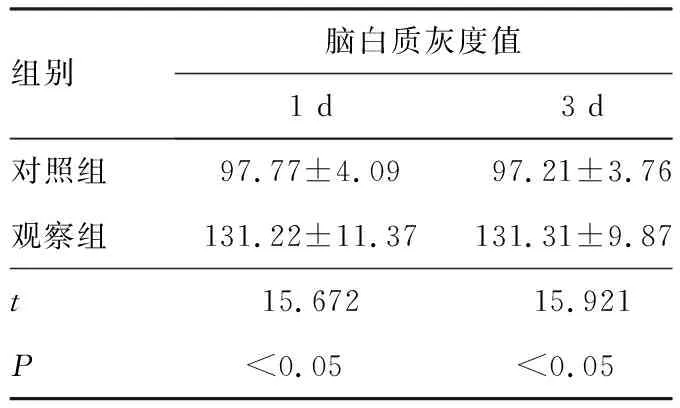
组别脑白质灰度值1 d3 d7 d对照组97.77±4.09 97.21±3.7697.35±3.32观察组131.22±11.37131.31±9.87129.76±10.09t15.67215.92114.764P<0.05<0.05<0.05
2.22组患儿血清NSE、S100B和IL-6水平比较结果见表2。出生后1、3、7 d,对照组患儿血清S100B、IL-6水平比较差异无统计学意义(F=0.319、0.307,P>0.05);对照组患儿血清NSE水平比较差异有统计学意义(F= 3.298,P<0.05),其中出生后3、7 d血清NSE水平显著低于出生后1 d(P<0.05),出生后7 d血清NSE水平显著低于出生后3 d(P<0.05)。观察组患儿出生后1、3、7 d 血清NSE、S100B、IL-6水平均呈现下降趋势(F=3.323、3.517、3.706,P<0.05),其中出生后3、7 d,观察组患儿血清NSE、S100B、IL-6水平与出生后1 d比较显著下降(P<0.05),出生后7 d观察组患儿血清NSE、S100B、IL-6水平与出生后 3 d 比较差异无统计学意义(P>0.05);但与对照组比较,观察组患儿出生后1、3、7 d血清NSE、S100B、IL-6水平较均显著增高,差异有统计学意义(P<0.05)。
表22组患儿不同时间点血清NSE、S100B和IL-6水平比较
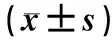
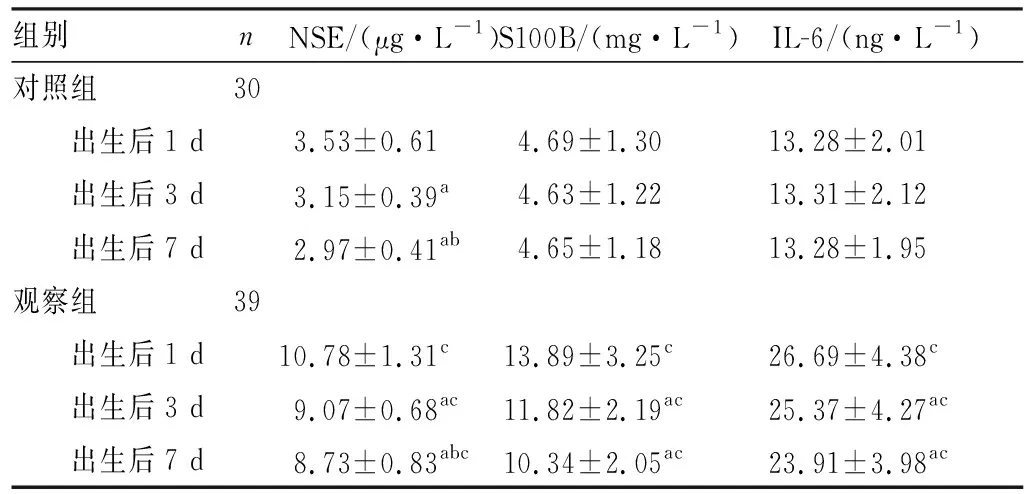
组别nNSE/(μg·L-1)S100B/(mg·L-1)IL-6/(ng·L-1)对照组30 出生后1 d3.53±0.61 4.69±1.30 13.28±2.01 出生后3 d3.15±0.39a4.63±1.2213.31±2.12 出生后7 d2.97±0.41ab4.65±1.1813.28±1.95观察组39 出生后1 d10.78±1.31c13.89±3.25c26.69±4.38c 出生后3 d9.07±0.68ac11.82±2.19ac25.37±4.27ac 出生后7 d8.73±0.83abc10.34±2.05ac23.91±3.98ac
注:与出生后1 d比较aP<0.05;与出生后3 d比较bP<0.05;与对照组同时间点比较cP<0.05。
2.3观察组患儿颅脑超声脑白质灰度值与血清NSE、S100B和IL-6的相关性观察组患儿出生后1 d时的颅脑超声脑白质灰度值与血清NSE、S100B和IL-6均呈显著正相关(r=3.137、3.358、3.056,P<0.05);在出生后3 d时脑白质灰度值与血清S100B和NSE呈显著正相关(r=2.872、2.347,P<0.05),而与IL-6无显著相关性(r=0.982,P>0.05);出生后7 d时脑白质灰度值仅与S100B呈显著正相关(r=2.791,P<0.05),而与NSE和IL-6之间无显著相关性(r=1.107、0.836,P>0.05)。
2.4出生后1d时ROC曲线诊断结果及诊断灵敏度及特异度比较结果见表3。血清NSE、S100B、IL-6的诊断曲线下面积分别为0.891、0.938、0.831。单个指标中S100B的灵敏度最高(100.00%),颅脑超声的特异度最高(90.32%),S100B的准确性最高(94.29%);IL-6因其灵敏度(84.62%)、特异度(80.65%)和准确性(82.86%)均较差而被排除出联合检测,颅脑超声+NSE+S100B联合检测脑白质损伤具有较高的诊断灵敏度(100.00%)、特异度(93.54%)和准确性(97.14%)。
表3出生后1d时颅脑超声、NSE、IL-6及S100B诊断脑白质损伤的价值
Tab.3Diagnosticvalueofcranialultrasonicexamination,serumNSE,S100BandIL-6onthewhitematterlesionsofprematureinfantsonthe1stdayafterbirth
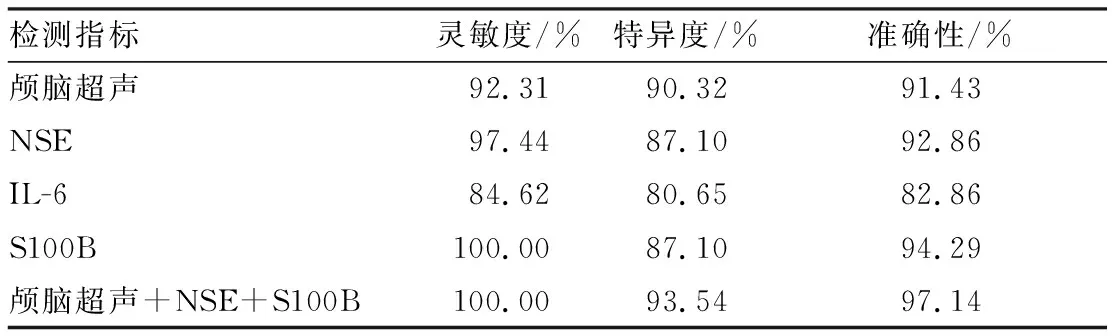
检测指标灵敏度/%特异度/%准确性/%颅脑超声92.3190.3291.43NSE97.4487.1092.86IL-684.6280.6582.86S100B100.0087.1094.29颅脑超声+NSE+S100B100.0093.5497.14
3 讨论
脑白质损伤可诱发脑性瘫痪或智力障碍,严重影响儿童健康成长及人口素质,加重家庭和社会负担,早期干预成为改善预后的关键问题[9-10]。目前研究认为,早产儿脑白质损伤与其脑部未成熟发育、缺氧缺血及感染等因素密切相关[11]。早期患儿临床症状不显著且具有非特异性,故依据症状无从判断,而早期轻微病理改变时展开干预可以改善预后甚至逆转病情,避免疾病进展。
影像学检查在早产儿脑白质损伤筛查中有重要作用,由于早产儿存在脑部发育缺陷风险,出生后应做影像学筛查。头颅超声检查因其便捷、价格低廉且无射线等优势已成为筛查的首选手段。目前,临床推荐对于胎龄低于30周的早产儿在出生后均要行头颅超声检查,并在校正胎龄36~40周进行复查[12]。有研究发现,脑白质的超声灰度值与脑白质损伤程度呈显著正相关,说明颅脑超声对于脑白质损伤诊断价值很高[13],但其灵敏度和特异度较MRI低,而MRI费用高,不便于长期监测且不便于床旁检查等,因此,探索以超声为基础的新诊断方案显得尤为重要。
本研究结果显示,观察组早产儿出生后1、3、7 d,颅脑超声检查的脑白质损伤检出率分别为92.31%、87.18%和84.62%,而对照组早产儿检出率分别为6.45%、3.23%和0.00%,观察组早产儿脑白质损伤的检出率较高。但有研究报道,颅脑超声对于直径较小的囊性病灶或非囊性病灶诊断灵敏度和阳性预测值均较低,漏诊率较大[5]。此外,颅脑超声实际应用中存在成像质量过度依赖操作者的技术和经验、部分脑部异常难以发现等情况。虽然本研究利用颅脑超声对早产儿脑白质损伤的检出率较高,但仍存在部分病例漏诊和误诊情况,这与曹立杰等[14]的研究结果类似,因此,利用颅脑超声检查脑白质损伤需要联合其他项目方可提高诊断准确性。而CT和MRI对早期脑白质损伤诊断不敏感,多用于晚期患儿随访时评价脑部发育,且因价格昂贵、存在辐射及无法搬运等而不利于连续监测。近年来研究发现,多种血清生物化学标志物在早产儿脑白质损伤早期即可出现高水平表达,且持续时间较长,或可成为诊断新指标,其中NSE、IL-6和S100B已被证实在早产儿脑白质损伤早期即显著上调[15-17],这与本研究结果一致。此外,本研究还发现,脑白质损伤患儿出生后1、3、7 d血清NSE、IL-6和S100B水平均显著高于脑白质无损伤早产儿。陆俊秀等[18]发现NSE与颅脑超声灰度值存在显著正相关,与本研究一致。本研究发现,血清S100B在观察组患儿出生后1、3、7 d时处于较高水平,但随着时间推移存在下降趋势。这与金越等[17]在早产儿脑白质损伤组中发现尿液S100B随着时间推移呈先上升后下降趋势的结果有所差异,推测可能是血、尿S100B代谢差异造成。此外,本研究还发现,观察组患儿出生后1 d血清NSE、IL-6和S100B水平均与颅脑超声灰度值呈显著正相关,而在出生后3 d时血清NSE和S100B与颅脑超声灰度值呈显著正相关,在出生后7 d仅血清S100B与颅脑超声灰度值呈显著正相关,提示NSE、IL-6和S100B或可成为脑白质损伤较好的诊断指标,且NSE和S100B相较IL-6与脑损伤关系更密切;而ROC曲线证实了这一结论,NSE和S100B的ROC曲线下面积较大,IL-6的ROC曲线下面积较小;此外,在诊断早产儿脑白质损伤时,S100B的灵敏度高达100.00%,颅脑超声特异度最强(90.32%),S100B的准确性最高(94.29%),而IL-6的灵敏度、特异度和准确性均较差,因此被排除出联合检测,而颅脑超声、NSE、S100B联合检测脑白质损伤可显著提高诊断早产儿脑白质损伤的灵敏度(100.00%)、特异度(93.54%)和准确性(97.14%)。
综上所述,颅脑超声仍是目前早产儿脑白质损伤的首选影像学诊断方法,此外,血清NSE和S100B亦可成为辅助诊断和连续监测的生物化学标志物,颅脑超声、NSE、S100B联合检测可显著提高脑白质损伤早期诊断的准确性,降低误诊和漏诊情况。
参考文献:
[1] 徐发林,李衡,程慧清,等.枸橼酸咖啡因对感染所致新生大鼠脑白质损伤的保护作用[J].中华实用儿科临床杂志,2017,32(14):1085-1088.
[2] 侯新琳.早产儿脑白质损伤诊断、防治与综合管理的专家组意见[J].中国新生儿科杂志,2015,30(3):175-177.
[3] PEYTON C,YANG E,MSALL M E,etal.White matter injury and general movements in high-risk preterm infants[J].AJNRAmJNeuroradiol,2017,38(1):162-169.
[4] 刘芳利,周柳英.超声对胎儿脑白质软化的诊断价值[J].中国计划生育和妇产科,2016,8(8):62-66.
[5] 张素娥,薛辛东,富建华.早产儿脑白质损伤的影像学研究进展[J].中国新生儿科杂志,2011,26(5):350-352.
[6] 艾雪梅,张莹,张亚平,等.脑白质损伤早产儿血清S100B蛋白、神经元特异性烯醇化酶及肌酸激酶脑型同工酶的变化分析[J].中国妇幼保健,2015,30(1):57-59.
[7] 陆俊秀,陈敬国,陈海燕,等.脑白质病变早产儿神经节苷脂治疗前后血清IL-6、NSE和颅脑超声的变化及意义[J].广东医学,2012,33(16):2410-2412.
[8] 中国医师协会新生儿专业委员会.早产儿脑损伤诊断与防治专家共识[J].中国当代儿科杂志,2012,14(12):883-884.
[9] 张永芹.神经节苷脂对早产儿脑白质损伤的疗效及安全性[J].中国实用神经疾病杂志,2015,18(11):27-28.
[10] 王晶晶,陈超.早产儿脑病发生率的流行病学研究进展[J].中华实用儿科临床杂志,2015,30(10):796-798.
[11] 杨芹,王少华.早产儿脑白质损伤的发病机制及早期诊断方法的新进展[J].医学综述,2014,20(2):228-231.
[12] 王红利,廖华波,孙明洁.早产儿脑损伤与妊娠期内宫内感染的相关性分析[J].西藏医药,2017,38(3):12-15.
[13] 樊曦涌,周丛乐,王红梅,等.超声灰度值测定诊断围产期脑白质损伤的作用[J].中华围产医学杂志,2011,14(9):523-529.
[14] 曹立杰,于金玲,侯春蕾.颅脑B超在58例新生儿缺氧缺血性脑病早期诊断中的应用[J].哈尔滨医药,2009,29(6):54-55.
[15] INOMATA K,MIZOBUCHI M,TANAKA S,etal.Patterns of increases in interleukin-6 and C-reactive protein as predictors for white matter injury in preterm infants[J].PediatrInt,2015,56(6):851-855.
[16] 艾雪梅,张莹,张亚平,等.脑白质损伤早产儿血清S100B蛋白、神经元特异性烯醇化酶及肌酸激酶脑型同工酶的变化分析[J].中国妇幼保健,2015,30(1):57-59.
[17] 金越,张敏,鲍星星,等.S100B蛋白和行为神经评分对早产儿脑白质损伤的诊断价值[J].中华实用儿科临床杂志,2015,30(14):1110-1112.
[18] 陆俊秀,陈敬国,陈海燕.颅脑超声与血清NSE对早产儿脑白质损伤诊断价值及二者相关性分析[J].临床儿科杂志,2012,30(9):836-839.
