珠子参中HMGR基因对皂苷生物合成的影响
2018-06-12刘美佳于怡琳刘迪秋
刘美佳,于怡琳,姜 森,张 翔,葛 锋,刘迪秋
(昆明理工大学 生命科学与技术学院, 昆明 650500)
珠子参(Panaxjaponicus)为五加科(Araliaceae)人参属(Panax)植物,因根茎节间纤细,节膨大成球形念珠状而得名,其根茎入药。珠子参作为药材,始载于《滇南本草》,为历版《中国药典》收载品种。药用珠子参主产于云南,属名贵常用中药材,是彝族、纳西族、白族、藏族、僳族等少数民族的传统用药。珠子参性味苦、甘、微寒,归肝、肺、胃经,具有补肺养阴、祛瘀止痛、止血之功效,临床上应用于气阴两虚、烦热口渴、虚痨咳嗽、跌打损伤、关节疼痛、咳血、吐血、外伤出血等症状[1-2]。
珠子参皂苷(Panaxjaponicussaponins)为珠子参的主要活性成分,主要由达玛烷型三萜皂苷和齐墩果烷型三萜皂苷构成。目前,已从珠子参根茎叶中分离出40多种皂苷成分,主要包括竹节参皂苷Ⅳa、Ⅳ和Ⅴ,人参皂苷R0、Re、Rd和Rb1等[3-5]。与珠子参同为人参属的人参(Panaxginseng)主要含达玛烷型皂苷,齐墩果烷型皂苷仅发现含量极微的人参皂苷R0;而三七(Panaxnotoginseng)只含达玛烷型皂苷,不含齐墩果烷型皂苷[6-7]。珠子参所含皂苷组分与同属人参、三七相比,在成分种类以及各组分含量上均存在明显差异,因其含有大量齐墩果烷型皂苷,导致临床上的用途比较特殊[8]。现代药理学研究表明,珠子参皂苷具有抗炎镇痛、改善心肌缺血、增加脑血流量、抗肿瘤、免疫调节以及治疗白细胞减少症等功效[9-10]。
药用植物三萜类皂苷主要由甲羟戊酸(MVA)途径合成,因此珠子参皂苷也通过MVA途径合成[11-12]。近年来,与珠子参亲缘关系较近的人参、三七皂苷合成途径研究已取得重要进展,皂苷生物合成的上游、中游路径基本清楚,下游的皂苷骨架后修饰过程也在逐步获得解析[13]。通过MVA途径合成珠子参皂苷的过程如下:首先,两分子乙酰辅酶A(acetyl-coA)经过硫解反应缩合生成乙酰乙酰辅酶A(acetoacetyl-coA),此反应需在乙酰辅酶A酰基转移酶(acetyl-coA acyltransferase,AACT)的催化下完成(其中乙酰乙酰辅酶A是由一分子乙酰辅酶A脱去一个乙酰跟另一分子乙酰辅酶A乙酰基结合从而生成的物质)。乙酰乙酰辅酶A在乙酰辅酶A及羟甲酰戊二酰辅酶A合成酶(3-hydroxy-3-methylglutaryl CoA synthase,HMGS)的作用下合成3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)。HMG-CoA在关键酶3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)的催化作用下合成了甲羟戊酸(MVA),珠子参皂苷的合成正式进入到MVA途径,HMGR也因此成为MVA途径的首个关键酶[14]。随后,经过异戊烯基焦磷酸(IPP)、鲨烯合成酶(SS)、 鲨烯环氧酶(SE)和法呢基焦磷酸(FPS)等一系列催化反应,生成2, 3-氧化鲨烯,它是三萜皂苷及植物甾醇等的共同前体物质。2, 3-氧化鲨烯由达玛烯二醇合酶(DS)催化进入达玛烷型皂苷合成支路,同时,经由β-香树脂合成酶(AS)催化,进入齐墩果烷型皂苷合成支路(图1)。
近年来,对于珠子参皂苷的研究多集中于有益于人类健康及疾病防治的药理学领域,而珠子参皂苷生物合成途径相关基因的调控研究较少。已有研究表明HMGR是甲羟戊酸途径的第一个关键酶,通过调控HMGR基因的表达影响盾叶薯蓣皂苷的生物合成[15];此外,Tansakul等[16]研究表明过表达人参皂苷合成途径中关键酶基因会导致人参皂苷积累量的变化。由于珠子参与人参、三七同属,因此对珠子参皂苷生物合成中关键酶基因进行调控也可能会影响皂苷的合成。本研究选取珠子参皂苷生物合成途径中关键酶基因PjHMGR为研究对象,在珠子参细胞中过表达该基因,明确PjHMGR的功能及其在皂苷合成过程中的地位,为获得高效、稳定的珠子参皂苷合成调控技术提供理论参考和依据。
1 材料和方法
1.1 实验材料
珠子参药材来源于云南省玉龙县珠子参大棚,经云南大学虞泓教授鉴定为珠子参(Panaxjaponicus),本研究所用珠子参材料是本实验室诱导并培养的珠子参愈伤组织。研究所用农杆菌感受态细胞EHA105、大肠杆菌感受态细胞Trans1-T1和植物过表达载体pCAMBIA2300s均由本实验室保存;克隆载体pGEM-T和M-MVL逆转录试剂盒均购买于Promega公司;SanPrep柱式DNA胶回收试剂盒和质粒提取试剂盒均购于上海生工生物工程有限公司。
1.2 方 法
1.2.1珠子参RNA提取和cDNA第一链合成采用两步法提取珠子参总RNA。首先通过改良的异硫氰酸胍法进行初提,随后通过酚和氯仿抽提以及DNA酶消化处理纯化后,获得纯度较好的珠子参总RNA[17]。cDNA第一链的合成利用M-MVL逆转录试剂盒完成,将获得的cDNA 置于-20 ℃条件下保存备用。
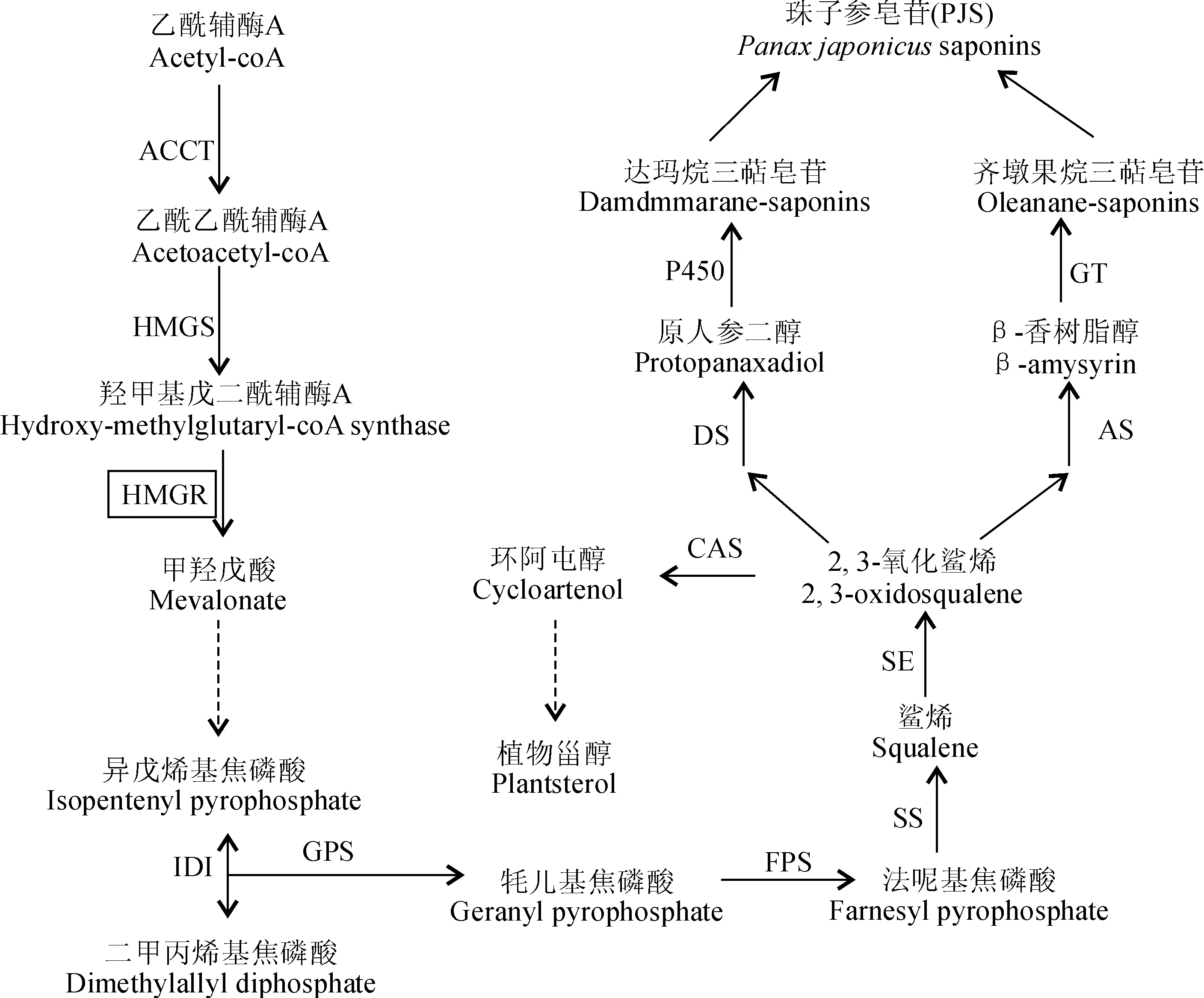
HMGR.3-羟基-3-甲基戊二酰辅酶A还原酶;FPS.法呢基焦磷酸;SS.鲨烯合成酶;SE.鲨烯环氧酶;DS.达玛烯二醇合成酶;AS.香树脂合成酶;CAS.环阿屯醇合成酶;GT.葡萄糖基转移酶;P450.细胞色素P450图1 珠子参皂苷及植物甾醇生物合成途径HMGR.3-hydroxy-3-methylglutaryl CoA reductase; FPS.Farnesylpyrophosphate synthase; AS.Amysyrin synthase; SS.Squalene synthase; SE.Squalene epoxidase; DS.Dammarenediol-II synthase; CAS.Cycloartenol synthase; GT.Glucosyl transferase; P450.Cytochromes P450Fig.1 The synthesis pathway of P. japonicus saponins and plant sterols
1.2.2PjHMGR基因克隆本研究首先根据NCBI公布的人参HMGR基因(AGV26444.1)设计特异性引物,以珠子参细胞RNA逆转录形成的cDNA为模板进行PCR扩增与测序,初步获得了珠子参HMGR基因序列。以获得的珠子参HMGR基因序列ORF为模板,设计特异引物PjHMGR-BamHⅠ-F(5′-CGCGGATCCCACCGAATCCTCCCACTAC-3′)和PjHMGR-KpnI-R(5′-CGGGGTACCTGACATATCCCGGCTTGAC-3′),再次PCR扩增及测序确认。克隆体系为:cDNA 模板5.0 μL,10×Buffer 5.0 μL,Extaq酶 0.5 μL,dNTPs 4.0 μL,10 μmol/L上下游引物 0.5 μL,Nuclease-free water(无核酸酶的水) 34.5 μL,总体系为50.0 μL。反应程序为95 ℃预变性5 min;95 ℃ 30 s,51 ℃ 30 s,72 ℃ 2 min,共32个循环;结束后72 ℃延伸7 min。利用SanPrep柱式DNA胶回收试剂盒,对所得目的基因片段进行提取与纯化,并与克隆载体pGEM-T连接,筛选阳性菌株并测序,最终获得了珠子参生物合成途径中关键酶基因PjHMGR的cDNA序列。菌液测序和引物合成均由上海生物工程技术服务有限公司完成。
1.2.3PjHMGR基因过表达载体构建和阳性细胞系抗性初筛通过BamH I和KpnI限制性内切酶构建过表达重组载体pCAMBIA2300s-PjHMGR。通过热激转化法将重组载体转入大肠杆菌DH5α感受态细胞中,筛选阳性菌株。通过液氮冻融法将上述阳性菌种质粒转入EHA105农杆菌感受态细胞中,将上述农杆菌侵染普通的珠子参细胞获得PjHMGR转基因珠子参阳性株系。
提取生长状态良好的PjHMGR转基因珠子参阳性系基因组DNA,以卡那霉素抗性基因nptⅡ目的条带为模板, 设计特异引物nptⅡ-F(5′-CTCTGATGCCGCCGTGTT-3′)和nptⅡ-R(5′-CCCTGATGCTCTTCGTCCA-3′)。PCR检测体系为:DNA模板 1.5 μL,10×EasyTaqBuffer 2.0 μL,dNTPs 1.5 μL,DNA Polymerase 5.0 μL,10 μmol/L的上下游引物 0.2 μL,Nuclease-free water 14.5 μL,总体积为20.0 μL。PCR反应程序为95 ℃预变性5 min; 95 ℃ 30 s,54 ℃ 30 s,72 ℃ 2 min,共32个循环;结束后72 ℃ 延伸7 min。PCR反应的产物通过1.0%的琼脂糖凝胶电泳检测。
1.2.4转基因珠子参细胞系荧光定量分析和HMGR酶活测定PjHMGR基因表达水平通过荧光定量PCR检测。转基因珠子参阳性株系RNA提取和纯化与1.2.1方法一致。荧光定量和内参的特异性引物为18srRNA-F(5′-AACCATAAACGATGCCGACCAG-3′)、18srRNA-F(5′-TTCAGCCTTGCGACCATACTCC-3′)、qHMGR-F(5′-TCCACAGCCTACTGATGAT-3′)和qHMGR-R(5′-GGGCAAACTAATGAGAAACTAC-3′)。整个反应通过GoTaq®2-Step RT-qPCR System (Promega, USA)完成,具体程序设置为94 ℃预变性 30 s;94 ℃变性 5 s,60 ℃退火反应 30 s,72 ℃延伸30 s,共45个循环;结束后72 ℃延伸9 min。
通过改良的紫外分光光度计法测定转基因珠子参阳性株系酶活。采用0.1 mol·L-1蔗糖,0.05 mol·L-1氯化钠,0.04 mol·L-1磷酸二氢钾,0.03 mol·L-1EDTA钠盐构成的Buffer A和加入0.02 mol·L-1二硫苏糖醇(DTT)Buffer A的Buffer B提取珠子参PjHMGR的可溶性微粒体蛋白。考马斯亮蓝法测定PjHMGR微粒体蛋白浓度,在340 nm处用紫外分光光度计测定空白对照和上述转基因样品的吸光度,并根据下列公式[酶活(μmol·mg-1·min-1)= (Δ340/min样品-Δ340/min空白)/12.44×V×M]计算PjHMGR酶活。
1.2.5转基因珠子参细胞系皂苷和植物甾醇含量测定准确称取珠子参皂苷标准品10 mg,用适量甲醇溶解。分别以吸光值、珠子参总皂苷含量为横纵坐标绘制珠子参皂苷标准曲线。用甲醇溶液溶解适量转基因珠子参细胞系粉末,再以超声法提取珠子参总皂苷粗提物,HPD100大孔树脂纯化珠子参总皂苷。以香草醛-高氯酸-冰乙酸显色反应为基础,利用标准曲线测定上述转基因珠子参细胞系的总皂苷含量。
称取干燥至恒重的转基因珠子参细胞系1.0 g,以石油醚作为溶剂,以氢氧化钾-乙醇溶液的皂化反应、正己烷萃取为基础,通过索式提取方式获取转基因珠子参阳性细胞系植物甾醇提取物。根据乙酸酐-浓硫酸显色反应测定植物甾醇含量,并以吸光值、植物甾醇浓度为横纵坐标绘制标准曲线。利用标准曲线计算转基因样品植物甾醇含量。
1.2.6统计分析本实验所有数据均来源于3组独立重复实验,计算标准差平均值,进行t检验。
2 结果与分析
2.1 PjHMGR转基因珠子参细胞系
本实验采用同源克隆法得到了珠子参HMGR基因的ORF全长序列,命名为PjHMGR,提交到NCBI 的GenBank数据库,获得登录号为MG712296,该序列包含一个1 716 bp的开放阅读框(ORF),编码571个氨基酸。PjHMGR基因编码蛋白序列与人参、三七、刺五加、常春藤的氨基酸序列比对结果显示:PjHMGR基因编码蛋白与其他药用植物HMGR一样具有多个保守的结构域,分别为TTEGCLVA、GTVGGGT、DMAMGMNM、EMPIGYVIP和2个KT保守结构域。以上结果表明HMGR功能结构域在进化过程中具有较高的稳定性。通过农杆菌遗传转化操作,本研究获得了7株具有抗性的转PjHMGR细胞系,并依次编号为H-1~H-7,分别提取阳性细胞系的基因组DNA,以nptII-F和nptII-R为特异性引物进行 PCR 扩增,琼脂糖凝胶电泳结果显示,所有细胞系在大约450 bp处均有与预期大小一致的特异性条带(图2)。
2.2 PjHMGR基因表达及HMGR活性分析
以上述H-1~H-7株系的cDNA为模板进行PjHMGR基因相对表达量分析。结果显示阳性细胞系中,PjHMGR基因相对表达量与野生型相比均有不同程度提高。H-3和H-7株系PjHMGR基因相对表达量增加最多,约为野生型对照组的7.15倍,而H-5株系仅仅为对照组的1.47倍(图3)。酶活分析表明,H-1~H-7转基因珠子参阳性细胞系HMGR活性与野生型相比均有一定提高,并以H-3株系PjHMGR酶活最高,约为野生型株系的6.14倍(图4)。各阳性细胞系PjHMGR基因表达量变化趋势基本与酶活变化具有较好对应关系。
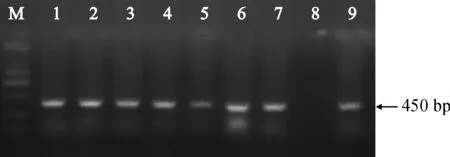
M. DL2 000;1~7.转基因珠子参细胞系;8.阴性对照;9.阳性对照图2 PjHMGR转基因珠子参细胞系的nptII基因的PCR检测M. DL2 000; 1-7. The transgenic P. japonicus cell lines; 8. Negative control; 9. Positive controlFig.2 The PCR detection of nptII gene in transgenic P. japonicus cell lines of PjHMGR
2.3 皂苷及植物甾醇含量分析
H-1~H-7中珠子参总皂苷含量与未转基因珠子参细胞系相比有明显提高。在整个实验组中,H-3和H-7株系总皂苷含量约为野生型对照组的3.5倍,也明显高于其他阳性细胞系(图5)。同时,转基因珠子参阳性细胞系中植物甾醇含量与野生型相比均有不同程度增加(图5)。因此过表达PjHMGR不仅可以有效提高珠子参主要活性成分皂苷含量,也可以提高植物甾醇含量。
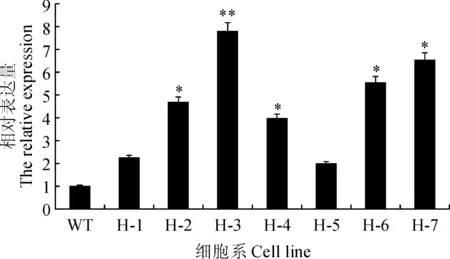
WT.野生型珠子参细胞系;H-1~H-7.PjHMGR转基因珠子参细胞系。下同图3 野生型和转PjHMGR基因珠子参细胞系的PjHMGR基因相对表达量WT.The wild-type P. japonicus cell lines; H-1-H-7.The transgenic P. japonicus cells of PjHMGR. The same as belowFig.3 Relative expression of PjHMGR in wild-type and transgenic P. japonicus cell lines
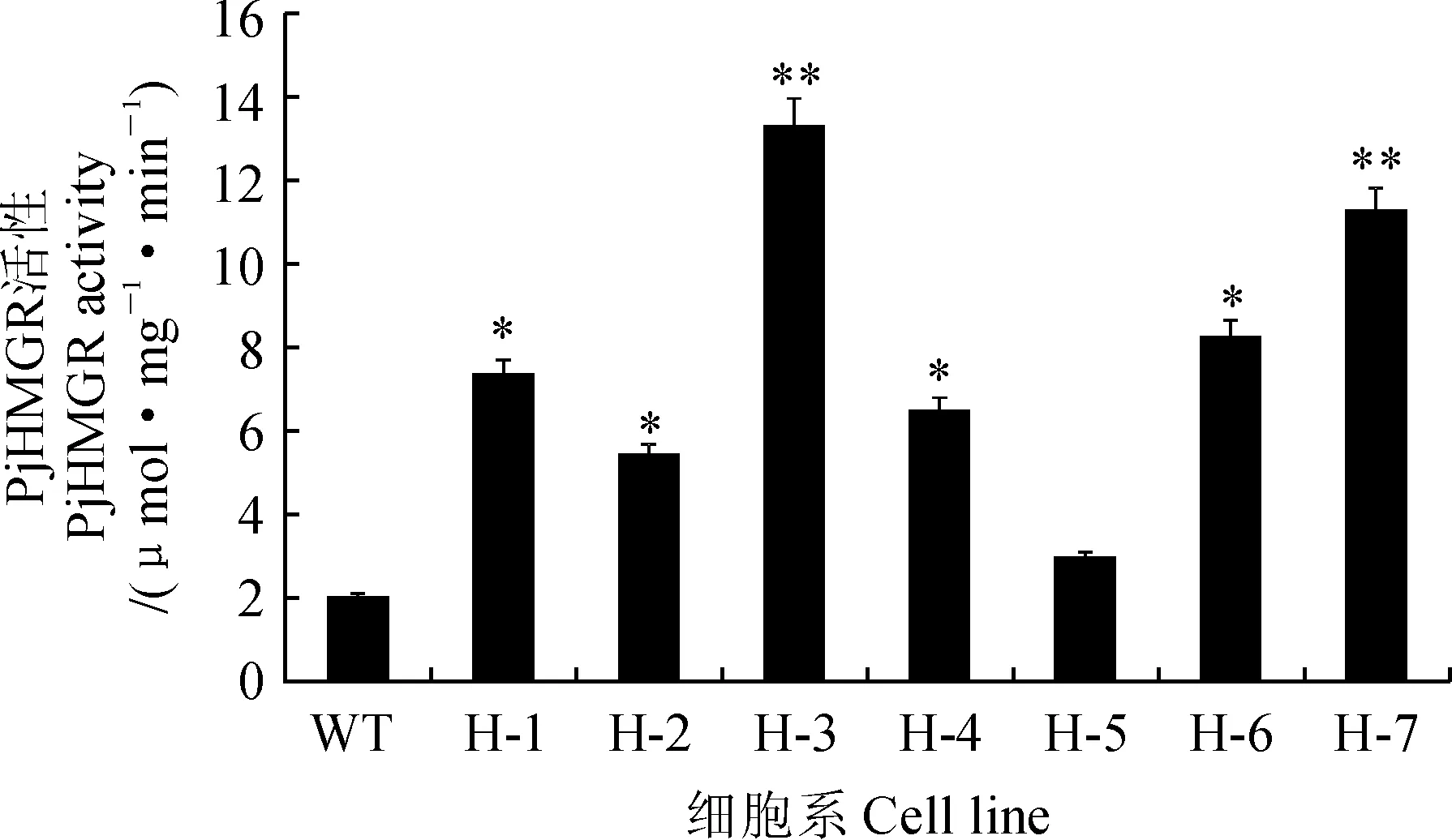
图4 野生型和转PjHMGR基因珠子参细胞系的HMGR活性Fig.4 Enzyme activities of HMGR in the wild-type and the PjHMGR transgenic P. japonicus cell lines
3 讨 论
人参属三大药材中,人参、三七备受关注且研究颇多,珠子参虽为中国传统名贵中药,却长期缺乏系统认识和研究。近年来,越来越多研究证明珠子参具有广泛而重要的药理学活性,对此相关基础研究逐步受到重视。三萜皂苷是珠子参主要生物活性成分,因此对其生物合成途径的研究尤为重要。从我们课题组前期对三七皂苷生物合成的研究中发现,在分子水平上影响人参属三萜皂苷合成的关键因素包括关键酶基因活性和转录因子活性。
目前,珠子参关键酶基因的克隆已取得了一些进展。Huang等[18]首次从珠子参细胞中克隆到关键酶基因PjAS,该基因是控制皂苷合成流向齐墩果烷皂苷的第一个关键酶基因。此外,珠子参关键酶基因PjDS、PjSS、PjFPS也相继被克隆[19]。HMGR是植物三萜皂苷合成途径中第一个关键酶,但针对于该关键酶的研究主要集中于五加科其他物种,包括邢朝斌等[20]克隆了长度为1 713 bp、编码570个氨基酸的刺五加(Acanthopanaxsenticosus)HMGR基因,与人参(Panaxginseng)的PgHMGR(AD180346)具有92.3%的相似性;罗红梅等[21]克隆了长度为1 770 bp、编码589个氨基酸的人参(Panaxginseng)HMGR2(JX648390)基因,与西洋参(Panaxquinquefolius)的PqHMGR(ACV65036)具有99%的相似性。我们课题组曾经从三七(Panaxnotoginseng)中克隆到编码574个氨基酸的PnHMGR(KJ578757)基因,其与人参PgHMGR(ADI80346.1)序列具有97%的相似性。本研究成功克隆了长度约为1 716 bp,编码571个氨基酸的珠子参PjHMGR(MG712296)序列,与张萍等[22]克隆PnHMGR(KJ578757)具有97%的相似性,该结果表明本实验克隆的HMGR基因的完整性和准确性相对较高。
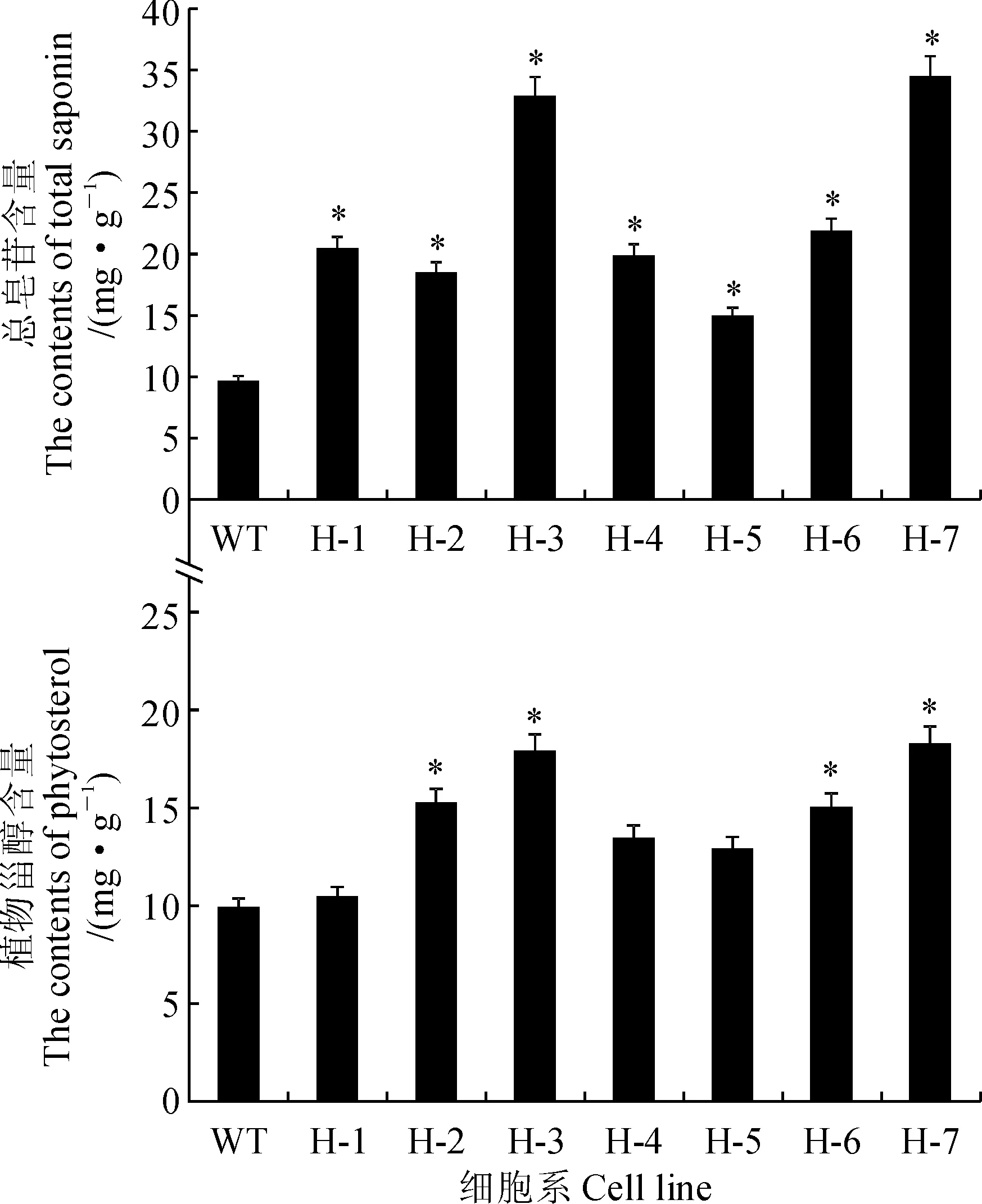
图5 野生型和转PjHMGR基因珠子参细胞系的总皂苷和甾醇含量Fig.5 The content of total saponins and phytosterol of the wild-type and PjHMGR transgenic P. japonicus cell lines
调控珠子参皂苷含量策略主要从两个层面展开。一是细胞水平上调控,即对珠子参植株进行寒冷、干旱等胁迫,使皂苷含量增加,该方法操作层面粗放,效果一般,难以实现对皂苷合成的稳定调控,只能影响“量”的变化而不能从根本上解决“质”的问题[23]。二是从分子水平,即通过直接控制皂苷合成的关键酶基因以及相关转录因子基因的表达影响皂苷合成,进而形成定向、高效、可靠的皂苷合成调控手段。分子操作是控制皂苷合成的终极途径。本研究通过过表达珠子参HMGR基因直接促进珠子参皂苷的生物合成,提高皂苷含量。HMGR是植物萜类合成途径中的第一个关键酶,它不仅是MVA途径的第一个限速酶,也是三萜化合物合成的重要调控点[24]。国内外对HMGR基因的功能性研究已经取得了一些进展。将人参关键酶基因PgHMGR过表达载体转化到人参发根中,可引起人参皂苷含量的增加,该转基因人参发根中皂苷含量与野生型相比平均提高了2倍以上[25]。此外,将人参关键酶基因PgHMGR1过表达载体转化到拟南芥中,同样可提高拟南芥中皂苷的积累量[26]。在青蒿素合成研究方面,HMGR能够限制黄花蒿中青蒿素的生物合成,过表达HMGR基因可增加青蒿素的含量[27]。刺五加的各个器官均可表达HMGR,增加刺五加细胞中HMGR基因的表达量可以促进刺五加总皂苷的合成[28]。前期研究表明,在三七细胞中同时过表达PnHMGR与PnSS,三七皂苷的生物合成能力可提高约4倍,相对于仅过表达1个关键酶基因来说同时过表达2个关键酶基因对皂苷合成的影响确实明显[29]。本研究还发现,皂苷合成被促进的同时,植物甾醇合成也被促进,其原因在于PjHMGR是三萜合成途径中比较上游的关键酶,植物甾醇与三萜皂苷的合成共享上游和中游路径,因此PjHMGR的表达增加,提高了整个代谢流的流量,流向三萜皂苷合成支路的代谢流增加的同时,植物甾醇合成支路的流量也随之增加,最终导致珠子参皂苷和植物甾醇的合成同时获得促进。
本研究实现了PjHMGR在珠子参细胞中的过表达,提高了珠子参皂苷的积累量,证明了PjHMGR确实是珠子参皂苷生物合成途径中能够显著影响三萜皂苷以及植物甾醇的合成的关键酶。接下来,将重点研究关键酶基因与重要转录因子的相互作用,力图把关键酶调控层面与转录因子调控层面结合起来,构建更为高效、科学的皂苷调控手段,全方位、多角度解析珠子参皂苷的合成机制。
参考文献:
[1] FRANCIS G, KEREM Z, MAKKAR H P,etal. The biological action of saponins in animal system: a review[J].BrJNutr, 2002,88(6): 587-605.
[2] HAN L K, ZHENG Y N, YOSHIKAWA M,etal. Anti-obesity effects of chikusetsusaponins isolated fromPanaxjaponicusrhizomes[J].BMCComplementAlternMed, 2005,10(1): 5-9.
[3] MATSUDA H, MORIKAWA T, UEDA H,etal. Medicinal Foodstuffs XXVII: saponin constituents Gotu Kola (2) Structures of new ursane-type and oleanane-type triterpene oligoglycosides, centellasaponin B, C, and D, fromCentellaasiaticacultivated in Sri Lanka[J].ChemPharmBull, 2001,49(6): 1 368-1 371.
[4] YOSHIZAKI K, DEVKOTA H P, FUJINO H,etal. Saponins composition of rhizomes, tap roots, and lateral roots of Satsuma-ninjin (Panaxjaponicus)[J].ChemPharmBull, 2013,61(3): 344-355.
[5] QI L W, WANG C Z, YUAN C S. Ginsenosides from American ginseng: chemical and pharmacological diversity[J].Phytochemistry, 2011,72(8): 689-699.
[6] ZHANG H J, WANG H F, LIU Y,etal. The haematopoietic effect ofPanaxjaponicuson blood deficiency model mice[J].Ethnopharmacology, 2014,154(3): 818-824.
[7] ZUO R, YUAN D. Research on chemical constituents and biological activities of rhizoma ofPanaxjaponicus[J].LishizhenMedMaterMedRes. 2005,16(9): 838-841.
[8] LUO H M, SUN C, SUN Y Z,etal. Analysis of the transcriptome ofPanaxnotoginsengroot uncovers putative triterpene saponin-biosynthetic genes and genetic markers[J].BMCGenomics, 2011,12(5): S5.
[9] HUANG Z P, ZHANG L N. Chemical structures of water-soluble polysaccharides from rhizomaPanaxjaponicas[J].CarbohydrateResearch, 2009,344(9): 1 136-1 140.
[10] YAMAZHARA J, KUBOMURA Y, MIKI K,etal. Anti-ulcer action ofPanaxjaponicusrhizome[J].JournalofEthnopharmacology, 1987,19(1): 95-101.
[11] MATSUDA H, SAMUKAWA K, FUKUDA S,etal. Studies ofPanaxjaponicusfibrinolysis[J].PlantaMed, 1989,55(1): 18-21.
[12] KIM Y K, KIM Y B, KIM J K,etal. Molecular cloning and characterization of mevalonic acid (MVA) pathway genes and triterpene accumulation inPanaxginseng[J].JKoreanSocApplBiolChem, 2014,57(3): 289-295.
[13] 黄壮嘉,刘迪秋,葛 锋,等.植物三萜皂苷生物合成中关键后修饰酶研究进展[J].西北植物学报2014,34(10): 2 137-2 144.
HUANG Z J, LIU D Q, GE F,etal. Advances in studies on key post-modification enzymes in triterpenoid saponins biosynthesis[J].ActaBotanicaBoreali-OccidentaliaSinica, 2014,34(10): 2 137-2 144.
[14] CHAPPELL J. Biochemistry and molecular biology of the isoprenoid biosynthesis pathway in plants[J].AnnuRevPlantPhysiolPlantMolBiol, 1995,46(1): 521-547.
[15] SABAKE T, DIARRA J H, JIANBO W,etal. Ethylene treatment improves diosgenin accumulation ininvitrocultures ofDioscoreazingiberensisvia up-regulation ofCASandHMGRgene expression[J].ElectronicJournalofBiotechnology, 2013,16(5): 1-10.
[16] TANSAKUL P, SHIBUYA M, KUSHIRO T,etal. Dammarenediol-II synthase, the first dedicated enzyme for ginsenoside biosynthesis, inPanaxginseng[J].FEBSLett., 2006,580(22): 5 143-5 149.
[17] AMIT R, YAMAZAKI M, TAMAZAKI H,etal. RNA-seq transcriptome analysis ofPanaxjaponicus, and its comparison with otherPanaxspecies to identify potential genes involved in the saponins biosynthesis[J].PlantScience, 2016, 7: 481-501.
[18] HUANG Z W, LIN J C, CHENG Z Xetal. Production of oleanane-type sapogenin in transgenic rice via expression of β-amyrin synthase gene fromPanaxjaponicusC. A. Mey[J].BMCBiotechnology, 2015,15(1): 45.
[19] ZHANG L, HUANG Y. Molecular cloning and expression of SS gene fromPanaxjaponicus[J].Nanotechnology,BiologyandMedicine, 2016,12(2): 524.
[20] 邢朝斌,吴 鹏,龙月红,等.刺五加HMGR基因的克隆与表达分析[J].江苏农业学报2012,28(6): 1 258-1 262.
XING Z B, WU P, LONG Y H,etal. Cloning and expression analysis of 3-hydroxy-3-methylglutaryl coenzyme A reductase inEleutherococcussenticosus[J].JiangsuJournalofAgriculturalSciences, 2012,28(6): 1 258-1 262.
[21] 罗红梅,宋经元,李雪莹,等.人参皂苷合成生物学关键元件 HMGR 基因克隆与表达分析[J]. 药学学报,2013,48(2): 219-227.
LUO H M, SONG J Y, LI X Y,etal. Cloning and expression analysis of a key device of HMGR gene involved in ginsenoside biosynthesis ofPanaxginsengvia synthetic biology approach[J].ActaPharmaceuticaSinica, 2013,48(2): 219-227.
[22] 张 萍,刘迪秋,葛 锋,等.三七3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)基因的克隆和生物信息学分析[J]. 中草2014,45(18): 2 684-2 690.
ZHANG P, LIU DQ, GE F,etal. Cloning and bioinformatics analysis of 3-hydroxy-3-methylglutaryl CoA reductase gene fromPanaxnotoginseng[J].ChineseTraditionalandHerbalDrugs, 2014,45(18): 2 684-2 690.
[23] 刘 佳,全雪丽,姜明亮,等.低温胁迫对人参皂苷生物合成途径基因家族表达特性的影响研究[J].中草药,2016,47(11): 1 956-1 961.
LIU J, QUAN X L, JIANG M L,etal. Effect of cold stress on expression characteristic of gene families of ginsenoside biosynthesis pathway[J].ChineseTraditionalandHerbalDrugs, 2016,47(11): 1 956-1 961.
[24] KIM Y K, KIM Y B, KIM J K,etal. Molecular cloning and characterization of mevalonic acid (MVA) pathway genes and triterpene accumulation inPanaxginseng[J].JKoreanSocApplBiolChem, 2014, 57: 289-295.
[25] KIM Y K, KIM J K, KIM Y B,etat. Enhanced accumulation of phytosterol and triterpene in the hairy root cultures of platycodon grandiflorum by overexpression ofPanaxginseng3-hydroxy-3-methylglutaryl CoA reductase[J].JournalofAgriculturalandFoodChemistry, 2013,61(8): 1 928-1 934.
[26] RAM M, KHANM A, JHA P,etal. HMG-CoA reductase limits artemisinin biosynthesis and accumulation inArtemisiaannuaL.plants[J].ActaPhysiol.Plant, 2010,32(5): 859-866.
[27] NAFIST, AKMALMOHD, RAMM,etal. Enhancement of artemisinin content by constitutive expression of the HMG-Co A reductase gene in high-yielding strain ofArtemisiaannuaL.[J].PlantBiotechnolRep, 2011,5(1): 53-60.
[28] 李非非, 杨 果, 吴 鹏, 等.刺五加HMGR基因的表达及其对皂苷合成的影响[J].基因组学与应用生物学,2015,34(3): 560-564.
LI F F, YANG G, WU P,etal. Expression of 3-hydroxy-3-methylglutaryl coenzyme a gene inEleutherococcussenticosusand its influence on saponins synthesis[J].GenomicsandAppliedBiology, 2015,34(3): 560-564.
[29] DENG B, ZHANG P, GE F,etal. Enhancement of triterpenoid saponins biosynthesis inPanaxnotoginsengcells by co-over-expressions of 3-hydroxy-3-methylglutaryl CoA reductase and squalene synthase genes[J].BiochemicalEngineeringJournal, 2017, 122: 38-46.
