miR-22靶向抑制NLRP3基因对冠心病内皮细胞炎症损伤的保护作用
2018-06-11张晓刚李德才
胡 波,张晓刚,李德才
冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)是一种多因素共同作用的冠状动脉性心脏疾病,由于脂质代谢异常引起动脉内膜脂类物质的堆积进而诱发动脉粥样病变[1-2],近年来,冠心病的发病率呈上升的趋势,并且在年龄上越来越趋向于年轻化[3]。炎症反应是心脏疾病中的一项重要的机制,该反应会使动脉粥样硬化斑块趋于不稳定,进而可能导致斑块破裂,促进冠心病的发生发展[4-6]。该研究[7]显示许多microRNA (miRNA)分子可以调控糖脂代谢、平滑肌细胞增殖以及血管炎症反应,在冠心病的发病机制中扮演着关键性的作用。Jazbutyte et al[8]发现miR-22靶向骨诱导因子(mimecan/osteoglycine, OGN),可促进心脏成纤维细胞的迁移,诱导心肌细胞衰老。NOD样受体蛋白3(NLRP-3)炎性小体是一种影响组织损伤、代谢应激、感染和炎症过程的复合体[9]。该研究旨在探讨miR-22靶向调控NLRP3基因对冠心病内皮细胞炎症损伤的影响,寻求一种新的方法来治疗冠心病。
1 材料与方法
1.1实验动物健康纯种SD雄性大白鼠24只,体重(240±60) g,鼠龄3 ~4月,由湖南斯莱克景达实验动物有限公司提供,动物合格证编号:HNASLKJ20100330,饲养在带不锈钢盖底的塑料笼内,每笼6只,自由饮水。室内温度25 ℃,湿度65%,饮水为普通自来水,饲料和水均可由大鼠自行随意摄取。饲养一周适应环境,以降低环境变更引起的应激反应。本次实验通过绵阳四0四医院伦理协会审核,同时动物实验严格遵循《赫尔辛基宣言》。
1.2病理模型的构建及分组参照沈丽 等[10]的方法制备冠状动脉粥样硬化模型,适应性喂养一周后,正常组喂基础饲料和普通自来水,AS组以高脂饲料(2%胆固醇、0.5%胆酸钠、3%猪油、0.2%丙基硫氧嘧啶和94.3%的基础饲料)喂养,在高脂饲料的基础上加维生素D3粉剂(1.25×106U/kg饲料)喂养,实验开始时于右下肢肌肉注射维生素D3粉针剂(3×106U/kg体重),每隔30 d重复一次。正常组和AS组各12只。
1.3血脂和血钙的检测实验3个月后,各组动物禁食过夜,在戊巴比妥钠腹腔麻醉下,分离腹主动脉,在肾动脉分叉处下方,剪开腹主动脉,插入穿刺针,以注射器采集动脉血,3 000 r/min离心5 min,分离血浆,取1 ml检测血脂和血钙。使用Abbott Aeroset TM生物化学分析仪(美国亚培公司)检测各组大鼠血浆总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDLC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDLC)和Ca2+的表达情况。实验重复3次,数据取平均值。
1.4冠状动脉内皮细胞的分离、培养及鉴定取近心端冠状动脉,将取出的冠状动脉放入盛有PBS和肝素的的器皿中浸泡5 min,防止血液凝固。无菌PBS冲洗3次,将其置于75%酒精中浸泡15 s,用眼科剪将动脉组织剪碎为1 mm3大小的组织块,加入0.2% Ⅱ型胶原酶3 ml,37 ℃水浴消化6 min,再加入等体积0.25%胰酶,37 ℃水浴消化5 min。消化结束后,加入3 ml含10%胎牛血清的DMEM培养液终止消化。弃上清液,将所得细胞充悬于完全培养液,在37 ℃、5% CO2细胞孵育箱中孵育,6 h后换液,弃去未贴壁细胞,待细胞生长至80% 融合,吸弃原培养液,PBS冲洗3遍。向瓶内加入0.25% 胰蛋白酶-0.02% EDTA溶液,轻轻晃动培养瓶,使消化液流遍所有细胞表面。将培养瓶置于显微镜下观察,待大部分细胞收缩变圆时,立即加入10%胎牛血清培养液终止消化。用移液器轻轻吹打使细胞脱壁。吸取细胞悬液并离心,用完全培养液重悬,混合均匀。调整到合适的密度后接种传代。含置于37 ℃恒温的5% CO2培养箱中孵育,每3 d换一次培养液。通过免疫细胞化学法,将细胞吹打,使用PBS洗涤,加入一抗孵育过夜。次日,PBS清洗3次,加入二抗,在37 ℃的条件下孵育30 min,DAB显色,光镜下观察记录。原代冠状动脉内皮细胞在培养24 h后,在倒置显微镜下进行观察。
1.5细胞转染及分组待处理的大鼠冠状动脉内皮细胞与0.25 mmol/L的同型半胱氨酸(homocysteine,HCY)共孵育24 h,造冠心病模型。针对有效促进大鼠miR-22基因表达的靶序列合成其过表达RNA的DNA Oligo,并制成双链DNA。与Age I和EcoR I双酶切后的Pgcsil-gfp载体连接、转化、PCR法筛选阳性克隆,提取质粒,酶切并测序。合成miR-22的过表达物(miR-22 mimic)、抑制物(miR-22 inhibitor)及NLRP3基因失活(si NLRP3) ,利用脂质体进行包装,待第3代冠状动脉内皮细胞生长至80%时开始转染,将脂质体一定比例稀释后加入细胞培养基共培养24 h,构成空白对照组(不转染的细胞)、阴性对照组(转染不相干序列)、miR-22 mimic组(转染miR-22的过表达物)、miR-22 inhibitor组(转染miR-22的抑制物)、miR-22 inhibitor + si NLRP3组(转染miR-22并失活NLRP3基因)。
1.6双荧光素酶报告系统检测采用生物信息学软件http://www.microrna.org预测miR-22 与NLRP3的靶向关系及miR-22 与NLRP3 3’UTR 的结合位点。合成含miR-22结合位点的NLRP3 3’UTR启动子区序列,构建NLRP3 3’UTR野生型(WT)质粒(NLRP3 3’UTR-WT)。并在该质粒基础上,突变结合位点,构建NLRP3 3’UTR 突变型(MUT)质粒(NLRP3 3’UTR -MUT)。按购买的质粒提取试剂盒(美国Promega公司)的方法步骤进行。将对数生长的293T细胞接种于96 孔板中,在细胞密度约70 % 时,Lipofectamine 2000 转染,将NLRP3-3′UTR-WT质粒和miR-22 mimic质粒混匀后共转染于293T 细胞,同时设NLRP3-3 ′ UTR-WT+NC(NLRP3 3’UTR野生型质粒转染无义对照序列)组、NLRP3-3′UT R-MUT+NC(NLRP3 3’UTR突变型质粒转染无义对照序列)组和NLRP3-3′UT R-MUT+miR-22 mimic(NLRP3 3’UTR突变型质粒转染miR-22 mimic质粒)组分别转染于293T 细胞。培养箱培养6 h后,更换含10 % FBS培养基继续培养48 h后,化学发光法检测荧光素酶活性。实验重复3次,数据取平均值。
1.7实时荧光定量PCR检测miR-22、NLRP3、caspase-1mRNA的表达水平采用TRIzol(美国Invitrogen公司)的一步法对组织和细胞总RNA进行提取,并通过紫外分析技术及甲醛变性电泳检测对获得高质量RNA进行证实。取1 μg RNA,用AMV逆转录酶逆转录得到cDNA。PCR引物由美国Invitrogen公司设计和合成,以β-actin作为内参。PCR扩增条件为:94 ℃预变性5 min,94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸1 min,40个循环,72 ℃再延伸10 min。产物经琼脂糖凝胶进行电泳,用OpticonMonitor 3软件(美国BioRad公司)分析PCR结果。手动将阈值选定在各对数扩增曲线平行上升的最低点,获得各反应管的Ct值,数据采用2-ΔΔCt法进行分析,2-ΔΔCt表示实验组与对照组目的基因表达的倍比关系,公式如下:ΔΔCt=[Ct(目的基因)-Ct(参照基因)]实验组-[Ct(目的基因)-Ct(参照基因)]对照组。实验重复3次,数据取平均值。
1.8Westernblot检测NLRP3、caspase-1蛋白表达情况提取各组大鼠心肌组织和各组细胞蛋白,按BCA试剂盒(武汉博士德公司)说明书测定蛋白浓度,将提取的蛋白加入上样缓冲液后在95 ℃煮10 min,每孔上样30 μg,10%聚丙烯酰胺凝胶(武汉博士德公司)电泳分离蛋白,电泳电压80 V转120 V,湿转,转膜电压 100 mV,时间 45~70 min,PVDF 转膜,5% BSA室温封闭1 h,加入兔抗鼠一抗NLRP3(1 ∶1 000稀释)、caspase-1(1 ∶1 000稀释)均购自美国Cell Signaling公司,抗鼠一抗β-actin(1 ∶3 000稀释)购自美国BD公司,4 ℃过夜。TBST 漂洗3次,每次5 min,相应的羊抗兔二抗(上海妙通生物科技公司)室温孵育 1 h,洗膜,洗3次,每次5 min,化学发光试剂显影。β-actin作为内参。Bio-rad Gel Dol EZ 成像仪(GEL DOC EZ IMAGER,美国Bio-rad公司)显影。目的条带采用Image J软件进行灰度值分析。实验重复3次,数据取平均值。
1.9MTT法检验细胞活性将2~3代CMEC细胞悬液按一定浓度稀释细胞数后以5×104每孔密度接种于96孔板中,每组设6个平行孔。待细胞达80%融合后,按上述实验分组处理细胞,复氧结束后,再加入MTT液(美国Sigma公司)20 μl,置于37 ℃培养箱孵育4 h,弃MTT溶液,每孔加入二甲基亚砜(美国Sigma公司)150 μl,摇床振荡10 min后于酶标仪490 nm波长处检测每孔吸光度(OD)值。实验重复3次,取平均OD值。细胞存活率=(试验组OD值-空白组OD值)/空白组OD值。实验重复3次,数据取平均值。
1.10Hochest33258染色检验细胞凋亡使用0.25%胰酶-0.02% EDTA消化处于对数生长期的细胞,离心后的细胞置于完全培养液中重悬,在24孔板中以500 μl(6×105/孔)密度接种于,37 ℃、5% CO2环境中孵育。待细胞贴壁融合后,取出盖玻片,PBS洗3次,4%多聚甲醛固定15 min,然后PBS洗3次,每次5 min。Hochest 33258工作液25 ℃染色5 min,蒸馏水冲净晾干。在倒置荧光显微镜下观察,随机选择高倍镜视野5个/组,固缩、浓集、细胞核变亮认为是凋亡细胞核,统计阳性细胞数。凋亡率等于阳性细胞数与总细胞数之比。实验重复3次,数据取平均值。
1.11ELISA检测白介素(interleukin,IL)-1β、IL-6、IL-10和IL-18水平0.25%胰酶-0.02%EDTA消化对数生长期细胞,离心后的细胞用完全培养液重悬,以500 μl(6×105/孔)密度接种于24孔板,37 ℃、5% CO2环境中孵育。待细胞贴壁融合后,收集细胞上清液。上清液保存于-20 ℃的环境中,按照ELISA试剂盒说明书检测细胞上清中的IL-1β、IL-6、IL-10和IL-18的浓度。实验重复3次,数据取平均值。
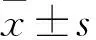
2 结果
2.1大鼠的血脂和血钙的浓度变化检测大鼠的血脂和血钙的浓度结果显示:与正常组大鼠比较,AS组大鼠血清TC、TG、LDLC水平均明显升高(P<0.05),HDLC差异无统计学意义。与正常组比较,AS组大鼠血清中Ca2+浓度明显升高(P<0.05)。见表1。
2.2大鼠心肌组织中miR-22和NLRP3、caspase-1mRNA表达水平经实时荧光定量PCR法检测大鼠心肌组织中miR-22水平和NLRP3、caspase-1 mRNA表达情况,两组大鼠miR-22水平和NLRP3、caspase-1 mRNA表达水平存在显著差异(t=26.84、64.01、50.59,P<0.05)。 与正常组比较AS组大鼠心肌组织中miR-22水平显著下调,而NLRP3和caspase-1 mRNA表达水平显著上调(P<0.05)。见图1。
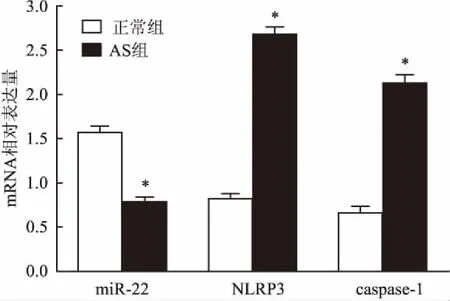
图1 大鼠心肌组织中miR-22和NLRP3、caspase-1 mRNA表达水平
2.3大鼠心肌组织中NLRP3、caspase-1蛋白表达水平Western blot法检测各组大鼠心肌组织中NLRP3、caspase-1 蛋白表达水平,各组间NLRP3、caspase-1 蛋白表达水平差异有统计学意义(t=120.70、50.21,P<0.05)。与正常组比较,AS组的NLRP3、caspase-1 蛋白表达显著上调,差异有统计学意义(P<0.05)。见图2。
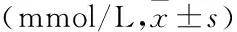
表1 各组大鼠血清血脂和血钙水平
与正常组比较:*P<0.05

图2 大鼠心肌组织蛋白表达水平
2.4双荧光素酶报告系统检测生物信息学软件http://www.microrna.org预测miR-22 与NLRP3有靶向关系(图3A)。293T细胞内共转染NLRP3-3′UTR-WT质粒和miR-22模拟物质粒,结果显示,野生型中,与NLRP3-3′UTR-WT+NC组比较, NLRP3-3′UTR-WT+ miR-22 mimic组荧光素酶活性显著降低(t=5.26,P<0.05)。而突变型中,与NLRP3-3′UTR-MUT+NC组比较,共转染NLRP3-3′UTR-MUT+miR-22 mimic质粒后,荧光素酶活性差异无统计学意义(图3B)。
2.5冠状动脉内皮细胞形态观察及鉴定原代CMECs培养24 h后,倒置显微镜下进行观察,可见细胞呈单层鹅卵石状生长,小而短梭形,胞体具有较好的折光度。贴壁细胞数量随着细胞培养天数增加越来越多,细胞开始伸展并呈梭形贴壁生长。培养至5~7 d时,细胞呈多角形或梭形(图4)。传代细胞3~4 h后可生长至融合状态,细胞形态与原代培养细胞相同,呈现典型“铺路石样结构”。 同时免疫细胞化学法显示内皮细胞的特异分子标志CD34、CD105、Tie-2因子呈强阳性,CD31、vW因子呈阳性。
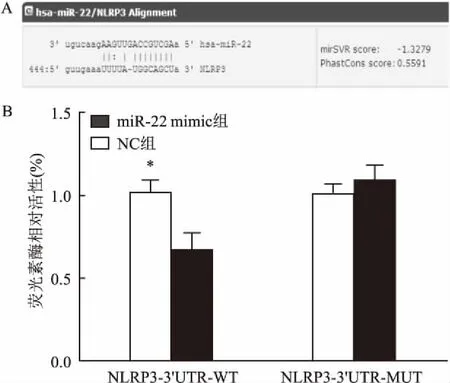
图3 miR-22 与NLRP3的靶向关系验证
A:在线软件预测靶向关系图;B:荧光素酶活性实验验证结果;与NLRP3-3′UTR-WT中的NC组比较:*P<0.05
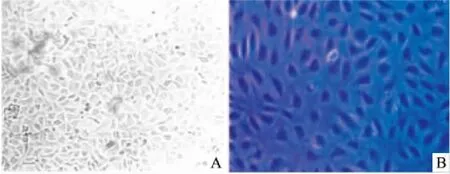
图4 CMECs形态观察 ×200
2.6各组细胞中miR-22和NLRP3、caspase-1mRNA表达水平实时荧光定量PCR结果显示:与空白对照组比较,miR-22 mimic组miR-22水平显著上升,NLRP3、caspase-1的mRNA表达水平显著下降;而miR-22 inhibitor组的miR-22水平显著下降,NLRP3、caspase-1的mRNA表达水平显著上升,差异有统计学意义(F=86.53、258.10、440.60,P<0.05)。空白对照组、阴性对照组和miR-22 inhibitor+si NLRP3组各指标差异无统计学意义。见图5。
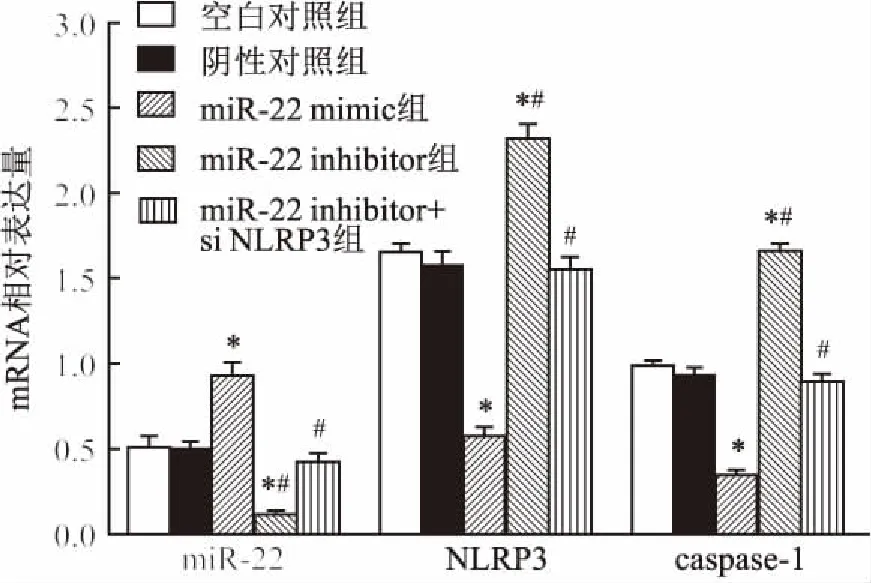
图5 各组细胞实时荧光定量PCR检测结果
与空白对照组比较:*P<0.05;与miR-22 mimic组比较:#P<0.05
2.7各组细胞中NLRP3、caspase-1蛋白表达水平Western blot法检测各组细胞中NLRP3、caspase-1 蛋白表达水平,结果显示:与空白对照组比较,miR-22 mimic组NLRP3、caspase-1的蛋白表达水平显著下降;而miR-22 inhibitor组的NLRP3、caspase-1的蛋白表达水平显著上升,差异有统计学意义(F=125.50、41.75,P<0.05)。空白对照组、阴性对照组和miR-22 inhibitor+si NLRP3组各指标差异无统计学意义。见图6。
2.8各组细胞活性MTT法检测各组内皮细胞活性,结果显示:空白对照组和阴性对照组细胞活性差异无统计学意义。与空白对照组比较,miR-22 mimic细胞活性显著升高;miR-22 inhibitor组细胞活性则显著降低(P<0.05)。空白对照组、阴性对照组和miR-22 inhibitor + si NLRP3组细胞活性差异无统计学意义。见图7。
2.9Hochest33258染色结果Hochest 33258染色结果显示:细胞进行冠心病应激后,出现细胞核不完整,核固缩,染色质浓集和凋亡小体等典型的凋亡特征。空白对照组和阴性对照组比较细胞凋亡情况差异无统计学意义。与空白对照组比较,miR-22 mimic组细胞核不完整的细胞明显减少,细胞凋亡率明显下降;而miR-22 inhibitor组细胞出现大量凋亡细胞,细胞核不完整的细胞明显增加,细胞凋亡率明显上升(P<0.05)。miR-22 inhibitor+si NLRP3组的凋亡率与空白对照组和阴性对照组差异无统计学意义。见图8。
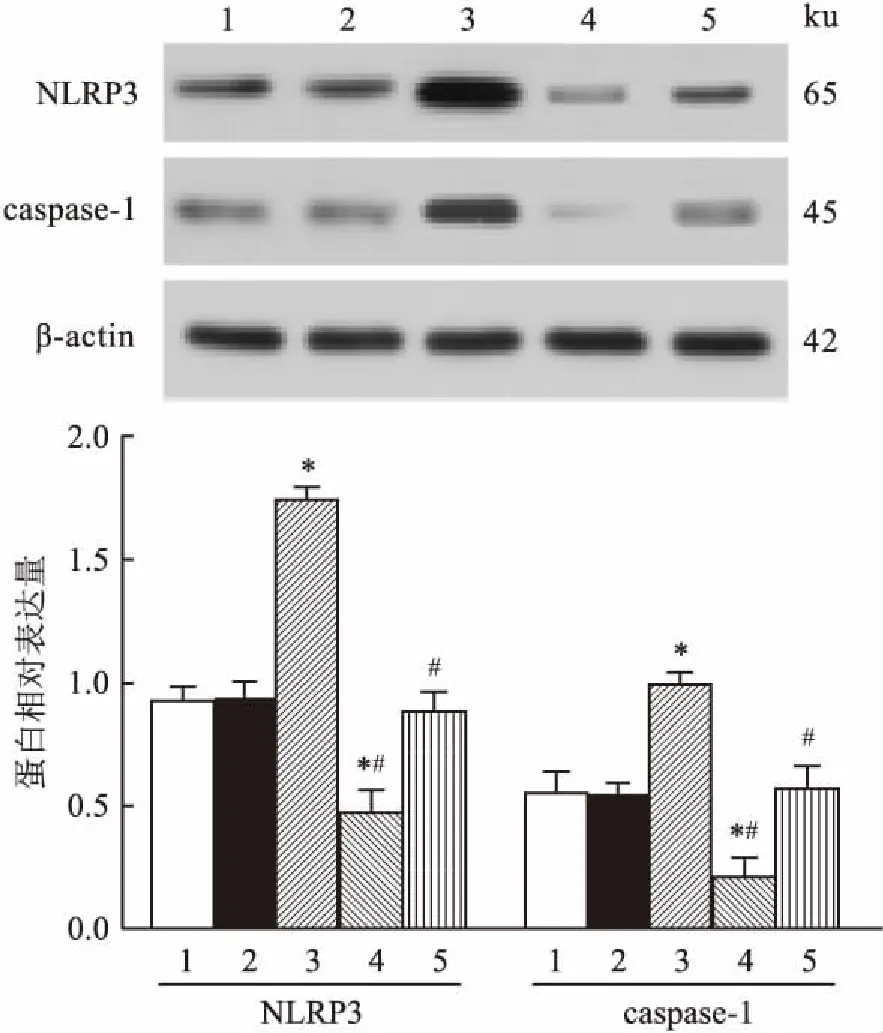
图6 各组细胞蛋白条带图和各组蛋白表达水平
1:空白对照组;2:阴性对照组;3:miR-22 mimic组;4:miR-22 inhibitor组;5:miR-22 inhibitor + si NLRP3组;与空白对照组比较:*P<0.05;与miR-22 mimic组比较:#P<0.05
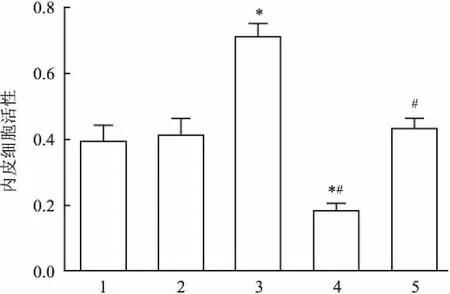
图7 MTT法检测各组内皮细胞的细胞活性
1:空白对照组;2:阴性对照组;3:miR-22 mimic组;4:miR-22 inhibitor组;5:miR-22 inhibitor + si NLRP3组;与空白对照组比较:*P<0.05;与miR-22 mimic组比较:#P<0.05
2.10细胞炎症因子表达水平经ELISA法检验表明:与空白对照组和阴性对照组比较,miR-22 mimic组IL-1β、IL-6和IL-18分泌量明显降低,IL-10分泌显著升高;而miR-22 inhibitor组IL-1β、IL-6和IL-18分泌量明显增加,而IL-10分泌显著下调(P<0.05)。空白对照组和阴性对照组及miR-22 inhibitor + si NLRP3组之间比较,IL-1β、IL-6、IL-10和IL-18分泌量差异无统计学意义。见表2。
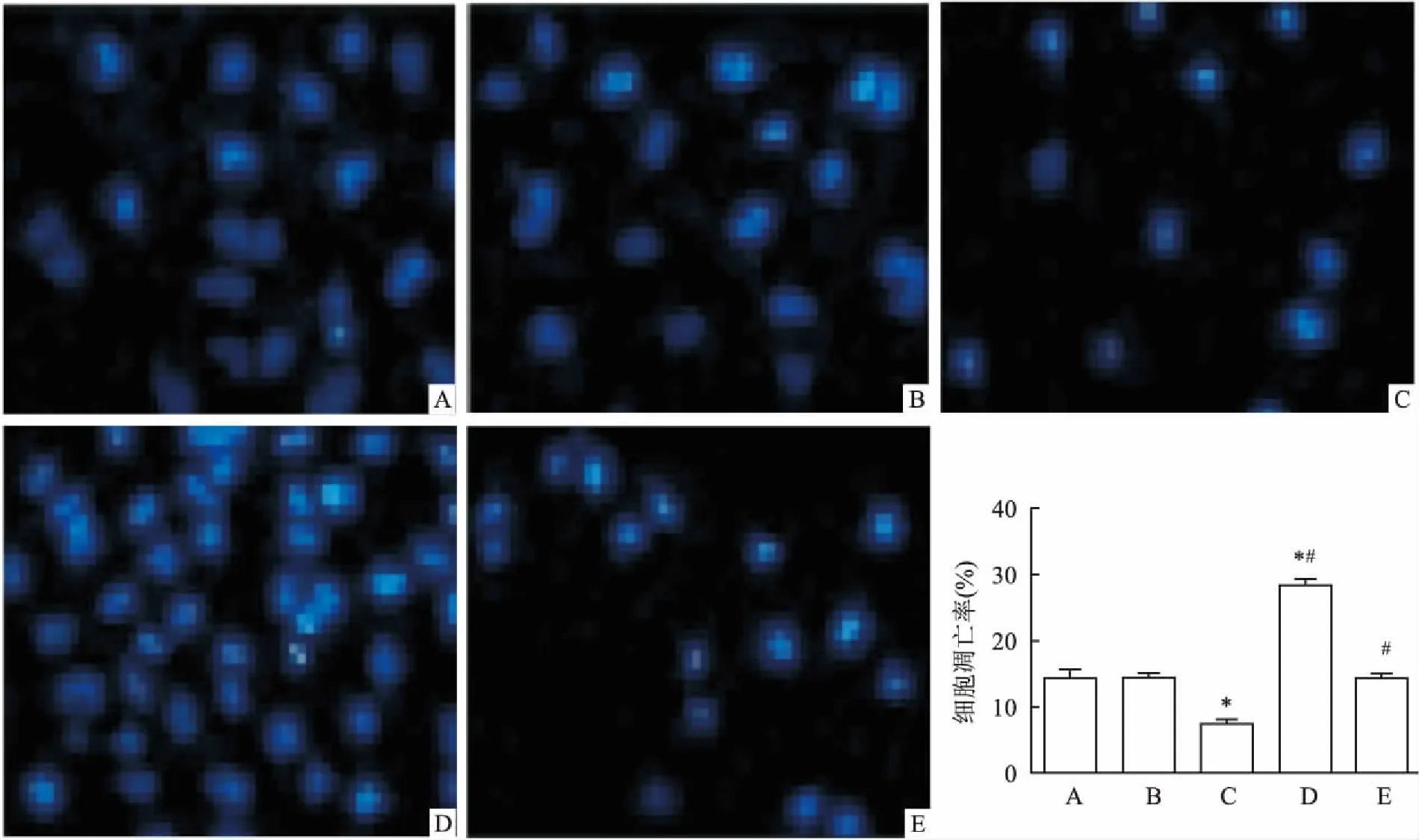
图8 各组细胞的凋亡染色图检测 ×200
A:空白对照组;B:阴性对照组;C:miR-22 mimic组;D:miR-22 inhibitor组;E:miR-22 inhibitor + si NLRP3组;与空白对照组比较:*P<0.05;与miR-22 mimic组比较:#P<0.05

表2 各组细胞炎症因子表达水平
与空白对照组比较:*P<0.05;与miR-22 mimic组比较:#P<0.05
3 讨论
据2010全球疾病负担报告分析,冠心病是当今影响全球死亡病例与入院治疗人群的主要原因之一。本研究显示miR-22通过靶向抑制NLRP3基因,减少冠心病大鼠心肌微血管内皮细胞凋亡及下调促炎症因子IL-1β、IL-6和IL-18的表达,从而发挥对大鼠心肌微血管内皮细胞的保护作用。
首先,本实验结果显示,与正常组比较,AS组大鼠心肌组织中miR-22水平显著下调,而NLRP3和caspase-1表达水平显著上调。NLRP3炎性体是目前结构和功能最为明确的炎性体之一,也是NLR家族的重要成员之一,主要由NLRP3、caspase-1和凋亡相关微粒蛋白(ASC)组成。NLRP3炎性体在动物动脉粥样硬化(AS)斑块中被激活,并且在冠心病患者主动脉中存在着过度表达,其表达水平与冠心病的严重程度相关[11]。经过双荧光素梅检测报告验证,NLRP3是miR-22的靶向基因。与空白对照组比较,miR-22 mimic组NLRP3、caspase-1的表达水平显著下降,而miR-22 inhibitor组的NLRP3、caspase-1的表达水平显著上升。本研究结果显示miR-22过表达可增强冠心病大鼠心肌微血管内皮细胞活力,并使细胞凋亡率下降。因此,miR-22可靶向抑制NLRP3减少冠心病大鼠心肌微血管内皮细胞凋亡。
与此同时,NLRP3炎症小体在冠状动脉粥样硬化炎症机制中发挥重要作用,被激活的NLRP3炎症小体,诱发caspase-1活化,进而促进白介素1β前体(pro-IL-1β)及pro-IL-18的成熟和分泌[12]。动脉硬化过程中,磷酸钙结晶体激活caspase-1,巨噬细胞中释放炎性因子IL-1β和IL-1α,促进动脉粥样硬化斑块形成[13]。与本研究结果一致,本研究显示miR-22 mimic组的IL-1β、IL-6和IL-18炎症因子表达水平下调。目前所知的IL-1家族一共包括了11个成员,IL-1α、IL-1β、IL-1 receptor agonist (IL-Ra)、IL-18、IL-1F5、IL-1F6、IL-1F7、IL-1F8、IL-1F9、IL-1F10与IL-33[14]。IL-1β通过结合IL-1受体1,是重要的炎症信号之一[15]。由此,可得出结论,miR-22通过靶向抑制NLRP3基因下调促炎症因子IL-1β、IL-6和IL-18的表达,减轻细胞炎症损伤。
综上,本研究显示miR-22通过靶向抑制NLRP3基因,减少冠心病大鼠心肌微血管内皮细胞凋亡,下调促炎症因子IL-1β、IL-6和IL-18的表达,从而保护大鼠心肌微血管内皮细胞,减少内皮细胞炎症损伤。这一发现或许会为冠心病的临床治疗提供一个新的研究方向。然而,该发现尚未得到临床数据的支持,因此接下来将进一步研究miR-22应用于冠心病的临床治疗的作用与分子机制。
