新型登革病毒RNA聚合酶小分子抑制剂Z1降低登革病毒复制和感染的研究
2018-06-08郭颂欣何士俊黄翠红姚新刚刘叔文
郭颂欣,何士俊,黄翠红,姚新刚,刘叔文
(南方医科大学药学院,广东省新药筛选重点实验室,广州市新发病毒防治药物研究重点实验室,广东 广州 510515)
登革病毒(dengue virus,DENV)属黄病毒科,黄病毒属(Flaviviridae),是一种具有包膜的单股正链RNA病毒[1]。随着城市化进程和全球气候变暖,登革病毒已成为当今世界上分布最广的虫媒病毒,该病毒具有4个血清型,主要流行在亚州、非州及南美州的热带和亚热带地区[2-3]。感染该病毒后,引起机体出现一系列自限性发热性疾病,如发热等,严重时为致命的登革出血热(dengue hemorrhagic fever,DHF)和登革休克综合征(dengue shock syndrome,DSS)[1]。据估计,全球范围内每年约有5 000万到1亿登革热感染病例,50万例登革出血热,其中25 000人不治而亡[1]。近年来,登革热病例正在迅猛增加,这种致命的传染病已威胁到全球三分之一人口的健康安全[1]。然而遗憾的是,至今没有安全有效的用于治疗和预防登革病毒感染疾病的药物,因此,急需寻找和开发抗登革病毒药物。
登革病毒基因组是全长10.3 kb的单股正链RNA,翻译表达为1条多蛋白前体,随后被宿主蛋白酶和病毒的NS2B/NS3蛋白酶切割为10种成熟的蛋白,包括3种与病毒血清型区分和参与病毒吸附进入有关的结构蛋白(C、PrM、E),以及7种与免疫逃避和病毒复制有关的非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)[4]。NS5是病毒最大的蛋白,相对分子质量为104 ku,约含900个氨基酸,在4种基因型中结构最为保守[5]。其N端具有SAM依赖的RNA甲基转移酶结构域,参与病毒基因组RNA的5’端加帽,C端具有RNA依赖的RNA聚合酶(RdRp)活性和核苷酸末端转移酶活性[5]。NS5的RdRp在病毒复制酶系统中起不可替代的作用,在病毒复制时,RdRp协助负链RNA的从头合成,随后以该负链RNA为模板复制产生病毒基因组[5]。本研究基于SPR高通量筛选技术,筛选与NS5 RdRp结合的小分子多取代二氢吡咯烷酮衍生物,通过细胞实验验证其抗登革病毒作用,并对其抗病毒的机制进行初步探讨,研究结果将为开发有效的防治登革病毒药物奠定基础。
1 材料与方法
1.1材料
1.1.1细胞与病毒 DENV2病毒新几内亚株,由南方医科大学公共卫生与热带医学院陈晓光教授提供。BHK-21细胞由本科室保存, C6/36细胞由南方医科大学公共卫生与热带医学院提供,培养方法参照ATCC细胞库指示。
1.1.2试剂 His标签蛋白琼脂糖高速纯化树脂(上海翊圣生物科技有限公司);异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)诱导剂、噻唑蓝(MTT)、利巴韦林(ribavirin),均购自Sigma公司;咪唑(imidazole,广州浩玛生物科技有限公司);乳酸脱氢酶试剂盒(lactate dehydrogenase, LDH, 碧云天生物技术有限公司);TRIzol试剂(Ambion公司);5×PrimeScript RT Master Mix(TaKaRa公司);GoTaq® qPCR Master Mix (Promega公司);E抗体(dengue virus envelope protein antibody,GeneTex公司);NS1抗体(dengue virus NS1 glycoprotein antibody,Abcam公司)。
1.1.3仪器 Genios Pro型Tecan酶标仪(Tecan公司);Milli-Q超纯水机(Millipore公司);7500型实时荧光定量PCR仪(ABI公司);FluorChem R多功能成像分析系统(Protein Simple公司);倒置激光共聚焦显微镜 (ZEISS公司);生物分子相互作用分析仪(Plex Array HT公司)。
1.2方法
1.2.1登革病毒NS5 RdRp的表达与纯化 将NS5 RdRp表达基因克隆于pET15b His标签载体上,在BL21上进行表达,37 ℃培养至OD值 0.5~0.6,加入100 mg·L-1IPTG诱导剂18 ℃诱导16 h。细菌超声破菌30 min,收集含有NS5 RdRp的上清。NS5 RdRp蛋白用镍柱亲和层析法及咪唑梯度洗脱纯化,各组分蛋白在SDS-聚丙烯酰胺电泳分离后,用考马斯亮蓝染色液染色。收集含杂质较少的组分装入透析袋,在没有咪唑的蛋白缓冲溶液中4 ℃透析24 h,超滤管浓缩,分子筛进一步纯化后,-80 ℃冰箱保存。
1.2.2LDH释放含量检测细胞活性 在细胞培养板中接种处于对数生长期的BHK-21细胞,1×108·L-1。加入病毒液,37 ℃感染1 h。药物处理组分别加入200 μL含2%胎牛血清的RPMI 1640培养基稀释至指定浓度的Z1,于37 ℃、5% CO2培养条件下培养。96 h后,待病毒组细胞出现明显的细胞病变,收集上清,测上清中细胞释放的LDH含量。抑制率/%=(A病毒组-A实验组)/(A病毒组-A空白对照组)×100%。
1.2.3蛋白免疫印迹检测病毒蛋白含量 按上述设置阳性药物组、病毒组、空白对照组、药物处理组,48 h后,RIPA裂解液收取细胞总蛋白。在10% SDS-聚丙烯酰胺凝胶上电泳,转膜,封闭,孵育一抗以及二抗,显影、定影。
1.2.4实时荧光定量PCR检测病毒mRNA水平 在加入药物处理48 h后,提取各组细胞总mRNA。随后参照TaKaRa说明书将mRNA逆转录为cDNA。各引物序列见Tab 1。根据各样品的CT值,运用2-ΔΔCт法算出各样品相对于对照组的mRNA水平。
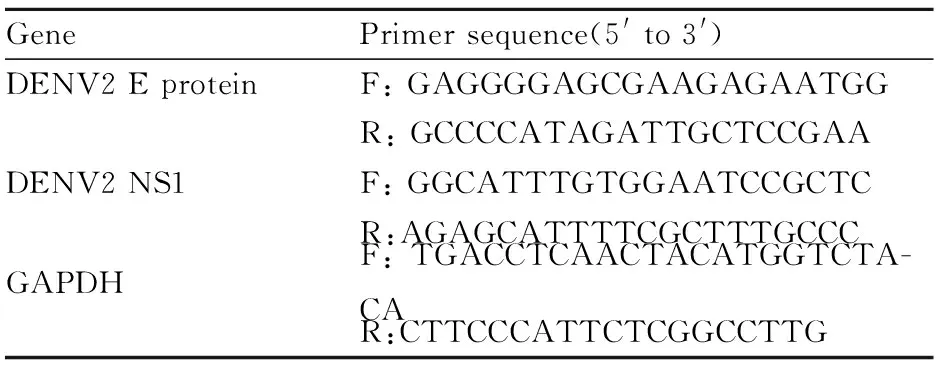
Tab 1 Primer sequence of qRT-PCR
1.2.5激光共聚焦显微镜观察病毒蛋白的分布与含量 BHK-21细胞感染病毒及化合物处理如上述,在病毒感染后的48 h,依次加入3 g·L-1BSA配制的登革病毒包膜蛋白或非结构蛋白1一抗、二抗,在激光共聚焦显微镜下拍照。
1.2.6空斑实验 将C6/36细胞接种至24孔培养板,然后将不同稀释度的病毒稀释液分别加入24孔培养板,每孔200 μL,每个稀释度2个复孔。同时设阴性及阳性对照。将24孔板置于37 ℃、5% CO2培养箱吸附1 h。然后吸出病毒液,每孔加入500 μL 2.4 g·L-1甲基纤维素覆盖培养基。培养4~6 d后,至病毒空斑明显时,固定,结晶紫染色,计算空斑的数量[6]。
1.2.7表面等离子共振法检测Z1与NS5蛋白相互作用 Z1打印在3D光交联芯片上,芯片进行真空干燥处理,在光交联仪器进行光交联反应。NS5 RdRp蛋白样品浓度为1 g·L-1,通过加入相应量的蛋白缓冲溶液稀释为3个梯度浓度:400、800、1 600 nmol·L-1。依次加载不同浓度梯度的NS5蛋白样品各650 μL,流速为2 μL·s-1,结合反应温度为16 ℃,结合时间为300 s,解离时间为300 s。随后,用Glycine-HCl(pH=2.0)溶液作为重生液(用超纯水配制),进行重生。
1.2.8统计学分析 运用Prism 5.0软件进行统计学分析,组间比较采用Student’st检验,多组比较采用单因素One-way ANOVA分析。
2 结果
2.1小分子化合物Z1与DENV2NS5RdRp相结合我们构建了带有His标签的NS5 RdRp蛋白(273-900)表达纯化体系,得到纯度达到90%以上的蛋白NS5 RdRp,其考马斯亮蓝PAGE图如Fig 1A所示。运用表面等离子技术(SPR)高通量筛选小分子化合物库,发现小分子化合物Z1(Fig 1B)与NS5 RdRp结构域具有明显的结合活性(Fig 1C)。用软件对实验结果进行数据拟合,得到ka=7.44×103Ls·mol-1,kd=7.17×10-4·s-1,KD=9.63×10-8mol·L-1,表明Z1和NS5有较强亲和性,结果显示Z1是一种新型的DENV2 NS5 RdRp小分子配体。

Fig 1 Affinity between Z1 and NS5 RdRp
A: Coomassie brilliant blue staining map of NS5 RdRp purification. M: Protein marker. The arrow indicates the NS5 RdRp protein about 70 KD; B: Structure of Z1; C: SPR-based binding assay of DENV-2 NS5 with Z1.
2.2Z1抑制DENV2诱导的细胞病变和细胞死亡MTT结果显示,Z1在1.25、2.5、5、10 μmol·L-1浓度下,对BHK-21细胞毒性较低(Fig 2I),使用上述浓度可排除其细胞毒性对活性检测的影响。DENV2感染后,在胞质内质网区域内引起细胞骨架和膜室的广泛重组,形成 “病毒工厂”以生产子代病毒[7],导致细胞出现细胞病变效应(cytopathic effect , CPE)。BHK-21细胞感染DENV2后,在d 4出现明显的细胞病变效应,表现为有退行性的形态学改变,细胞间紧密连接降低使细胞脱离,膜的降解,最终死亡[8-9](Fig 2B)。而在感染后给予广谱抗病毒药利巴韦林(ribavirin, 40 μmol·L-1),在d 4时细胞形态正常(Fig 2C)。而Z1处理后,细胞病变呈浓度依赖性减弱,至1.25 μmol·L-1时活性消失,表明化合物Z1具有浓度依赖抑制登革病毒感染的活性(Fig 2D-2H)。随后以LDH的含量作为Z1抑制DENV2活性的定量描述,发现感染DENV2后的BHK-21 LDH释放量明显升高,而Z1对DENV2引起的LDH升高有浓度依赖的抑制作用,其半数有效浓度(EC50)为4.75 μmol·L-1(Fig 2J), 进一步表明Z1能有效抑制DENV2导致的BHK-21死亡,可保护感染的宿主细胞。接着,我们通过经典的空斑实验,进一步检测化合物Z1对病毒子代颗粒产生的抑制效果。发现2.5、5、10 μmol·L-1的Z1对空斑形成的抑制率分别为2.04%、9.39%、88.16%,说明Z1浓度依赖地抑制子代病毒的产生(Fig 2K)。以上实验表明,Z1具有抗登革病毒感染和抑制病毒增殖活性。
2.3Z1抑制DENV2的RNA合成实时荧光定量PCR检测病毒E和NS1的mRNA水平,发现5、10 μmol·L-1Z1浓度依赖地降低细胞内DENV2 E蛋白和NS1的RNA水平(Fig 3A)。正链RNA病毒DENV2在复制时,会产生能被J2抗体识别的复制中间体dsRNA[10]。通过J2抗体对dsRNA进行标记,激光共聚焦实验显示,明亮绿色荧光聚集在胞质呈点状分布,表明在这些区域存在大量的病毒复制中间体dsRNA。而在5 μmol·L-1Z1处理下,DENV2的复制中间体dsRNA含量明显减少(Fig 3B),表明Z1抑制病毒RNA复制合成,即Z1作用于NS5的RdRp结构域,并抑制其RNA聚合酶的活性,从而抑制RNA的复制。
2.4Z1抑制DENV2的蛋白合成在感染DENV2 48 h后,Western blot检测细胞内病毒包膜蛋白含量,发现在2.5、5、10 μmol·L-1Z1处理后,呈浓度依赖减少,表明病毒包膜蛋白的合成受到抑制(Fig 4A)。另外,激光共聚焦显微镜600倍镜下,在感染DENV2的BHK-21细胞内,病毒E和NS1在胞质大量分布,表明DENV2在胞质进行活跃蛋白合成,这与前人研究发现DENV2在内质网完成蛋白合成实现增殖过程一致。而在5 μmol·L-1化合物Z1处理下,病毒包膜蛋白E(Fig 4B)和非结构蛋白NS1(Fig 4C)在胞质的累积减少,证明Z1影响病毒蛋白合成。
2.5Z1阻止DENV2的早期复制阶段为确认小分子化合物Z1的抑制作用是作用于DENV2的进入,还是进入后阶段,我们分别在DENV2感染前、感染后给予5、10 μmol·L-1Z1处理。结果表明,当用以下两种方式处理时,即DENV2感染前用Z1处理细胞在感染时撤去,以及在Z1存在下感染DENV2,Z1的病毒RNA合成抑制活性消失,抑制子代病毒释放活性消失,且失去了对DENV2感染细胞细的保护作用;只有在DENV2感染后,Z1持续处理细胞能抑制DENV2引起的细胞死亡,抑制病毒RNA合成,以及抑制子代病毒释放(Fig 5)。表明Z1只对感染了DENV2的BHK-21细胞有保护作用,该结果表明Z1作用于DENV2的早期复制阶段。
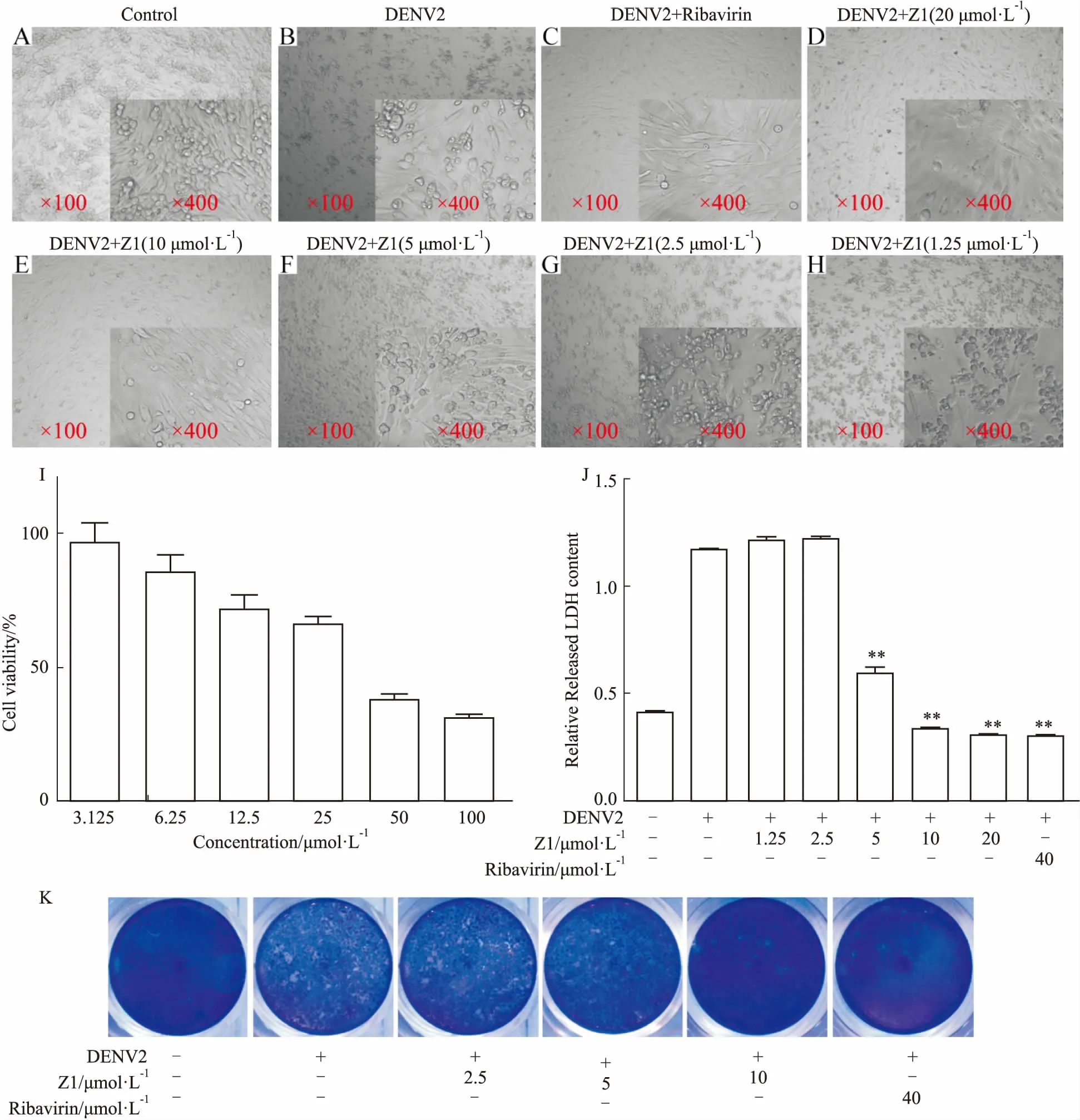
Fig 2 Z1 protected DENV2-infected cells from death in cell-based assay
A-H: Morphological changes of Z1 treated and DENV2 infected BHK-21 cells at 96hpi; I: Cytotoxicity of BHK-21 in Z1 by MTT assay; J: The effect of Z1 on LDH released by DENV2 infected BHK-21 cells by LDH assay at 96hpi; K: Effect of Z1 on DENV2 production by plaque assay at 48hpi.**P<0.01vsDENV2 infected group without treatment.
3 讨论
登革疫情日益严峻,目前仍无有效的药物,因此,抗登革病毒药物的研发迫在眉睫[11]。在登革感染病例中,二次感染异型病毒产生的抗体依赖感染增强作用,使患者更容易出现致死率更高的引起出血和休克的DHF和DSS,于是抗登革药物的研发应倾向于能广泛抑制DENV的4种血清型[1]。登革病毒NS5是具有多种功能的非结构蛋白,在病毒基因组的复制中承担核心作用,针对其结构保守的RdRp结构域设计的抑制剂可以研发成为广谱的抗登革药物[5]。

Fig 3 Inhibition of compound Z1 on DENV RNA replication
A:The effect of 2.5, 5, 10 μmol·L-1Z1 on E and NS1 mRNA in BHK-21 cells was examined by RT-PCR at 48hpi.**P<0.01vsDENV2 infected group without treatment; B: dsRNA was monitored by laser scanning confocal microscopy in BHK-21 at 48hpi. Arrows indicate the stained dsRNA.
许多有临床价值如抗炎、抗肿瘤、抗HIV、抗老年痴呆等的化合物都含有吡咯烷酮的母核结构[12-13]。已有文献报道,这类化合物具有抑制caspase-3酶活化,抗凋亡的活性[14]。运用我们科室已验证的NS5 RdRp蛋白表达纯化平台,结合SPR技术,寻找能与NS5 RdRp结合并能抑制其活性的含有吡咯烷酮母核结构的小分子化合物,最终发现,这类化合物中的Z1与 NS5 RdRp有明显结合能力,具有潜在的抗登革病毒作用。CPE和空斑形成实验是验证药物抗病毒活性的金标准[1]。因此,在细胞水平上,我们通过3种细胞实验验证候选化合物Z1的抗病毒活性。CPE抑制实验从细胞感染DENV2后的CPE出发,具有抗病毒活性的小分子化合物能抑制病毒增值感染过程,减少病毒载量,从而减轻感染细胞膜结构破坏。LDH实验中,LDH释放量是细胞毒性指标,是我们定量化合物抗病毒活性的主要方法。空斑实验显示Z1浓度依赖的登革抑制活性。3种细胞实验的验证充分说明了Z1的抗病毒效果。随后我们发现,其对HIV病毒和流感病毒并没有明显的抑制活性,而对登革其他血清型(DENV1、DENV4)同样具有抑制活性,很有可能是广谱的抗登革病毒药物。既然Z1具有抗病毒活性,又存在NS5 RdRp亲和性,那么Z1的抗病毒活性有可能通过抑制RdRp活性实现的。为了验证这一点,我们以5 μmol·L-1Z1处理细胞进行后续的实验,此时Z1具有抗病毒活性,细胞存活率大于84.96%。由于NS5 RdRp在病毒RNA基因组复制中的关键作用,我们检测Z1对病毒RNA合成水平,发现均有浓度依赖的抑制作用,表明Z1通过抑制NS5 RdRp活性,从而抑制RNA复制。dsRNA在病毒的复制过程中产生,主要是正链RNA复制时形成的正链负链RNA产生的双链RNA[15],当NS5 RdRp的从头合成活性受到抑制时,dsRNA形成减少,因此Z1再次被证实通过抑制NS5 RdRp,从而抑制RNA复制,是一种NS5 RdRp小分子抑制剂。随后,我们检测Z1处理后DENV2的蛋白合成水平,发现Z1浓度依赖抑制蛋白合成,证实继RNA合成减少后,蛋白合成也减少。

Fig 4 The inhibitory effect of compound Z1 onDENV protein synthesis
A: The effect of 2.5, 5, 10 μmol·L-1Z1 on E protein in BHK-21 cells was examined by Western blot at 48hpi; B-C: Infection was monitored by laser scanning confocal microscopy with antibody against the E protein (B) and the NS1 protein (C) in BHK-21 at 48hpi. Arrows indicate the stained E protein (B) and NS1 protein (C).

Fig 5 Compound Z1 inhibited early stage of DENV life cycle
Time course of the effect of 5 or 10 μmol·L-1Z1 on dengue virus infection in BHK-21 cells by LDH assay (A), and plaque assay (B) , RT-PCR (C) at 48hpi. For ‘‘pre’’ conditions, cells were pre-incubated with Z1. For ‘‘co’’ conditions, Z1 was present during the 1-hr incubation of viral inoculum with cells. For ‘‘post’’ conditions, Z1 was added following the initial 1-hr infection and washes. For ‘‘co+post’’ conditions, Z1 was present during and following the 1-hr incubation of viral inoculum with cells.**P<0.01vsDENV2 infected group without treatment.
从头合成RNA活性受到抑制,对病毒复制的早期阶段产生影响,因此用时间点实验进一步验证Z1只有在感染后才具有抗病毒效果,结果表明,Z1作用于病毒进入后的早期复制阶段。而在感染前处理没有抑制效果,表明Z1不影响细胞表面吸附的受体,也没有增强细胞内抗病毒相关的信号,Z1的作用靶点不在细胞上。在感染时处理依然没有抑制效果,表明Z1对DENV2并没有杀伤功能,并非作用于病毒结构蛋白,没有影响DENV2与细胞表面受体的结合,对DENV2的吸附进入过程没有影响。再次证实了Z1通过抑制NS5 RdRp活性,从而抑制RNA复制,抑制病毒增殖的猜想。
因此,在本研究中,Z1在DENV2病毒感染的早期发挥作用,通过作用于病毒NS5抑制早期病毒的RNA合成,进而降低了病毒自身关键蛋白的合成,达到抗DENV2病毒的效果。这类之前没报道过的具有NS5RdRp抑制活性的小分子化合物可以作为抗登革病毒先导化合物,通过结构改造进行药物研发。而Z1的NS5 RdRp抑制机制如何发生,仍需进一步探索研究。
(致谢:本实验在南方医科大学药学院病毒免疫药物药理组实验室完成,病毒相关实验在生物安全2级实验室完成。感谢南方医科大学药学院有机功能材料学科组朱秋华教授提供的化合物。感谢南方医科大学公共卫生与热带医学院陈晓光教授提供的登革病毒。)
[1] Boldescu V, Behnam M A M, Vasilakis N, et al.Broad-spectrum agents for flaviviral infections: dengue, Zika and beyond[J].NatRevDrugDiscov, 2017,16(8): 565-86.
[2] Bhatt S, Gething P W, Brady O J, et al.The global distribution and burden of dengue[J].Nature, 2013,496(7446): 504-7.
[3] Dengue—an infectious disease of staggering proportions[J].Lancet, 2013,381(9884): 2135-222.
[4] Martin-Acebes M A, Vazquez-Calvo A, Saiz J C.Lipids and flaviviruses, present and future perspectives for the control of dengue, Zika, and West Nile viruses[J].ProgLipidRes, 2016,6: 123-37.
[5] Lim S P, Noble C G, Shi P Y.The dengue virus NS5 protein as a target for drug discovery[J].AntiviralRes, 2015,119: 57-67.
[6] 盛子洋, 王 娟, 吴江漫, 等.利用甲基纤维素改良的病毒噬斑技术[J]. 免疫学杂志, 2012,28(4): 363-8.
[6] Sheng Z Y, Wang J, Wu J M, et al. The improvements of plaque assay using methylcellulose [J].ImmunolJ, 2012,28(4): 363-8.
[7] de Armas-Rillo L, Valera M S, Marrero-Hernandez S, et al.Membrane dynamics associated with viral infection[J].RevMedVirol, 2016,26(3): 146-60.
[8] Cheng M S, Lau S H, Chan K P, et al.Impedimetric cell-based biosensor for real-time monitoring of cytopathic effects induced by dengue viruses[J].BiosensBioelectron, 2015,70: 74-80.
[9] Pastorino B, Nougairede A, Wurtz N, et al.Role of host cell factors in flavivirus infection: implications for pathogenesis and development of antiviral drugs[J].AntiviralRes, 2010,87(3): 281-94.
[10] Son K N, Liang Z G, Lipton H L.Double-stranded RNA is detected by immunofluorescence analysis in RNA and DNA virus infections, including those by negative-stranded RNA viruses[J].JVirol, 2015,89(18): 9383-92.
[11] Patz J A, Frumkin H, Holloway T, et al.Climate change: challenges and opportunities for global health[J].JAMA, 2014,312(15): 1565-80.
[12] Zhu Q, Huang L, Chen Z, et al.A new series of C-6 unsubstituted tetrahydropyrimidines: convenient one-pot chemoselective synthesis, aggregation-induced and size-independent emission characteristics[J].Chemistry, 2013,19(4): 1268-80.
[13] 赵肖涯, 陆仲夏, 杜丽君, 等.雷丸蛋白pPeOp诱导胃癌细胞SGC-7901凋亡机制研究[J]. 中国药理学通报, 2017,33(9): 1271-7.
[13] Zhao X Y, Lu Z X, Du L J, et al. Apoptosis mechanism of gastric cancer cell SGC-7901 induced by Omphalia lapidescens protein pPeOp [J].ChinPharmacolBull, 2017,33(9): 1271-7.
[14] Zhu Q, Gao L, Chen Z, et al.A novel class of small-molecule caspase-3 inhibitors prepared by multicomponent reactions[J].EurJMedChem, 2012,54: 232-8.
[15] Chatel-Chaix L,Bartenschlager R.Dengue virus- and hepatitis C virus- induced replication and assembly compartments: the enemy inside-caught in the web[J].JVirol, 2014,88(11): 5907-11.
