酿酒酵母细胞壁诱导体外培养绵羊瘤胃上皮细胞表达SBD-1的研究
2018-06-07田巧珍张召议王云鹤杨银凤
田巧珍,金 鑫,张 曼,张召议,王云鹤,杨银凤
(内蒙古农业大学兽医学院 农业部动物疾病临床诊疗技术重点实验室,呼和浩特 010018)
随着经济的转型,畜牧业正向规模化、集约化、高密度的养殖模式过渡。舍饲或半舍饲模式成为我国畜牧业的主要模式,由此导致畜禽疾病感染率增高。滥用抗生素引起的病原菌耐药性增强、畜产品抗生素残留超标等问题愈发严重[1],如何提高动物机体自身免疫成为兽医工作者的新课题。
防御素是一种广泛存在于生物界中的阳离子抗菌肽,是宿主抵御外来物的基础[2]。β-防御素广泛存在于哺乳动物和禽类体内,在上皮细胞、白细胞、血浆、尿液及多种组织中均有表达[3-5]。在绵羊体内,目前鉴定出2种β-防御素,被命名为绵羊β-防御素-1、-2(Sheep beta-defensin -1、-2,SBD-1、SBD-2)[6]。通过RT-qPCR检测发现,SBD-2 mRNA只表达于舌和远端回肠,SBD-1 mRNA却在气管和整个消化道(从舌~结肠)广泛表达[7]。研究表明,绵羊防御素的转录产物主要在上皮细胞中发现,且转录产物含量最多的是瘤胃上皮组织[6],由此可推断,β-防御素是绵羊瘤胃上皮内发挥天然免疫作用的重要成员。
动物机体的益生菌群与黏膜免疫系统之间呈积极和谐的关系,益生菌在预防病原菌定植和维持肠道黏膜免疫中发挥着无可替代的作用[8]。益生菌黏附、定植于胃肠道上皮细胞是其发挥益生作用的基础,因此上皮细胞是益生菌发挥益生作用的重要媒介[9]。益生性大肠杆菌 Nissle1917的鞭毛蛋白可以诱导人肠上皮细胞Caco-2表达β-防御素-2(hBD-2)[10]。乳酸菌和VSL#3菌能联合增加肠道的免疫屏障功能,其作用机制主要涉及炎症通路,包括NF-κB和AP-1及MAPK诱导上调hBD-2[11]。黎观红等[12]研究结果显示,鼠李糖乳酸杆菌LGA能够促进鸡小肠上皮细胞后抗菌肽β-防御素-9的表达。本试验室研究团队前期进行了酿酒酵母等益生菌与防御素相关的研究[13-15]。尽管刘龙海等[16]研究了酿酒酵母菌发酵液的体外抑菌活性,但益生菌发挥益生作用的有效成分和机理目前还不是十分清楚。
酿酒酵母在酿酒、制药、食品等行业中有着极高的应用价值。酵母细胞壁位于酵母细胞最外层与生长外环境直接接触,它对维持酵母菌自身形态构造、渗透压、物质代谢、免疫识别等至关重要[17]。迄今为止,关于酿酒酵母细胞壁与哺乳动物特别是反刍动物防御素表达的研究尚未见报道。本试验通过采用酿酒酵母细胞壁刺激绵羊瘤胃上皮细胞,检测不同浓度、不同时间酵母细胞壁作用绵羊瘤胃上皮细胞的SBD-1 mRNA和蛋白表达的变化,为从菌体表面抗原与上皮细胞抗菌肽表达关系的角度解析防御素发挥非特异性免疫的机制提供更多的理论基础。
1 材料与方法
1.1 试验材料
酿酒酵母菌菌株购于中国微生物菌种网(编号:CGMCC 2.614)。瘤胃组织取自内蒙古呼和浩特市北亚屠宰场。6月龄的健康蒙古绵羊屠宰后,立刻剪取约10 cm×10 cm大小的瘤胃组织,用无菌的含双抗和两性霉素的磷酸盐缓冲液(PBS)充分洗净后,带回试验室备用。
1.2 主要仪器与试剂
仪器:CO2培养箱(Thermo)、显微成像系统(Analytik Jena,German)、多功能酶标仪(SynergyTMH4,Biotek)、超声波细胞破碎仪(QSONICA Q700 Sonicator)、实时荧光定量PCR仪(Q7,ABI)、激光共聚焦显微镜(ZEISS,German)。
试剂:DEME/F12培养基(GLIBCO)、FAST200总RNA极速抽提试剂盒(飞捷公司)、TAKARA反转录试剂盒(RR047A)、Glass beads(425~600 μm,Sigma)、TaKaRa荧光定量PCR酶(RR820A)、绵羊防御素β1(DEFβ1)ELISA试剂盒(ELA06599Sh)、Ms m Ab to Cytokeratin 18[c-04]、Goat anti-mouse IgG-FITC SC-2010(武汉新启迪生物公司)。
1.3 试验方法
1.3.1 酿酒酵母菌培养及生长曲线的测定 将活化的菌种接种于麦芽汁培养基中,28 ℃、180 r·min-1培养48 h,用于发酵种子。将发酵液按5%的接种量接种到麦芽汁培养基中,相同条件培养48 h,每隔3 h取适量菌液测定OD600 nm值,绘制生长曲线。将酵母培养液按5%的接种量接种到麦芽汁培养基中扩大培养,在生长刚进入稳定期时停止培养,离心收集菌体沉淀,用灭菌的PBS洗涤3次,冷冻干燥,-80 ℃超低温冰箱保存备用。
1.3.2 酿酒酵母细胞壁的提取及成分分析 采用玻璃珠和超声波相结合的破碎方法,称取10 g冻干酵母细胞,用灭菌PBS悬浮,在冰浴条件下,进行超声波细胞破碎(工作2 s/间歇2 s、30 min、功率70 W),然后4 ℃、3 000 r·min-1离心10 min,去除上清液,反复超声破碎2次;破壁完成后,用2% SDS缓冲液沸水浴10 min;室温离心取沉淀,用PBS反复洗涤沉淀4~5次,直到离心上清透明为止,把沉淀冷冻干燥即为酿酒酵母菌全细胞壁成分,-80 ℃超低温冰箱保存备用。采用凯氏定氮法测定细胞壁蛋白质含量,酸水解法测定脂肪含量,HPLC测定葡聚糖含量,气相色谱法测定甘露聚糖,X衍射检测几丁质含量(送上海复昕检测公司测样)。
1.3.3 绵羊瘤胃上皮细胞的培养及鉴定 将瘤胃组织块钝性分离去除浆膜、肌层、黏膜下层,置于含1 000 U·mL-1青霉素、1 mg·mL-1链霉素、5 μg·mL-1两性霉素的DPBS溶液中;在超净工作台,用含有抗生素的DPBS溶液反复洗涤浸泡30 min后,用含EDTA的0.25%胰蛋白酶进行时间梯度消化并收集消化液中的细胞,离心、洗涤后,分装于细胞培养瓶中,在37 ℃、5% CO2培养箱培养。当原代细胞长到80%以上时传代,至第3代时,接种于6孔细胞培养板,用于后续的细胞诱导表达试验。采用免疫荧光法鉴定绵羊瘤胃上皮细胞:将无菌盖玻片置于培养皿中进行细胞爬片培养,细胞生长到50%时,取出盖玻片,依次经过4%多聚甲醛固定—0.25% Triton-100通透—5% BSA封闭后,4 ℃过夜,封闭一抗(CK18),PBST漂洗,37 ℃避光孵育荧光二抗1 h,PBST漂洗,用DAPI复染4 min,PBST漂洗后,50%甘油封片,激光共聚焦显微镜观察照相。
1.4 酿酒酵母细胞壁成分对绵羊体外瘤胃上皮细胞的刺激试验
饥饿处理后的细胞,用DPBS洗涤后,加入酿酒酵母细胞壁不同浓度(0、25、50、100、200、400 μg·mL-1)的无血清无抗生素DMEM/F12培养基,培养12 h后,分别提取各组总RNA,以确定最佳诱导浓度;每孔加入200 μg·mL-1酿酒酵母细胞壁浓度的无血清无抗生素DMEM/F12培养基,继续培养0、2、4、8、12、24 h后,分别提取各组总RNA,以确定最佳诱导时间。
1.4.1 细胞总RNA的提取、反转录及实时荧光定量PCR 采用FAST200试剂盒,按其说明提取各试验组细胞总RNA,将提取的总RNA按反转录试剂盒(RR047A)说明书进行操作,得到的cDNA置于-20 ℃冰箱保存备用。根据SBD-1基因和管家基因β-actin序列用Oligo 6软件设计特异性引物,送上海生工公司合成,引物序列见表1。以cDNA为模板进行RT-qPCR反应,反应完成后,根据扩增曲线的Ct值计算SBD-1基因的相对表达量。本研究选用β-actin作内参,根据公式2-ΔΔCt[18]求出不同浓度和时间酿酒酵母细胞壁对绵羊瘤胃上皮细胞SBD-1基因的相对表达量,进行统计分析。

表1 实时荧光定量 PCR 引物序列Table 1 The primer sequences for real time PCR
1.4.2 ELISA检测共培养上清中SBD-1蛋白的表达及标准曲线的绘制 收集各试验组瘤胃上皮细胞培养上清,采用绵羊防御素β1(SBD-1)ELISA试剂盒检测SBD-1蛋白的表达,按其说明进行操作。运用Curve expert 1.4软件以标准品浓度作横坐标,OD450 nm值作纵坐标,用平滑线连接各标准品的坐标点,绘制标准曲线得到二次多项式拟合方程(图略)。
1.5 数据分析
数据采用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),结果用“平均值±标准差(Mean±SD)”表示,以P<0.05和P<0.01分别表示差异显著和极显著。
2 结 果
2.1 酿酒酵母菌的培养和细胞壁提取
2.1.1 酿酒酵母菌培养和生长曲线的绘制 由图1可见,酿酒酵母菌呈卵圆形具有典型的酵母细胞结构[19](0.1%吕氏美蓝染色),在12 h时酵母菌生长由对数期到达平台期,故提取此时的酵母细胞壁作为刺激物。

A.酿酒酵母菌生长曲线;B.平台期酿酒酵母形态A.The proliferation curve of S.cerevisiae; B.The morphology of S.cerevisiae during logarithmic phase图1 酿酒酵母菌培养结果Fig.1 The culture of S.cerevisiae
2.1.2 酿酒酵母细胞壁的鉴定 由图2可知,细胞壁成分中甘露聚糖占的比重最大,其余依次为葡聚糖、蛋白质、脂肪等,该酿酒酵母细胞壁的组成成分基本符合酵母细胞壁应有的各个组分的比重[19-20],说明本试验中所提取的细胞壁成分较纯,可以用于后续试验。
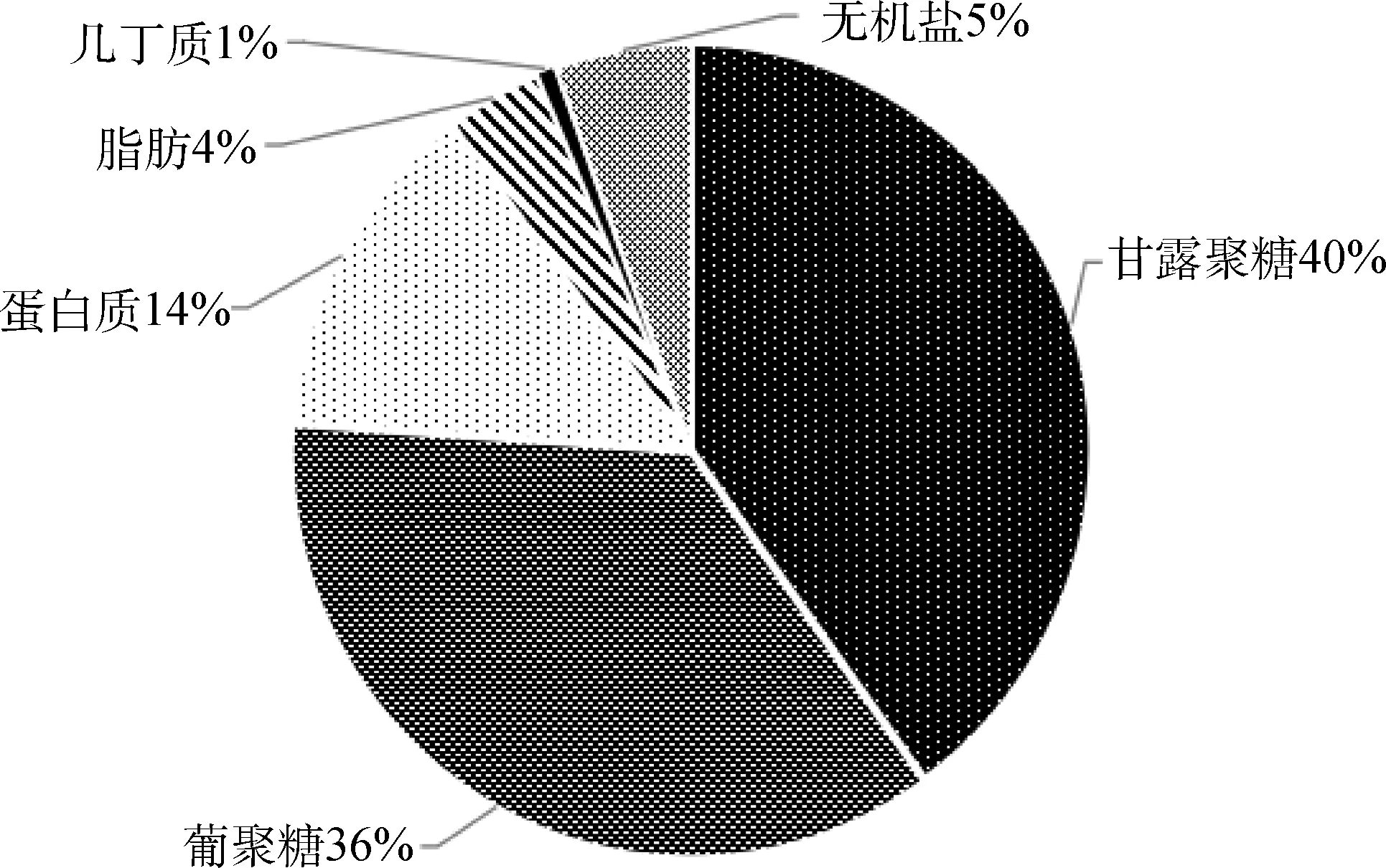
图2 酿酒酵母细胞壁成分组成Fig.2 Cell wall ingredients of S.cerevisiae
2.2 绵羊瘤胃上皮细胞培养与鉴定
2.2.1 细胞培养 将原代细胞传到第3代,可见贴壁细胞界限清晰,呈鹅卵石铺路状致密排列,符合试验要求(图3A,3B)。用酿酒酵母细胞壁刺激后,绵羊瘤胃上皮细胞形态和数量未发生明显变化(图3C,3D)。
2.2.2 细胞鉴定 用免疫荧光法检测上皮细胞中骨架蛋白CK18的表达结果见图4。结果显示,细胞内CK18的表达呈明显的阳性反应,且分布于整个细胞胞浆,角蛋白染色阳性细胞占80%以上。
2.3 酿酒酵母细胞壁诱导绵羊瘤胃上皮细胞表达SBD-1的研究
2.3.1 不同浓度酿酒酵母细胞壁对绵羊瘤胃上皮细胞SBD-1 mRNA和蛋白相对表达量的影响 如图5所示,当用不同浓度酵母细胞壁刺激绵羊瘤胃上皮细胞12 h后,200 μg·mL-1组SBD-1 mRNA相对表达量达到最大,极显著高于其它试验组(P<0.001,图5A);所以200 μg·mL-1用作试验的最佳浓度。ELISA检测结果显示,SBD-1在蛋白水平的表达趋势与在mRNA水平的表达趋势基本一致。200 μg·mL-1浓度组酵母细胞壁刺激瘤胃上皮细胞后,SBD-1蛋白表达量极显著高于对照组(P<0.001,图5B)。
2.3.2 酿酒酵母细胞壁诱导不同时间对绵羊瘤胃上皮细胞SBD-1 mRNA和蛋白相对表达量的影响 用相同浓度的酵母细胞壁(200 μg·mL-1)分别刺激绵羊瘤胃上皮细胞0、2、4、8、12、24 h,在各组内SBD-1 mRNA的表达量呈时间依赖关系,当刺激12 h时表达量达到最大,并与对照组和其他时间组相比差异均极显著(P<0.001,图6A)。ELISA检测结果如图6B所示,SBD-1的蛋白表达趋势与mRNA水平的表达趋势基本一致,12 h时酵母细胞壁刺激瘤胃上皮细胞表达SBD-1蛋白量极显著高于对照组(P<0.001)。由此确定酵母细胞壁诱导绵羊瘤胃上皮细胞表达SBD-1的最佳浓度为200 μg·mL-1,最佳时间为12 h。
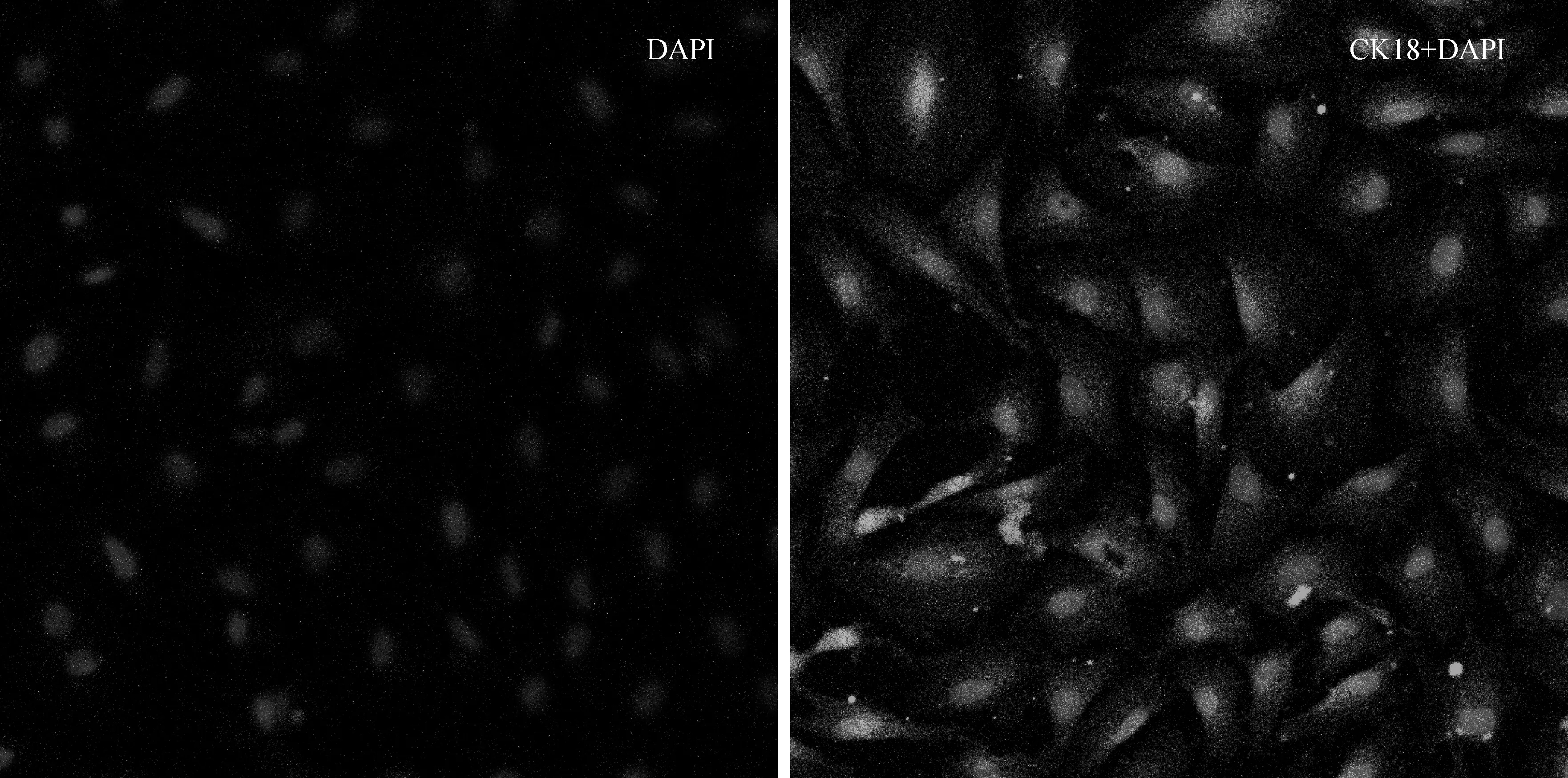
图4 瘤胃上皮细胞的免疫荧光法检测结果 (200×)Fig.4 The immunofluorescent detection of ruminal epithelial cells (200×)
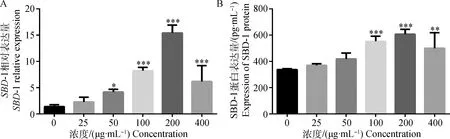
A.RT-qPCR; B.ELISA。*.P<0.05;**. P<0.01;***. P<0.001。下同A.RT-qPCR; B.ELISA.*.P<0.05;**. P<0.01;***. P<0.001.The same as below图5 不同浓度酿酒酵母细胞壁诱导瘤胃上皮细胞表达SBD-1和蛋白的结果(12 h)Fig.5 SBD-1 gene and protein expression of different concentrations of cell wall of S. cerevisiae stimulated ruminal epithelial cells (12 h)
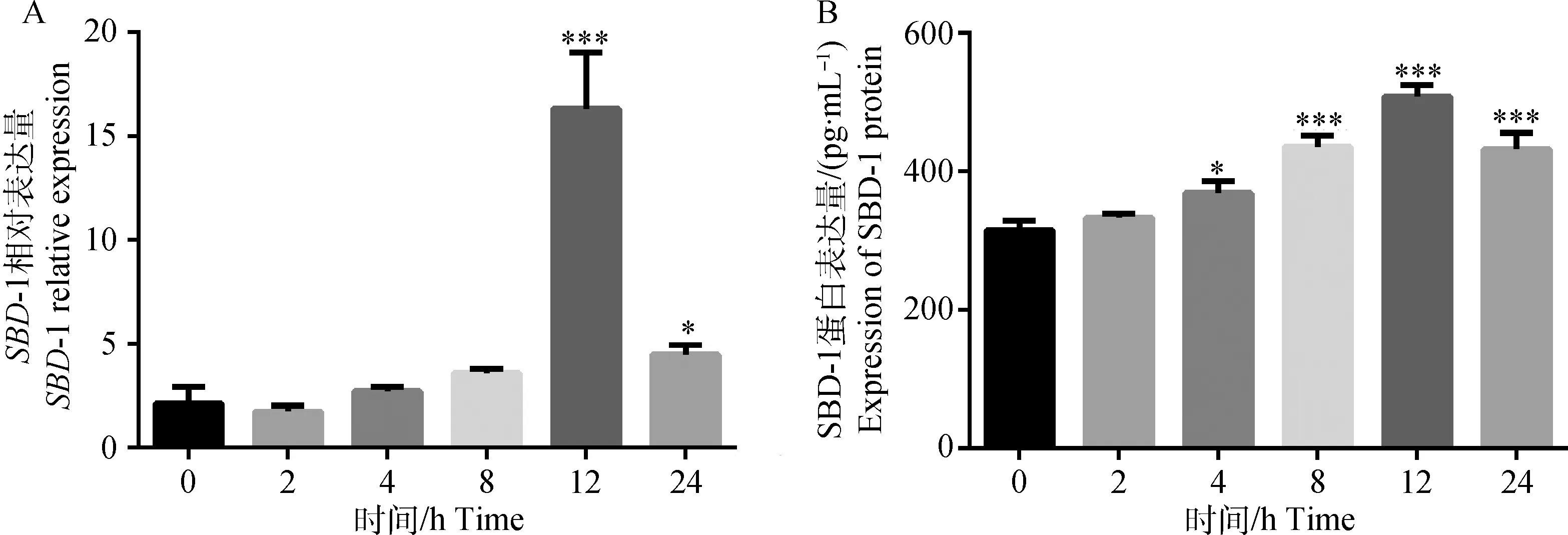
图6 酿酒酵母细胞壁诱导不同时间瘤胃上皮细胞表达SBD-1 mRNA和蛋白的结果(200 μg·mL-1)Fig.6 SBD-1 mRNA and protein expression of cell wall of S. cerevisiae stimulated ruminal epithelial cells at different times(200 μg·mL-1)
3 讨 论
抗菌肽特别是防御素在人类和家畜体内的天然免疫屏障中扮演着重要的角色,抗菌肽主要作用于病原微生物的细胞膜,且病原微生物不易对其产生耐药性,可解决传统抗生素药物导致的抗药性的难题[21-22],但在家畜体内进行的抗菌肽的相关试验仍然滞后于人。利用人结肠癌上皮细胞研究发现,益生乳酸杆菌及其他益生菌可增加防御素的表达量从而提高机体天然免疫功能,但是利用癌细胞的结果来解释正常细胞受限10,18]。此外,活体内胃肠道pH环境、胆汁和各种消化酶等均对益生菌的活力和细胞壁组分的完整性产生影响。因此,本研究利用体外原代培养的正常绵羊瘤胃上皮细胞可以有效避免这些复杂因素的干扰及肠道共生菌相互之间的影响,为研究酵母提取物诱导SBD-1基因的表达提供了更客观的资料。
酵母细胞壁是弹性很大的结构,具有维持细胞形态、渗透性休克防护、防止机械应力和细胞表面蛋白支架等功能,其生长和形态均受到高度精密和极化方式的调节,这一过程主要受细胞壁的完整性控制信号通路的调控[23]。本研究利用玻璃珠结合超声波的方法很容易将酵母细胞破碎,成功提取纯度较高的酵母细胞壁,以用于后续研究。国外研究发现,在奶牛饲养的日粮中添加酵母细胞壁可增强动物抗病力,提高日增重等[24]。酵母细胞壁富含β-葡聚糖和甘露聚糖等多种活性物质。酵母细胞壁的β-葡聚糖是非特异性免疫刺激多糖,能特异性结合机体的免疫细胞受体,刺激T细胞、B细胞、NK细胞产生大量的巨噬细胞,进而调节机体免疫[25]。β-葡聚糖是一种重要的消化道黏膜免疫增强剂[26],饲喂β-葡聚糖可提高荷斯坦犊牛干物质的采食量[27]。肠道病原菌的鞭毛或绒毛上的外源凝集素特异性识别宿主上皮细胞膜的受体并与之结合进而发生感染,而甘露聚糖可有效的干扰肠道病原体的定植。同时甘露糖可为肠道内有益菌(如双歧杆菌、乳酸杆菌等)提供营养物质,促进有益菌大量繁殖,进一步抑制有害菌生长[28]。戈婷婷等[29]发现,甘露寡糖提高了锦江黄牛瘤胃培养液挥发性脂肪酸和菌体蛋白浓度。
本试验发现,酿酒酵母细胞壁诱导体外绵羊瘤胃上皮细胞SBD-1的表达结果呈剂量—时间依赖关系,酿酒酵母细胞壁刺激绵羊瘤胃上皮细胞不同时间后,在12 h时,SBD-1基因表达量达到最大,这种依赖趋势与黎观红的试验结果吻合[12]。本研究采用RT-qPCR和ELISA方法,结果发现SBD-1的mRNA与蛋白的表达趋势一致,且酿酒酵母细胞壁刺激后的瘤胃上皮细胞SBD-1基因表达量明显高于对照组,说明SBD-1在转录水平开始就调节蛋白的表达。
综合本试验结果推断,酵母细胞壁可诱导或促进上皮细胞防御素的表达,对黏膜形成保护,抑制和杀灭有害菌并调节有益菌数量和种类以维持胃肠道微生态平衡。酵母细胞壁作为廉价的抗生素的天然替代品,可作为饲料补充剂来提高家畜的免疫水平,为解决传统抗生素药物导致的抗药性难题提供新思路,研究如何提高家畜体内抗菌肽表达至合理的水平,从而去预防和治疗家畜疾病提供理论依据。
4 结 论
本研究结果表明,从mRNA水平和蛋白质水平得出了酿酒酵母细胞壁能有效促进瘤胃上皮细胞SBD-1的表达,且酿酒酵母细胞壁以200 μg·mL-1浓度在刺激瘤胃上皮细胞12 h,SBD-1基因的表达量达到最高,酿酒酵母细胞壁刺激瘤胃上皮细胞后SBD-1蛋白可分泌到细胞外发挥其生物学功能。
参考文献(References):
[1] LI Y X,ZHANG X L,LI W,et al.The residues and environmental risks of multiple veterinary antibiotics in animal faeces[J].EnvironMonitAssess,2013,185(3):2211-2220.
[2] MEADE K G,CORMICAN P,NARCIANDI F,et al.Bovine β-defensin gene family:Opportunities to improve animal health?[J].PhysiolGenomics,2014,46(1):17-28.
[3] ZHAO P W,CAO G F.Production of bioactive sheep β-defensin-1 inPichiapastoris[J].JIndMicrobiolBiotechnol,2012,39(1):11-17.
[4] HUTTNER K M,BREZINSKI-CALIGURI D J,MAHONEY M M,et al.Antimicrobial peptide expression is developmentally regulated in the ovine gastrointestinal tract[J].JNutr,1998,128(2):297S-299S.
[5] BROGDEN K A,ACKERMANN M R,MCCRAY P B Jr,et al.Antimicrobial peptides in animals and their role in host defences[J].IntJAntimicrobAgents,2003,22(5):465-478.
[6] MONTELEONE G,CALASCIBETTA D,SCATURRO M,et al.Polymorphisms ofβ-defensingenes in Valle del Belice dairy sheep[J].MolBiolRep,2011,38(8):5405-5412.
[7] 李 砚,杨银凤.家畜体内防御素多态性和表达的研究进展[J].中国畜牧兽医,2013,40(3):160-168.
LI Y,YANG Y F.Research progress of polymorphism and expression of defensinsinvivoof livestock[J].ChinaAnimalHusbandry&VeterinaryMedicine,2013,40(3):160-168. (in Chinese)
[9] GALDEANO C M,DE MORENO DE LEBLANC A,VINDEROLA G,et al.Proposed model:Mechanisms of immunomodulation induced by probiotic bacteria[J].ClinVaccineImmunol,2007,14(5):485-492.
[10] SCHLEE M,WEHKAMP J,ALTENHOEFER A,et al.Induction of human β-defensin 2 by the probioticEscherichiacoliNissle 1917 is mediated through flagellin[J].InfectImmun,2007,75(5):2399-2407.
[11] SCHLEE M,HARDER J,KÖTEN B,et al.Probiotic lactobacilli and VSL#3 induce enterocyte β-defensin 2[J].ClinExpImmunol,2008,151(3):528-535.
[12] 黎观红,洪智敏,贾永杰,等.鼠李糖乳酸杆菌LGA对鸡小肠上皮细胞β-防御素-9基因表达的影响[J].畜牧兽医学报,2012,43(4):634-641.
LI G H,HONG Z M,JIA Y J,et al.Effect ofLactobacillusrhamnosusLGAon β-defensin 9 expression in cultured chicken small intestinal epithelial cells[J].ActaVeterinariaetZootechnicaSinica,2012,43(4):634-641. (in Chinese)
[13] 范燕茹,王 佩,金 鑫,等.乳酸杆菌诱导绵羊瘤胃上皮细胞内SBD-1的表达[J].中国兽医学报,2016,36(4):604-612.
FAN Y R,WANG P,JIN X,et al.The expression of SBD-1 in the rumen epithelium cells of sheep induced bylactobacillus[J].ChineseJournalofVeterinaryScience,2016,36(4):604-612. (in Chinese)
[14] 王 佩,范燕茹,金 鑫,等.枯草芽孢杆菌对绵羊瘤胃上皮细胞β-防御素-1表达的影响[J].畜牧兽医学报,2015,46(5):760-767.
WANG P,FAN Y R,JIN X,et al.Effects ofBacillussubtilison the expression of SBD-1 in cultured ruminal epithelial cells of sheep[J].ActaVeterinariaetZootechnicaSinica,2015,46(5):760-767. (in Chinese)
[15] 金 鑫,张 曼,范燕茹,等.酿酒酵母菌对绵羊瘤胃上皮细胞β-防御素-1(SBD-1)基因表达的影响[J].中国农业科学,2015,48(19):3910-3918.
JIN X,ZHANG M,FAN Y R,et al.Effects ofSaccharomycescerevisiaeon the expression of SBD-1 in cultured ruminal epithelial cells of sheep[J].ScientiaAgriculturaSinica,2015,48(19):3910-3918. (in Chinese)
[16] 刘龙海,李新圃,杨 峰,等.奶牛饲料中酿酒酵母菌的分离鉴定及其发酵液的体外抑菌活性研究[J].中国畜牧兽医,2016,43(5):1226-1231.
LIU L H,LI X P,YANG F,et al.The study of isolation,identification ofS.cerevisiaefrom dairy feed and its antibacterical activity in the fermentation brotheinvitro[J].ChinaAnimalHusbandry&VeterinaryMedicine,2016,43(5):1226-1231. (in Chinese)
[17] ORLEAN P.Architecture and biosynthesis of theSaccharomycescerevisiaecell wall[J].Genetics,2012,192(3):775-818.
[18] WEHKAMP J,HARDER J,WEHKAMP K,et al.NF-κB- and AP-1-mediated induction of human beta defensin-2 in intestinal epithelial cells byEscherichiacoliNissle 1917:A novel effect of a probiotic bacterium[J].InfectImmun,2004,72(10):5750-5758.
[19] KLIS F M,BOORSMA A,DE GROOT P W J.Cell wall construction inSaccharomycescerevisiae[J].Yeast,2006,23(3):185-202.
[20] 邵 强,黄友解,韩 月,等.酵母细胞壁的结构组成、生物学功能及在养殖业中的应用[J].浙江畜牧兽医,2017,42(1):13-16.
SHAO Q,HUANG Y J,HAN Y,et al.The yeast cell wall’s structural composition,biological function and application in the breeding industry[J].ZhejiangJournalAnimalScienceandVeterinaryMedicine,2017,42(1):13-16. (in Chinese)
[21] NAVA G M,ESCORCIA M,CASTAEDA M P.Molecular diversity of the antimicrobial domain of beta-defensin 3 and homologous peptides[J].CompFunctGenomics,2009:983636.
[22] WANG S,ZENG X F,YANG Q,et al.Antimicrobial peptides as potential alternatives to antibiotics in food animal industry[J].IntJMolSci,2016,17(5):603.
[23] LEVIN D E.Regulation of cell wall biogenesis inSaccharomycescerevisiae:The cell wall integrity signaling pathway[J].Genetics,2011,189(4):1145-1175.
[24] BROADWAY P R,CARROLL J A,BURDICK SANCHEZ N C.Live yeast and yeast cell wall supplements enhance immune function and performance in food-producing livestock:A review[J].Microorganisms,2015,3(3):417-427.
[25] XIAO Z G,TRINCADO C A,MURTAUGH M P.β-Glucan enhancement of T cell IFNγ response in swine[J].VetImmunolImmunopathol,2004,102(3):315-320.
[26] 孔维华,王京杭,彭正华,等.β-1,3-葡聚糖抗实验性胃溃疡作用研究[J].山东大学学报:自然科学版,2001,36(1):107-112.
KONG W H,WANG J H,PENG Z H,et al.Studies of β-1,3-glucan for anti experimental gastric ulcer[J].JournalofShandongUniversity,2001,36(1):107-112. (in Chinese)
[27] MA T,TU Y,ZHANG N F,et al.Effects of dietary yeast β-glucan on nutrient digestibility and serum profiles in pre-ruminant Holstein calves[J].JIntegrAgric,2015,14(4):749-757.
[28] 许 浩,申立泉,康 坤,等.日粮添加酵母细胞壁对泌乳早期荷斯坦牛生产性能的影响[J].中国奶牛,2017(5):4-8.
XU H,SHEN L Q,KANG K,et al.Effect of supplementation of yeast cell wall in diets on performance of early lactating dairy cows[J].ChinaDairyCattle,2017(5):4-8. (in Chinese)
[29] 戈婷婷,瞿明仁,张 晖,等.功能性寡糖对锦江黄牛瘤胃发酵及微生物生长效率的影响[J].动物营养学报,2012,24(3):557-562.
GE T T,QU M R,ZHANG H,et al.Functional oligosaccharides affect rumen fermentation and microbial growth efficiency of Jinjiang cattle[J].ChineseJournalofAnimalNutrition,2012,24(3):557-562. (in Chinese)
