聚药雄蕊植物甜叶菊花部特征与繁育特性初步研究
2018-06-07袁鎏柳罗庆云陈思锐杨凯祺麦雅文
袁鎏柳,罗庆云,陈思锐,杨凯祺,麦雅文
(南京农业大学园艺学院中药材科学系,南京210095)
两性花植物作为优势种群,既可通过柱头接受外来花粉与胚珠生产种子(雌性功能),又可散发花粉与其它胚珠形成种子而实现雄性功能。两性花形态结构及雌、雄蕊相对位置随发育进程的动态变化会直接影响植株雌性和雄性功能的有效发挥[1-4]。
聚药雄蕊是花药环绕花柱成筒状聚合而花丝分离的一种雄蕊合生现象,广泛存在于菊科、堇菜科、蛇菰科、香茜科、凤仙花科等植物的两性花中[5]。为揭示聚药雄蕊对两性花植物雌性和雄性功能的贡献途径,了解其繁殖适应意义,同时为甜叶菊种质遗传创制途径的建立提供参考,本文以甜叶菊为例,对聚药雄蕊植物花部特征及繁育特性进行了初步研究。
1 研究材料与地点
甜叶菊(Stevia rebaudiana Bertoni)为菊科斯特维亚属多年生草本植物,自然分布于南美洲巴西巴拉圭平原[6],为上世纪60年代起开始人工种植研究的新型甜味剂作物,我国自上世纪70年代后半开始引入,目前已发展为种植面积、提取加工量及出口量最大的国家[7-8]。甜叶菊为多年生丛生型半灌木草本植物,可以匍匐的茎节、种子等进行繁殖,茎末端直立,叶对(互、轮)生。花果期在7—11月,盛花、果期在8—10月。
套袋自交、不同发育时期柱头及花药发育动态变化情况研究用材料为本实验室搜集和创制的部分种质资源共350份,分别种植于江苏省南京市玄武区孝陵卫街道的南京农业大学本部校区种植圃和江苏省南京市江浦县的南京农业大学园艺试验站中;隔离种植实验用材料为无性扦插繁殖的谱星3号,种植地点为位于江苏省南京市六合区竹镇镇金磁社区江苏省农业科学研究院试验站中。甜叶菊授粉生物调查地点为前述种植圃、园艺试验站和江苏省盐城市东台县三仓镇甜叶菊产地。
2 研究方法
2.1 花部特征与传粉生物学观察
2017年7月,甜叶菊开始进入盛花期前。选择有代表性5个株系进行如下观察:头状花序发育进程、小花构造、小花开花进程、花冠颜色等。每个株系选取发育进程一致的头状花序30个进行标记并定点观测,每天9:00~11:00和15:00~16:00各观察1次,直到花朵萎蔫。小花开放前记录花冠筒长度、花冠筒颜色、小花开放时间;小花开放后记录柱头伸长情况、授粉生物访花情况、柱头和花瓣萎蔫情况等。
在甜叶菊头状花序发育过程中,总苞片最先形成,然后小花再开始伸长,从总苞片形成至小花开放,因品系和气温而异,大概需要15~25d,小花开放时间为4~5d。为便于交流,开放前根据小花与总苞片的相对高度划分为4个发育时期,开放后依照小花开放时间划分为3个发育时期,共7个发育时期:1/4高期(小花约为总苞片高度1/4)、1/2高期(小花约为总苞片高度1/2)、3/4高期(小花约为总苞片高度3/4)、等高期(小花与总苞片等高)、初花期(花开第1天)、盛花期(花开第2~5d)和花后期(花后5d及以后,柱头和花冠萎蔫)。每个时期选取10朵小花进行显微解剖,在显微镜下分析雌、雄蕊相对位置及其随发育时间的变化并统计每朵小花花粉数量等。参照龚燕兵和黄双全方法[9],在晴天上、下午进行访花昆虫观察。对访花昆虫的类型与访花行为、访花频率、花间运动等进行分析,判断甜叶菊常见访花昆虫和有效传粉者。
2.2 繁育特性
2.2.1 异交指数 通过小花开放口径、雌雄蕊空间位置及成熟同步情况等进行繁育系统评判。具体方法为:(1)小花开放口径<1mm者记为0,1~2mm者记为1,>2、≤6mm者记为2,>6mm者记为3;(2)花药开裂时间与柱头可授期之间时间间隔,雌雄蕊同时成熟或雌蕊先熟者记为0,雄蕊先熟者记为1;(3)柱头与花药的空间位置,同一高度者记为0,空间分离者记为1。三者之和为异交指数,异交指数越大,植物异交程度越高,对外界传粉者依赖性越强[10]。
2.2.2 花粉胚珠比 取等高期小花,用镊子尖端将花冠筒剖开,将花药筒连同其包裹的雌蕊一同取出,统计花药个数后置于2.0mL离心管中,按每只花药20μL加入蒸馏水,用移液器搅拌匀浆使花药中的花粉完全释放,制成花粉悬浮液。取4μL悬浮液在光学显微镜下统计花粉数,重复5次。
用解剖刀划开子房,镜检统计胚珠数。花粉数量与胚珠数量之比即为花粉胚珠比(P/O比)。较高的P/O值代表异交程度较高,较低的P/O值则表示植物以自交为主[11]。
2.2.3 花粉活力和柱头活性 取2.1所列7个发育时期(1/4高期、1/2高期、3/4高期、等高期、初花期、盛花期、花后期)花药,参照刘巧红等方法[12],用含15%(m:v)蔗糖的花粉管萌发液室温下萌发处理4h[13],光学显微镜下统计花粉萌发率,根据花粉萌发率判断花粉活力。
联苯胺—过氧化氢法测柱头可授性(King,1960)[14]:将不同时期柱头置载玻片上,滴加联苯胺-过氧化氢溶液[1%联苯胺∶3%过氧化氢∶水=4∶11∶22(v:v:v)],显微镜下镜检,若柱头周围反应液呈蓝色,根据气泡多少判断柱头可授性强弱。
2.2.4 人工授粉套袋实验 为揭示甜叶菊是否存在自发自交现象,以及自交亲和性程度,设置了以下几个套袋处理实验:1)直接套袋:去除已开放花序,保留未开放者,直接套袋;2)人工自交授粉:花蕾套袋,剥取同植株等高期小花花药筒将其花粉涂抹于盛花期柱头上,然后套袋;3)人工异交授粉:花蕾套袋,等高期去雄,盛花期涂抹适量其他甜叶菊株系花粉,之后套袋。每处理30朵小花。果实成熟后统计结实率,并与自然状态下对应的指标进行比较[3]。
2.2.5 隔离种植实验 由于甜叶菊的访花昆虫之一蜜蜂的有效活动范围可达2~3km,最远可达14km,为进一步验证甜叶菊是否自交不结实,特选择周围20km范围内无甜叶菊种植的地块,以扦插繁殖的同一品系植株300棵为材料,进行天然隔离种植实验。同时设置人工异交授粉对照试验,正反交各处理30朵小花。果实成熟后统计比较结实率。
2.3 数据分析
采用SPSS20.0 for Windows统计软件中One-way ANOVA分析套袋隔离种植实验中不同处理间的结实率差异。数据间的两两比较采用Student-Newman-Keuls检验法(S-N-K法)。
3 结果
3.1 花部综合特征
甜叶菊头状花序筒状,簇生于伞房状分枝顶端,长 6.5±0.2mm,由聚生于直径为 1.3±0.1mm 花盘上的 5(稀6)朵的小花组成;花萼异变为刚毛状冠毛;总苞片5(稀4),位于头状花序外围,圆筒状,绿色,近等长,彼此交叉重叠,外密被短柔毛。
小花基部白色或浅红色联合成筒状,先端白色,5裂,喇叭口状外展 (图1-V/A),单花寿命4~5d,花冠筒外被稀疏柔毛。雄蕊5(稀6),全着药,花药完全合生形成花药筒,长1.6±0.3mm,花药管顶端有小口(图1-V/A)。雄蕊花丝分离,着生于花托。柱头2(稀3)裂,花柱和柱头裂片外侧表面分布有腺体,功能未明(图1-V/C,图3)。柱头和花柱上端被包裹在花药筒内,形成类似合蕊柱的柱状结构。在开花后第2天,柱头从花药筒顶端小口伸出,呈“Y”型张开,直至萎蔫(图1-VI/B&C)。

图1 甜叶菊花器官形态发育进程Fig.1 Floral organ morphogenesis of S.rebaudiana
3.2 传粉生物学
传粉生物学观测发现,蜜蜂经常前来采集花粉,也常发现蓟马经从花冠筒口处进入小花内取食花粉,偶有蝴蝶探入花冠筒内吸食花蜜。以蜜蜂和蓟马的访问频率最高,蝴蝶的访问频率最低。
蓟马是被观察到访问时间最长、最频繁的甜叶菊访花者,其生活在开放的小花中,直至花粉连同花粉囊被取食完毕。由于田间正常生长的甜叶菊植株小花多,单株花期持续时间长,对于主要依靠爬行移动的小型昆虫蓟马来说,活动空间足够大,花粉量足够多,为此,对同一只蓟马,其活动范围多只局限于同一植株不同小花之间。虽然,在肉眼及显微镜下可见蓟马身上花粉附着明显,也常观察到蓟马在小花之间来回穿梭活动,但由于蓟马活动范围小,且以取食花粉为主,为此,对甜叶菊花粉外传(雄性功能)不利。
蜜蜂是另一类甜叶菊常见访花者,以采集花粉为主,在盛花期,一只蜜蜂大概只需20min左右就可以采集满两携粉足,表明花粉是蜜蜂访问甜叶菊花朵的主要目标物,且甜叶菊花粉量大,蜜蜂花粉采集能力强。此外,还观测到,同一朵小花,从刚刚开放直至盛花期,在持续4~5d的花期中,前面3~4d都观察到有蜜蜂前来采集花粉,表明甜叶菊花粉的释放是一个持续时间相对较长的过程,且小花的持续开放更多的是为吸引和方便蜜蜂多次前来采集花粉,并通过蜜蜂在不同植株的小花间活动来实现花粉的向外传播,在此过程中,通过外露柱头接受蜜蜂带来的外源花粉。较一次性全部释放完毕而言,较长的花期和花粉持续释放时间,可吸引蜜蜂多次访问,提高传粉和受粉概率,更好地实现其雄性和雌性功能。
3.3 繁育系统
3.3.1 异交指数 甜叶菊小花开放时喇叭口小,喇叭口直径为1.2±0.3mm,雄蕊先熟。由于雄蕊合生将柱头包裹在内,柱头和花药接近,没有明显的异位。根据Dafni(1992)异交指数的计算规则,甜叶菊的异交指数为3,繁育系统以异交为主,部分自交亲和,需要传粉者。
3.3.2 花粉胚珠比(P/O比) 甜叶菊小花花粉数量为6600±3100粒,胚珠1个,P/O比为6600,依据Cruden(1977)标准,甜叶菊的繁育系统为专性异交系统。
3.3.3 花粉与柱头的活性 甜叶菊雄性先熟,花粉在小花开放前的1/2高期即成熟并从花药中释放出来,此时其萌发率最高(6.1%±2.6%);随着成熟时间的延长,花粉萌发率逐渐下降,但直至盛花期,花粉仍保持一定的萌发率(3.0%±1.8%)(图 2)。
甜叶菊柱头在小花开放前无可授性,随着小花的开放,逐渐伸出花药筒,并开始表现为具有一定的可授性活性;在盛花期,柱头绝大多数具有完全活性,并可持续1~2d(图3)。因此,甜叶菊为雄性先熟,柱头在伸出花药筒后才开始具有活性。
3.3.4 套袋实验 套袋实验结果发现,自然情况下套袋没有种子生成,表明不存在自发自交。人工自交授粉也没有种子生成,表明甜叶菊自交不亲合。相应地,天然隔离种植没有种子生成,而作为母本和父本分别与其他株系人工杂交都获得了成熟饱满的种子,研究结果进一步表明甜叶菊自交不亲合。

图2 甜叶菊花器官发育进程中花粉萌发率变化情况Fig.2 Change in the germination rate of pollens at different morphogenesis stages of stevia floret
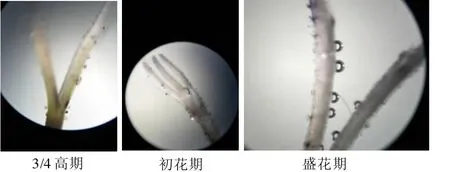
图3 甜叶菊花器官发育进程中柱头可授性变化情况Fig.3 Change in the receptivity of stigmas at different morphogenesis stages of stevia floret
4 讨论
4.1 繁育系统与P/O比
从P/O比来看,甜叶菊的繁育系统被判断为专性异交系统,与根据异交指数判断结果(异交为主、部分自交亲和、需要传粉者)差别很大。本文的研究结果证明,甜叶菊雄性先熟,两性成熟的重叠时间长,而且雌蕊成熟时,柱头与花药间基本无间隔(图1-B)。套袋及隔离种植实验结果表明,甜叶菊自交不亲合(表1),繁育系统以异交为主,自交可能性低。可见,在判断繁育系统时,对于甜叶菊来说,P/O比值较异交指数更合适。
甜叶菊雄蕊聚合形成花药管,花粉向花药管内侧散粉,由柱头及收集毛承载花粉粒,并通过柱头的伸长,将花粉逐渐推出花药管,实现花粉的分批异位呈现[15-16]。花药合生成筒且花粉释放到筒内的聚药雄蕊结构,能使花粉分批地集中呈现在同一个位置,多个花粉粒一起释放,降低花粉损耗、促进花粉输出,使得植物不必通过生产大量花粉来保证异交花粉的成功散布[4]。
但本研究结果显示,甜叶菊P/O比高,综合本研究所观察到的有关蓟马作为出现频率最高、访花时间最长的甜叶菊访花昆虫这一现象,表明甜叶菊高P/O比,似为应对蓟马等花粉取食昆虫以及蜜蜂的采集损耗,并通过花药管及柱头的有效配合实现花粉的分批异位呈现,以确保雄性功能的实现。

表1 套袋实验的结实情况Table1 Seed-set of bagged experiments for S. rebaudiana
4.2 传粉生态学过程
蜜蜂以植物花粉作为蛋白质的主要来源[4],其体表刚毛密布,在采集花粉时,粘附花粉的刚毛会不可避免地接触到包括柱头在内的多个部位,间接地完成了花间授粉。甜叶菊聚药雄蕊合生在一起,并通过柱头及收集毛将花粉粒异位呈现于花冠筒开口处,从而对蜜蜂的访花行为进行约束,使蜜蜂在采集当前花朵上的花粉时,能够将刚刚在前一朵小花中采集花粉时附着于头部刚毛上的花粉传递给当前花朵的位于花药筒上部的呈 “Y”形展开的柱头裂片表面。同时,原位于柱头裂片表面的当前花朵的花粉也可以附着于蜜蜂头部的刚毛上,并随着蜜蜂对下一朵小花的访问,将花粉传递出去。这一现象表明,甜叶菊的花部特征可能对蜜蜂传粉机制产生了一定的特化适应。此外,在试验中还观察到,蜜蜂对甜叶菊的访问,往往是在不同植株间来回穿梭,而不集中在同一个植株上,蜜蜂的这一行为,实现了甜叶菊的异花授粉需求。
4.3 聚药雄蕊
聚药雄蕊现象广泛存在于菊科、桔梗科、凤仙花科、堇菜科、香茜科、葫芦科、茄科及苦苣苔科等植物[5]。聚药雄蕊植物的花部结构多表现为:1)花冠形成花冠筒或花冠基部合生成管状;2)雄性先熟;花粉会通过柱头及其表面的刷粉毛的伸长,在花药管外异位呈现;3)传粉者多为小型昆虫或用喙伸入花内吸蜜的蝶蛾类[5]。且上述这些特征能较为普遍地关联出现,可能是为了提高花内所有花粉接触到传粉者的可能性,促进花粉的输出;同时,提高传粉的准确性,降低了花粉的损耗[5,17]。与任明迅[3]有关花药合生结构“减少了移出花药内所有花粉的所需昆虫访问数”推断不同。本研究结果表明聚药雄蕊这一特征具有如下功能:1)为花粉及其活力的保存提供屏障。甜叶菊的花粉在花冠筒开放前已完全成熟并在花药筒内侧释放,花朵开放后,聚药雄蕊形成的花药筒就成为了花粉的唯一保护器官,可以为已成熟花粉营造适宜的萌发力保存生境。2)对访花生物的访花行为进行规范,促进雌性和雄性功能的实现。聚药雄蕊在访花生物和花粉间提供屏障,阻止访花生物直接接触花药内侧的花粉,规范了访花生物的访花行为;通过柱头及其表面刷粉毛的伸长,在花药管外对花粉进行较长时间的分批异位呈现,延长花朵对访花生物的花粉吸引时间,提高访花生物来访次数,从而提高柱头接触访花生物、获取外源花粉进行异花授粉,实现雌性功能,而且,还可以通过对花粉的分批释放,降低蜜蜂的采集或蓟马的取食对花粉外传所造成的不良影响,提高花粉外传机会,实现雄性功能。
4.4 花部综合特征
本研究结果发现:1)形态结构上联合作用。聚药雄蕊结构不是单独存在的,而是与位于其外侧发育初期密闭的花冠筒、包裹于其内侧并紧密接触的柱头等花部结构联合在一起,这些结构的协同作用,为花粉和柱头的发育及活力的保存提供了良好的微生态环境。2)发育生理上雌雄异熟。为避免聚药雄蕊结构所带来的花粉和柱头紧密接触而导致的自交衰退,往往通过雌雄异熟的方式来避免自交可能。但是在本研究中,我们的研究结果表明,甜叶菊的花粉在1/2高期就开始成熟并释放到花药筒内壁,由于花药筒内壁与柱头紧密接触,因此花粉也释放到柱头上,且花粉活力维持时间较长,在小花开放、柱头裂片呈“Y”形展开后,仍具有一定萌发力。为此,虽然甜叶菊的雌雄蕊间存在一定的异熟,但并不能阻隔自身花粉和柱头的交配。为此,甜叶菊演化出第三个策略:3)遗传生理上的自交不亲和。套袋和隔离种植试验表明,甜叶菊自交不亲和;此外,在研究中,甜叶菊花粉在自身花柱或柱头表面萌发的现象非常罕见(图4)。为此,推断甜叶菊的自交不亲和包括孢子体不亲和及配子体不亲和两种情况,且以孢子体不亲和为主,配子体不亲和为辅,即花粉不能在自身柱头上萌发,即使偶有萌发者,也不能实现真正的受精,具体情况有待进一步验证。
最后,本研究以甜叶菊为例,揭示了聚药雄蕊植物通过花部各组分形态结构上的联合作用,发育生理上的雌雄异熟及遗传生理上的自交不亲和等协同作用,促进了植株雄性功能和雌性功能的协调统一。为此,本研究结果不仅可为聚药雄蕊植物花部结构相关研究提供参考,也可为甜叶菊遗传改良途径的建立提供参考。
致谢:实验由袁鎏柳参与数据采集、初稿撰写,由罗庆云设计、操作、部分数据采集、图表制作及定稿撰写,陈思锐、杨凯祺、麦雅文等参与部分实验材料的繁育和数据采集,陈爱彦和刘福凤负责实验材料的田间管理。南京农业大学农学院洪德林教授在项目实施阶段提供了参考意见和有益的讨论,海南大学热带农林学院任明迅教授对论文撰写进行了有益的讨论,在此一并致谢!

图4 甜叶菊花粉在自身柱头外表面的萌发侵入(圆圈中者)Fig.4 Germination and invasion of pollen on the outer surface of self stigma of stevia(in the circles)
参考文献:
[1]Harder LD,Barrett SCH.Pollen removal from tristylous Pontederia cordata:effects of anther position and pollinator specialization[J].Ecology,1993,74(4):1059-1072.
[2]Harder LD,Wilson WG.Floral evolution and male reproductive success:optimal dispersing schedules for pollen dispersal by animal-pollinated plants[J].Evolutionary Ecology,1994,8(5):542-559.
[3]任明迅.雄蕊合生植物半边莲的花部综合征与繁育系统[J].植物生态学报,2009,33(2):361-368.
[4]张大勇.植物生活史进化与繁殖生态学[M].北京:科学出版社,2004.
[5]任明迅.植物雄蕊合生的多样性、适应意义及分类学意义初探[J].植物分类学报,2008,46(4):452-466.
[6]黄应森,陆荣刚.甜菊栽培技术[M].南京:江苏科学技术出版社,1981.
[7]舒世珍.甜菊引种三十年[J].中国种业,2010(6):21-23.
[8]舒世珍.新糖料作物——甜叶菊在京试种成功[J].农业科技通讯,1979(2):19-20.
[9]龚燕兵,黄双全.传粉昆虫行为的研究方法探讨[J].生物多样性,2007,15(6):576-583.
[10]Dafni A.Pollination Ecology:A Practical Approach[M].Oxford University Press,Oxford,1992.
[11]Cruden RW.Pollen-ovule ratios:a conservative indicator of breeding systems in flowering plants[J].Evolution,1977,31(1):964-974.
[12]刘巧红,马莺,程大友,等.一种甜菜花粉萌发的培养方法[P].中国发明专利.201510152104.9 2015-04-01.
[13]Brewbaker,J.D.and Kwack,B.H.The essential role of calcium ion in pollen germination and pollen tube growth[J].Am.J.Bot.,1963,50(9):859-865.
[14]King JR.The peroxidase reaction as an indicator of pollen viability[J].Stain Technology,1960,35(4):225-227.
[15]Howell GJ,Slater AT,Knox RB.Secondary pollen presentation in angiosperms and its biological significance[J].Australian Journal of Botany,1993,41(5):417-438.
[16]Castro SV,Sileira P,Navarro L.How does secondary pollen presentation affect the fitness of Polygala vayredae(Polygalaceae)?[J].American Journal of Botany,2008,95(6):706-712.
[17]Harder LD,Johnson SD.Function and evolution of aggregated pollen in angiosperms[J].International Journal of Plant Sciences,2008,169(1):59-78.
