PKP治疗新鲜与陈旧性老年椎体压缩性骨折的对比研究
2018-06-07南京医科大学附属苏州市立医院骨科江苏苏州215001
(南京医科大学附属苏州市立医院骨科 江苏 苏州 215001)
陆军 沈文东 郑伟伟(通讯作者)
随着人口老龄化问题的加剧,因骨质疏松入院治疗的患者逐渐增加,中老年人尤其是绝经后妇女容易发生绝经后骨质疏松症[1]。骨质疏松后可自发性或轻度外伤而导致椎体骨折,其中骨质疏松性椎体压缩性骨折已成为骨科最为常见的疾病之一。经皮穿刺椎体后凸成形术(PKP)是一种经过椎弓根或椎弓根外向椎体内注入骨水泥以维持椎体强度的手术方式,PKP手术创伤小、恢复快、止痛效果好、术后可早期下床活动等优点,在临床中已逐渐普及[2]。本研究回顾性分析我院2015年6月至2017年2月采用PKP治疗骨质疏松性压缩性骨折83例患者临床资料,通过分析术后患者疼痛和功能指数及影像学检查,探索手术时机的选择对于PKP术后疗效的影响。
1.资料和方法
1.1 一般资料
选取83例胸腰段椎体骨质疏松性压缩性骨折患者作为研究对象,其中男29例,女性54例,年龄55~91岁。纳入标准:(1)腰背部疼痛史或外伤史;(2)X线显示椎体骨折;(3)MRI检查显示责任椎T1低信号和T2高信号。根据骨折发生距手术的时间,小于3周为新鲜骨折组(A组),大于等于3周为陈旧性骨折组(B组),A组52例,其中男性19例,女性33,年龄55~83岁。B组31例,其中男性10例,女性21例,年龄61~91岁。
1.2 方法
术前进行心肺功能、实验室及影像学检查,排除相关手术禁忌症,对于自发性脊柱骨折患者应排除脊柱肿瘤可能。PKP手术采用全身麻醉,C臂机辅助定位,扩孔钻穿过责任椎体椎弓根,刺入椎体后缘1/3处,拔出针芯后将扩张钻头钻孔至椎体前缘1/3处,置入球囊,缓缓向球囊内注入造影剂,在C臂机透视下进行扩张复位,复位满意后取出球囊,缓慢向伤椎灌注骨水泥,待骨水泥完全凝固后拔出导管,透视观察是否有骨水泥渗漏,压迫止血、缝合伤口。术后24 h鼓励患者下地行走,5天出院。术后予以抗骨质疏松药物治疗,门诊定期复查。
表1 二组患者VAS评分、ODI指数、椎体高度和Cobb’s角(±s)
* P<0.05, VS 术前;# P<0.05, VS A组
组别 例数 术前 术后3d 术后6个月 术后1年VAS评分 A组 52 8.6±1.7 3.1±0.8* 2.1±0.6* 2.0±0.7*B 组 31 7.8±1.1 3.4±0.9* 2.6±0.9* 2.3±0.6*ODI指数 A组 52 77.6±6.9 35.8±4.6* 27.4±2.3* 26.3±1.9*B 组 31 75.9±7.1 36.1±3.9* 29.8±3.2* 25.7±2.7*椎体高度(mm) A组 52 13.9±2.5 24.6±2.6* 23.1±1.8* 22.4±2.2*B 组 31 11.6±3.1 17.2±1.8*# 15.5±0.9*# 15.1±1.4*#Cobb’s角(°) A组 52 30.6±5.8 10.6±2.7* 11.3±2.5* 11.6±1.7*B 组 31 31.9±6.1 18.3±3.4*# 19.2±3.1*# 19.7±1.9*#
1.3 观察指标
术前、术后3d、术后6月及1年进行视觉模拟疼痛评分(VAS评分),Oswestry功能障碍指数(ODI指数),X线片检查,记录术前和术后椎体恢复的高度,Cobb’s角的测量采用Phillips的方法[3]。
1.4 统计学方法
所得数据采用SPSS 19.0统计软件进行处理,对A组和B组患者计数资料使用t检验或χ2检验,P<0.05认为差异有统计学意义。
2.结果
术前A组平均椎体前缘压缩(48.9±10.6)%;B组平均椎体前缘压缩(46.7±9.9)%。二组患者在年龄、性别及椎体前缘压缩上无显著差异(P>0.05)。所有患者均顺利完成手术,术中未发生脊髓、神经损伤,A组患者中有1例发生椎体间隙渗漏,B组患者有2例发生椎体前方渗漏,术后无特殊不适,未给予特殊治疗。术后随访12~24个月,术后3d、6个月及1年A组、B组VAS评分、ODI指数较术前均显著降低(P<0.05),提示PKP手术能显著改善新鲜或陈旧性骨折疼痛及功能指数,而A组与B组术后均无明显统计学差异(P>0.05);术后3d、6个月及1年A组、B组椎体高度,较术前显著提高(P<0.05),而A组椎体高度均明显高于B组(P<0.05),提示PKP手术对于恢复新鲜骨折椎体高度更具优势;术后3d、6个月及1年A组、B组Cobb’s角,较术前显著降低(P<0.05),而A组Cobb’s角均显著低于B组(P<0.05),提示PKP手术在恢复新鲜骨折的胸腰椎前凸弧度更有优势。(见图1,表1)
3.讨论
随着年龄的增加,成骨/破骨细胞平稳出现紊乱,破骨细胞活性增强,导致骨密度降低和骨量的丢失。骨质疏松症高发于老年人,椎体是骨质疏松症主要的受累部位之一[1,4]。随着骨量的丢失和骨密度的降低,脊柱椎体骨组织结构随之退变,从而使椎体承重力下降,即使轻度外伤,甚至自发情况下出现压缩性骨折[5]。并且,中老年患者基础代谢较差,储备力弱,且往往合并高血压、糖尿病及呼吸、循环系统慢性疾病,因此,对于此类患者除了有效恢复椎体高度,缓解责任伤椎引起的疼痛外,还要求治疗方式创伤小,安全性高、手术时间短等[6]。非手术治疗一般要卧床制动3~4个月,且长期制动不仅加速骨量丢失容易发生再次骨折,且卧床易并发呼吸、泌尿系统感染,严重时可危及生命[7]。传统的手术治疗主要是开放性手术治疗,通过行内固定支撑恢复椎体高度,然而骨质疏松患者术后大多会发生内固定切割作用,导致内固定失败,且开放手术方式创伤大,并发症高,不能早起下床活动及需二次手术等缺点[8]。
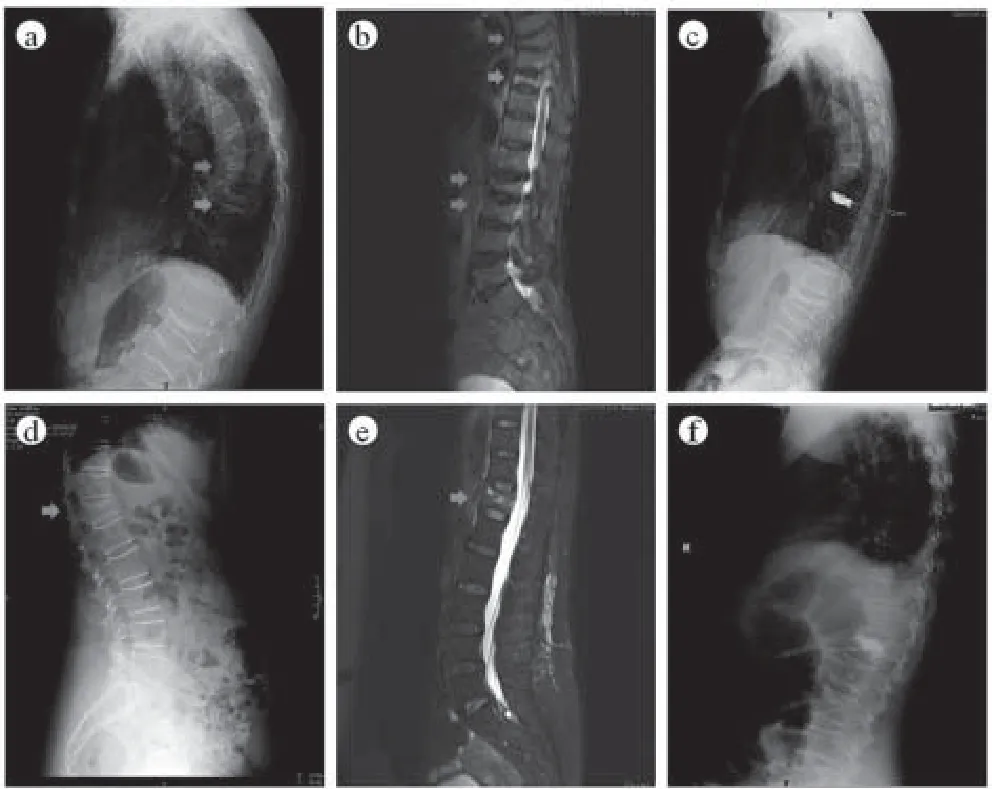
图1 二组患者手术前后影像学表现(箭头表示骨折处,红色箭头表示陈旧性非责任椎体,绿色箭头表示责任椎体)
PKP是目前治疗老年骨质疏松性压缩性骨折首选手术方法,在治疗椎体骨折方面具有如下优势:(1)手术疗效明确,有效恢复椎体高度,显著缓解责任椎体引发的疼痛,研究显示,PKP可缓解70%~90%椎体骨折引发的疼痛[2,9];(2)预后较好,可早起活动,恢复脊柱的正常序列关系,二次手术率低[10]。本研究中,PKP术后,各组患者在VAS评分、ODI指数、椎体高度和Cobb’s角均有明显改善,提示PKP手术能显著缓解疼痛,提高伤椎高度,增加胸腰部活动度。此外,新鲜骨折组和陈旧性骨折组在术后VAS评分和ODI指数上无显著差异,而在术后椎体高度及Cobb’s角方面,新鲜骨折组显著优于陈旧性骨折组,提示PKP对于治疗新鲜骨折具有更好的临床疗效。
PKP手术并发症主要为骨水泥渗漏,包括向前方、椎间隙或后方渗漏,渗漏率在10%~15%之间[11,12]。陈旧性骨折是否需要行PKP手术目前仍存在争议,对于已畸形愈合的椎体,若强行用骨水泥撑开椎体,容易造成再次骨折或骨水泥外渗[13]。本研究中,纳入标准的陈旧性骨折在T2加权像中仍呈高信号,对于T2加权像未呈高信号的骨折未纳入手术范围,且本研究中A组患者中有1例发生椎体间隙渗漏,B组患者有2例发生椎体前方渗漏,三例患者术后随访均获得满意疗效,未发现其他严重并发症。
总之,PKP手术是一项安全、有效的手术方式,早期行PKP手术对术后椎体的解剖学复位更为理想。
[1]Lloyd AA, Gludovatz B, Riedel C, et al. Atypical fracture with long-term bisphosphonate therapy is associated with altered cortical composition and reduced fracture resistance[J]. Proc Natl Acad Sci U S A, 2017, 114(33):8722-8727
[2]Gosev I, Nascimben L, Huang PH, et al. Right ventricular perforation and pulmonary embolism with polymethylmethacrylate cement after percutaneous kyphoplasty[J]. Circulation, 2013, 127(11):1251-1253.
[3]O'Higgins P, Cobb SN, Fitton LC, et al. Combining geometric morphometrics and functional simulation: an emerging toolkit for virtual functional analyses [J]. J Anat, 2011, 218(1):3-15.
[4]Stamm TA, Pieber K, Blasche G. Health care utilisation in subjects with osteoarthritis, chronic back pain and osteoporosis aged 65 years and more: mediating effects of limitations in activities of daily living, pain intensity and mental diseases [J]. Wien Med Wochenschr, 2014,164(7-8):160-166.
[5]Kerezoudis P, Rinaldo L, Alvi MA, et al. The Effect of Epidural Steroid Injections on Bone Mineral Density and Vertebral Fracture Risk: A Systematic Review and Critical Appraisal of Current Literature [J]. Pain Med, 2018, 19(3):569-579.
[6]Selassie A, Snipe L, Focht KL. Baseline prevalence of heart diseases, hypertension, diabetes, and obesity in persons with acute traumatic spinal cord injury: potential threats in the recovery trajectory [J]. Top Spinal Cord Inj Rehabil, 2013, 19(3):172-182.
[7]Szulc P, Samelson EJ, Sornay-Rendu E, et al. Severity of aortic calcification is positively associated with vertebral fracture in older men--a densitometry study in the STRAMBO cohort. Osteoporos Int, 2013,24(4):1177-1184.
[8]Zhang ZF, Huang H, Chen S, et al. Comparison of highand low-viscosity cement in the treatment of vertebral compression fractures: A systematic review and meta-analysis[J]. Medicine, 2018, 97(12):e0184.
[9]Li HK, Hao DJ, Yang JS, et al. Percutaneous kyphoplasty versus posterior spinal fixation with vertebroplasty for treatment of Kümmell disease: A case-control study with minimal 2-year follow-up [J]. Medicine, 2017, 96(51):e9287.
[10]Liu H, Liu B, Gao C, et al. Injectable, biomechanically robust, biodegradable and osseointegrative bone cement for percutaneous kyphoplasty and vertebroplasty [J]. Int Orthop,2018, 42(1):125-132.
[11]Vanni D, Pantalone A, Magliani V, et al. Corpectomy and expandable cage replacement versus third generation percutaneous augmentation system in case of vertebra plana: rationale and recommendations [J]. J Spine Surg,2017,3(3):379-386.
[12]Filippiadis DK, Marcia S, Masala S, et al. Percutaneous Vertebroplasty and Kyphoplasty: Current Status, New Developments and Old Controversies [J]. Cardiovasc Intervent Radiol, 2017, 40(12):1815-1823.
[13]Chen F, Xia YH, Cao WZ, et al. Percutaneous kyphoplasty for the treatment of spinal metastases [J]. Oncol Lett,2016, 11(3):1799-1806.
