不同红蓝光比例对番茄幼苗叶片结构及光合特性的影响
2018-06-06杨俊伟鲍恩财张珂嘉潘铜华曹晏飞邹志荣西北农林科技大学园艺学院陕西杨凌712100农业部西北设施园艺工程重点实验室陕西杨凌712100
杨俊伟,鲍恩财,张珂嘉,潘铜华,曹晏飞,张 静,邹志荣(1.西北农林科技大学 园艺学院,陕西杨凌 712100;2.农业部西北设施园艺工程重点实验室,陕西杨凌 712100)
番茄因其独特风味成为世界上最受欢迎的蔬菜之一[1]。在设施番茄栽培中,幼苗质量直接影响番茄后期的生长发育及产量形成。在生产中,人们通常通过喷施激素类物质[2-3]如矮壮素、多效唑等植物生长调节剂来促进幼苗的健壮生长。而这些激素大多在自然状态下难以降解[4],摄入过多后可能会危害人体健康[5]。在栽培学上,调控栽培环境(如光照)是培育壮苗的一种生态环保的可行方法。光是植物生长最重要的环境因子之一,光质对番茄幼苗品质有显著影响[6]。新型半导体发光二极管(light emitting diode,LED)光源具有体积小、能耗低、坚固耐用、使用寿命长、工作电压低、冷光源和环保等特点[7]。同时,LED可以根据不同植物对光强和光质的需求不同进行精准调制,最大限度满足作物对光的需求[8]。因此,在设施番茄幼苗培育过程中,研究光质精准调控对人工光环境下工厂化育苗具有一定的实际应用价值。关于光质对蔬菜生长和发育的影响,前人在生菜[9]、黄瓜[10]、乌塌菜[11]和芽苗菜[12]等蔬菜中已有广泛研究。不同光信号通过影响光敏色素和隐花色素的形成进而影响植物的光形态建成[13]、茎的伸长[14]、叶绿素的合成[15]、气孔运动[16]和叶片结构[17]。Poudel等[13]发现红光处理可促进葡萄幼苗茎和节间的伸长,蓝光可增加葡萄叶片数和气孔数量。王丽伟等[18]用不同比例红蓝光处理番茄幼苗发现红光∶蓝光=3可以显著增加叶绿素总浓度,红光∶蓝光=9可以提高Chla/b。Mizuno 等[19]发现植株在黑暗期给予适当的远红光照射可使植物体内的光敏色素转变成Pfr构型,从而促进植株下胚轴的伸长。Li 等[20]研究发现陆地棉在蓝光处理下叶片最厚,栅栏组织最长。前人关于光质对作物生长发育的影响主要集中在单色光或复合光(多种光)对植株光合及干物质积累的影响上[21]。叶片结构和植物的光合特性存在紧密联系,而不同比例红蓝光对植株叶片内部结构影响的研究较少,针对西北地区设施生产实践,缺乏与光质调控对番茄的生理生化性状相应的技术。研究不同红蓝比例LED 对番茄幼苗光合特性,叶片结构和叶绿体超微结构的影响,筛选适合番茄幼苗生长的红蓝光配比,从而为番茄的工厂化育苗和LED光源在设施番茄中高效利用提供理论基础。
1 材料与方法
1.1 试验材料
试验于2016年9月-2017年5月在西北农林科技大学科研温室12号植物生长箱(陕西旭田光电农业科技有限公司)中进行。供试温室番茄品种为‘金棚朝冠’,种子购于陕西杨陵金棚种业有限公司。
1.2 试验处理
番茄种子经温汤浸种后,在温度28 ℃,空气湿度90%的人工气候箱(RDN-1000D-4,宁波东南仪器有限公司)中催芽72 h后播种于72孔穴盘中,穴盘放置于人工气候箱中。设置光周期12 h/12 h,温度25 ℃/20 ℃,湿度65%~75%,光照强度为100 μmol·m-2·s-1。当番茄幼苗长至两叶一心时,挑选长势一致的植株移栽到植物生长箱(西北农林科技大学科研温室,陕西旭田光电农业科技有限公司提供)中。以草炭∶珍珠岩∶蛭石=3∶1∶1(体积比)为栽培基质,采取潮汐式营养液灌溉模式,营养液采取1/2倍山崎番茄营养液配方。使用时控开关(KG316T,浙江正泰电器股份有限公司)精确控制光周期(昼∶夜=14 h∶10 h),控制LED灯打开个数使番茄叶冠层光照强度达到200 μmol·m-2·s-1±10 μmol·m-2·s-1,温度25 ℃/20 ℃(昼/夜),湿度65%~75%。试验重复3次,每次从定植到当次试验结束持续30 d。试验采用不同比例的红(400~500 nm)、蓝(600 ~700 nm)单色LED(西安麟字半导体照明有限公司)灯珠数量的组合,构成5个不同光质处理,分别为红光(R)、 蓝光(B)、红∶蓝=1∶2 (1R2B)、红∶蓝=1∶1 (1R1B)、红∶蓝=2∶1 (2R1B),以白光(W)为对照,光照强度均200 μmol·m-2·s-1±10 μmol·m-2·s-1。不同处理的波谱分布如图1所示,不同波谱为在距离灯正下方20 cm处测定。
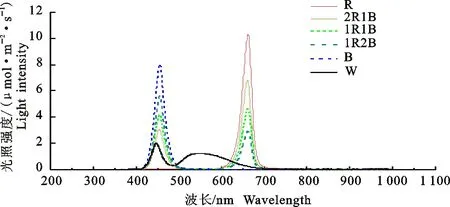
图1 不同处理的光谱分布
1.3 测定项目及方法
光照强度和光谱的测定:试验进行之前,在暗室内采用光谱仪(PAR-NIR,Apogee Instruments Inc,Logan,UT)于灯正下方20 cm处测定不同处理的光谱,根据设定的光强调整LED灯管数量。
番茄幼苗生长指标的测定:番茄植株生长15 d 后,每个处理随机选取10株,重复3次,用精度为0.1 cm的直尺测量番茄幼苗的株高;用精度为0.01 mm的电子数显卡尺(605A-05,哈尔滨量具刃具集团有限责任公司)测量第1节位上方的茎粗。
叶绿素质量分数测定:将待测叶片洗净擦干后用打孔器取样,加φ=96%的乙醇,室温下置于暗处浸提过夜(8 h),期间摇动2~3次,直至叶片完全变白为止。取1mL的提取液于离心管,以φ=96%乙醇定容至5 mL,用岛津紫外可见光分光光度计(UV-1800)测定其在 665、649、470 nm 波长下的吸光值,并依据下列式(1)、(2)分别计算叶绿素a和b的质量分数[22]。
叶绿素a(Ca)=13.95×A665-6.88×A649
(1)
叶绿素b(Cb)=24.96×A649-7.32×A665
(2)
番茄叶片比叶重(LMA)的测定根据公式(3)[6]计算:
比叶重(g·cm-2)= 叶片干质量/叶面积
(3)
番茄叶片结构的观察:用不同比例的红蓝光处理番茄幼苗15 d后,参考吴涛等[23]的方法处理样品。用正置荧光显微镜(OlympusBX51,日本奥林巴斯株式会社,日本)观察叶片结构,栅栏组织内含叶绿体多,进行同化作用,而海绵组织空隙多,也较大,组织疏松,内含叶绿体少。每张切片选取5个视野,用Cell Sens软件在每个视野分别测定栅栏和海绵组织3次,求平均值,即为栅栏(海绵)组织厚度。
叶绿体超微结构观察:不同比例的红蓝光处理番茄幼苗15 d后,参考He等[24]的方法稍作调整处理样品。先用φ=4%的戊二醛固定植物叶片6 h,接着用pH6.8的磷酸缓冲液冲洗6次,然后用10 g/L的锇酸在4 ℃下固定2 h,在不同梯度乙醇梯度脱水之前再多次漂洗,EPON812树脂包埋,聚合8 h后超薄切片,用透射电子显微镜(JEM-1230,日本电子,日本)观察叶绿体超微结构。
光合速率的测定:不同比例的红蓝光处理番茄幼苗15 d后,用便携式光合-荧光联用系统(LI-6400XT,LI-COR Inc,USA)测定不同红蓝光配比处理下番茄幼苗最新完全展开叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和气孔限制值(Ls),每个处理选择5株,每株选择3个叶片进行测定。
叶绿素荧光参数测定:采用PAM-II 便携调制式荧光仪(PAM Photosynthesis Yield Aanalyser,Walz,Effeltrich,Germany)测定叶绿素荧光参数:稳态荧光水平(Fs)、饱和光脉冲激发的荧光水平(Fm′)、PSII实际光化学效率(ΦPSⅡ)和光适应下PSII 最大光化学效率(Fv′/Fm′)。
番茄幼苗干物质积累的测定:用蒸馏水冲洗番茄植株表面基质及灰层后,用吸水纸吸干植株表面的水分,然后用精度为0.001 g的电子天平(FA2004C,上海越平科学仪器有限公司)分别测量番茄幼苗叶片、茎和根的鲜质量,将鲜样在105 ℃杀青15 min后,于电热鼓风干燥箱(101-2型,北京科伟永兴仪器有限公司)中70 ℃烘干48 h 至恒量后,采用精度为0.000 1 g的电子天平(AL204,梅特勒-托利多仪器有限公司,上海)称量各部分干质量。
壮苗指数的计算[18]:壮苗指数 = (茎粗 /株高+地下部干质量 /地上部干质量) ×全株干质量。
1.4 数据处理
采用SPSS 20.0对试验数据进行方差分析及显著性分析(α=0.05),用OriginPro 8.0进行图表制作。
2 结果与分析
2.1 不同比例红蓝光处理对番茄植株生长的影响
由图2和表1可知,不同比例的红蓝光处理对番茄形态生长影响显著。R处理番茄株高和第1节间长度显著高于其他处理。R、2R1B和1R1B处理番茄的茎粗和真叶数间无显著性差异,但均显著高于对照及其他处理番茄的茎粗。R、2R1B、1R1B和1R2B处理下的番茄茎粗分别较对照增加47.84%、46.86%、46.08%和14.71%,而B处理和W处理无显著性差异。

图2 不同比例红蓝光处理下番茄植株幼苗的生长
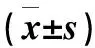
表1 不同红蓝光比例处理下番茄的幼苗形态指标
注:同列不同小写字母表示处理间差异显著(P<0.05),下同。
Note: Different lowercase letters in the same column means significant difference (P<0.05), the same below.
2.2 不同比例红蓝光处理对番茄植株叶片叶绿素质量分数、叶面积及比叶重的影响
不同比例的红蓝光对番茄幼苗叶片的叶绿素质量分数、叶面积及比叶重具有显著影响(图3)。由图3-A可知,R和B处理番茄幼苗叶绿素质量分数最高,叶绿素质量分数随蓝光比例的增加而增加。由图3-B可知,1R1B处理番茄幼苗的叶绿素a/ b的比值最高,显著高于R、B和W处理。由图3-C可知2R1B和1R1B处理番茄幼苗的叶面积无显著差异,且显著高于W及其他处理,R与1R2B次之,且两者无显著差异,而W与B最低。由图3-D可知,R处理下叶片比叶重最大,1R1B次之,并且显著高于其他处理,W处理下比叶重最低。
不同小写字母表示处理间差异显著(P<0.05),下同
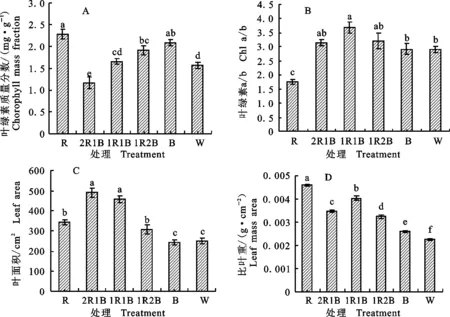
2.3 不同比例红蓝光处理对番茄叶片结构和叶绿体超微结构的影响
由表2可知,不同比例红蓝光处理对番茄叶片结构影响显著。2R1B处理叶片最厚,W次之,1R2B与B无显著差异,而R的叶片厚度最低,显著低于其他处理。2R1B处理番茄叶片的栅栏组织最长,1R2B和1R1B次之,且二者之间无显著性差异; R和B处理番茄叶片的栅栏组织和海绵组织最短,显著低于其他处理。由图4可以看出,1R1B、 1R2B和W处理番茄叶片的栅栏组织排列整齐,并且和海绵组织有明显的界线,而R处理番茄叶片的栅栏组织排列杂乱且和海绵组织之间无明显界线。B、R和W处理的栅栏组织长度显著低于红蓝光处理。
由图5可知,不同比例红蓝光处理对番茄叶绿体超微结构影响显著。R处理番茄叶片的淀粉粒体积膨大,占据叶绿体主要结构空间,叶绿体基粒片层整齐,基粒类囊体垛叠较少; B 处理淀粉粒少,叶绿体基粒数少,基粒类囊体结构不明显。2R1B和1R1B 处理,淀粉粒体积相对R处理缩小,叶绿体基质和基粒片层清晰,基粒类囊体垛叠较多且排列整齐致密,1R2B 处理,淀粉粒质量分数少;CK 处理,淀粉粒体积较小基粒数较少,基质片层清晰,片层较薄。

表2 不同比例红蓝光处理番茄幼苗叶片结构
PT.栅栏组织细胞 Palisade tissue cells;ST.海绵组织细胞 Sponge tissue cells;UE.上表皮 Upper epidermis;LE.下表皮 Lower epidermis;S.气孔 Stomata.下同 The same below
图4不同比例红蓝光处理下番茄植株幼苗叶片结构
Fig.4Anatomicalstructureoftomatoleavesunderdifferentredandbluelightratios
2.4 不同比例红蓝光处理对番茄植株光合特性的影响
番茄幼苗处理15 d后,不同比例红蓝光处理对各光合特性指标产生了不同程度的影响(图6)。2R1B处理Pn与1R1B及W无显著性差异,且均显著高于其他处理(比R、B和1R2B分别高22.30%、21.11%和10.95%)。番茄幼苗Gs随蓝光比例的增加,先升后降,B处理幼苗Gs显著低于1R2B(11.64%),2R1B、1R1B、1R2B和B处理番茄幼苗显著高于W(P<0.05),R处理番茄幼苗和W无显著性差异。处理组的Ci显著高于CK,1R2B和B处理的Ci显著高于其他处理(W除外)。Ls的变化趋势与Ci的变化趋势恰好相反。
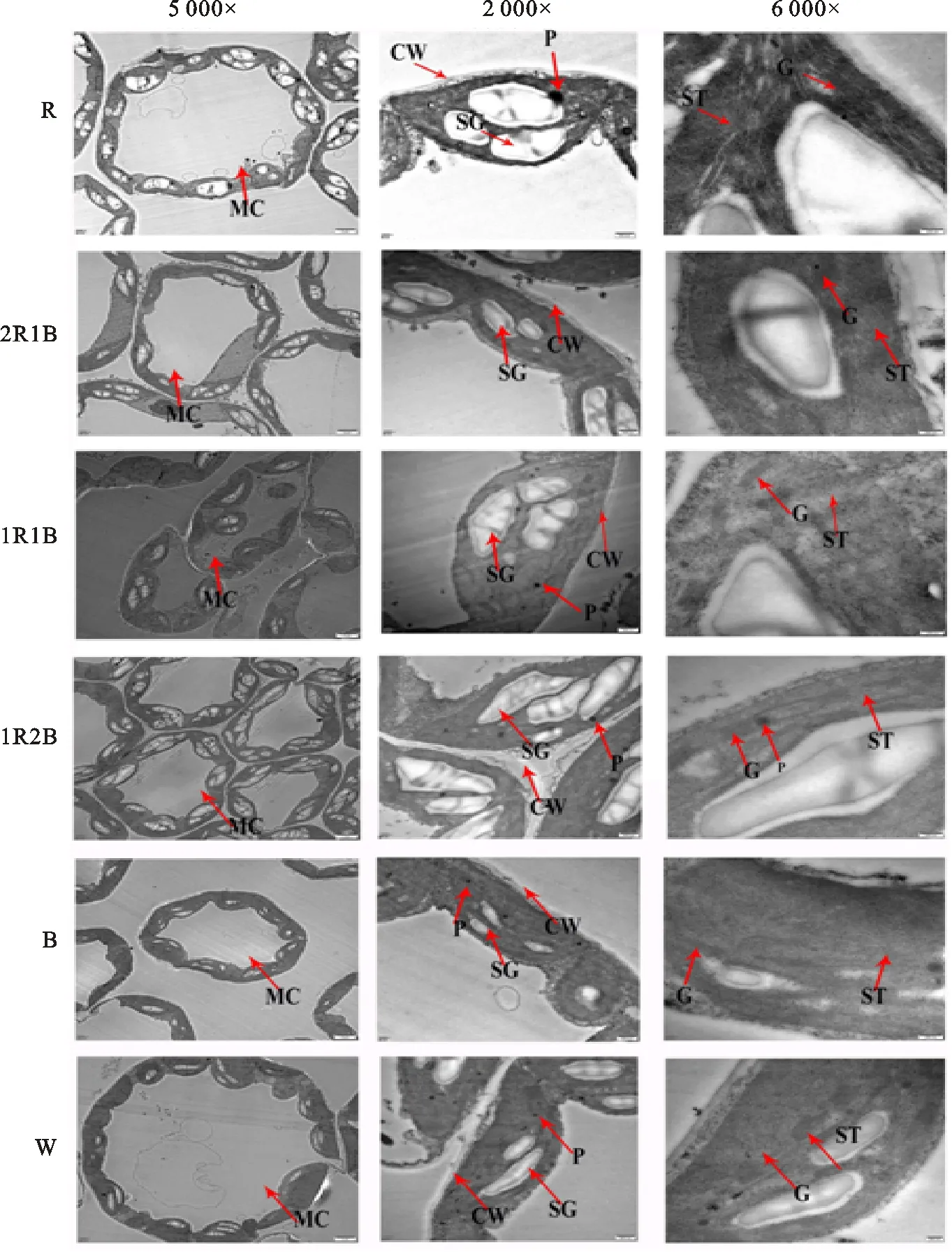
MC.叶肉细胞 Mesophyll cells;CW.细胞壁 Cell wall;CP.叶绿体 Chloroplast;SG.淀粉颗粒 Starch grain;G.基粒类囊体 Granathylakoid; ST.基质类囊体 Stromathylakoid; P.质体小球 Plastoglobulus
图5不同比例红蓝光处理下叶绿体超微结构
Fig.5Structureofchloroplastsunderdifferentredandbluelightratios
2.5 不同比例红蓝光处理对番茄植株Fv′/Fm′ 和ΦPSⅡ的影响
番茄幼苗处理15 d后,不同比例红蓝光处理对Fv′/Fm′和ΦPSⅡ产生了不同程度的影响(表3)。1R1B处理下番茄幼苗的Fv′/Fm′最高,显著高于其他处理,但和B处理下的幼苗无显著差异,R处理下的Fv′/Fm′最低。2R1B、1R1B和1R2B处理下幼苗的ΦPSⅡ无显著性差异,但显著高于其他处理,B处理下的ΦPSⅡ最低。
2.6 不同比例红蓝光处理对番茄植株干、鲜质量的影响
由表4可以看出,不同比例的红蓝光处理对番茄植株地上部和地下部干、鲜质量影响显著。2R1B和1R1B处理植株地下部的鲜质量显著高于其他处理,R、2R1B和1R1B处理间的番茄幼苗地上部鲜质量和总干质量无显著差异,但显著高于其他处理。R、2R1B和1R1B处理番茄不同光质对地上部干质量与总干质量影响趋势一致,2R1B处理地下部干质量和1R1B处理无显著差异,但显著高于其他处理。
由表4和图2可知,2R1B和1R1B处理番茄幼苗植株的壮苗指数无显著差异,但显著高于其他处理。
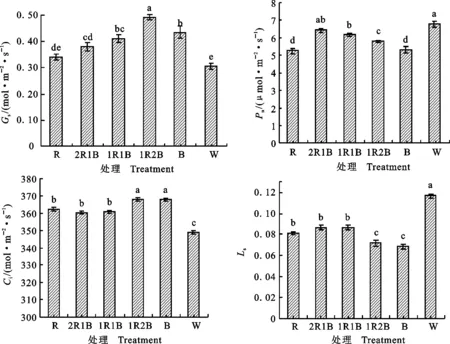
图6 不同比例红蓝光处理下番茄植株的光合特性

表3 不同比例红蓝光质处理下番茄幼苗叶片叶绿素的荧光参数
表4 不同比例红蓝光处理下番茄植株地上部和地下部干、鲜质量
3 讨 论
光在植物生长发育中具有重要作用,既可作为能量供植物生长,也可作为光信号调控其形态建成[25]。大量研究表明,植物的生长发育、叶片形态及干物质积累受光质尤其是红蓝光[9,26]的显著影响。本研究发现R处理下的番茄幼苗株高最高,B处理下最矮,2R1B和1R1B处理下幼苗壮苗指数显著高于其他处理,这与徐文栋等[27]在黄瓜上的研究一致。说明蓝光可以抑制茎的生长,而红光促进茎的伸长。徐文栋等[27]研究发现红光下黄瓜的叶面积最大,而本试验2R1B处理下幼苗的叶面积最大,可能是因为不同种类的蔬菜对光质的响应具有差异性[28],选择合适的光质可以促进作物的生长发育。叶片中的叶绿素是衡量植物生长发育的一个重要指标。Nhutd等[29]发现红光促进草莓试管苗的生长但是降低了叶绿素质量分数,30%蓝光显著提高了草莓试管苗的叶片叶绿素质量分数,这与本试验在红光处理下叶绿素质量分数最高不一致,可能是由不同作物之间的差异性导致。Sander 等[30]报道了50%的蓝光可以提高黄瓜叶片的叶绿素a/b,这与本研究结果相一致。Chla/Chlb反映捕光色素复合体II (LHCII)在所有含叶绿素的结构中所占比例,该比值与植物光能利用率呈正相关[31]。
叶片是植物进行光合作用,将光能转化为化学能的重要组织器官[32]。叶片结构与光合作用存在紧密联系[33]。不同光质处理通过改变植物叶面积、叶片数量、倾斜角度、叶片厚度和叶片结构[33-35],从而最大程度利用光能。本试验发现,1R1B和1R2B处理下番茄叶片的栅栏组织排列整齐、致密。Macedo等[36]研究发现蓝光处理可以显著增加莲子草叶片的上表皮和栅栏组织的厚度,这与本研究发现2R1B处理下可以显著增加栅栏组织、海绵组织和叶片厚度不太一致,这可能与作物的品种有关,需要进一步研究。此外,本试验发现,2R1B处理下叶片栅栏组织厚度显著高于W处理, 这与Liu等[37]报道的红蓝光处理显著增加了番茄叶片的厚度和栅栏组织细胞的长度相一致。以往研究表明,红蓝光处理下的叶肉细胞中含有更多的淀粉粒,基质类囊体和基粒类囊体之间的界线更清晰[38],这与本研究发现的2R1B和1R1B处理下基质、基粒片层清晰,基粒类囊体垛叠较多且排列整齐致密,叶绿体中适当比例的淀粉粒结果相一致;表明适宜比例的红蓝光处理有利于促进叶绿体内部结构整齐,从而促进光合速率的提高。
叶片的光合和荧光特性是衡量作物对光能的吸收、利用与分配的两个重要指标。其中Fv′/Fm′是PSII有效光化学量子产量,反映开放的PSII反应中心原初光能捕获效率,可以表示光合功能的相对限制。本试验中,W和2R1B下叶片Pn均较高,这可能是由于该处理下Chla/b较高、栅栏组织排列更加紧密和叶绿体中类囊体垛叠较多且排列整齐致密,从而增加了叶片对光能的利用率,但是W处理下番茄幼苗的干物质积累和壮苗指数较低,这与王丽伟等[18]研究相似,白光处理下淀粉颗粒体积较小不利于干物质的积累。总之,植物光合作用受到很多因素的影响,而干物质积累和壮苗指数的高低并不能完全反映光合作用的强弱。本试验表明,1R1B处理下Fv′/Fm′和ΦPSⅡ最高,这与苏娜娜等[10]在黄瓜上发现的50%的蓝光可以显著提高光合速率和ΦPSⅡ结果相一致。周成波等[39]发现以白光为背景,红光∶蓝光=1∶1处理下的小白菜的光合作用、Fv′/Fm′和ΦPSⅡ最高,这与本研究结果相一致,表明1R1B处理在一定程度上可以提高植株PS II反应中心活性、原初光能转换效率及光能利用率。
健康强壮的幼苗有利于增加作物的产量和提高蔬菜的品质。Kai等[40]发现增加夜间红光打断次数可以使番茄幼苗更健壮,并增加早期产量。本研究发现R、2R1B和1R1B处理可以显著增加番茄幼苗的地上部和全株的干鲜质量,2R1B和1R1B处理显著增加地下部干鲜质量,可能是该配比可以显著提高碳水化合物的积累,这与Nhutd等[29]发现的30%蓝光+70%红光可以明显提高草莓幼苗地下部和地上部的干质量相符,表明不同光质配比可以显著影响光合同化产物的运输与积累。综上,2R1B和1R1B处理可以明显促进番茄幼苗的干物质积累,为植株后期的生殖生长奠定良好的基础。
4 结 论
本研究结果表明,合适的红蓝光比例有利于改善叶肉细胞结构与叶绿体超微结构,提高植株叶片的光合色素及光合速率,从而促进植株的干物质积累、分配与植株健壮成长。本试验中,2R1B和1R1B下叶绿体基粒、基质片层发育更良好,叶片栅栏组织和海绵组织的厚度较厚,栅栏组织排列比其他处理更整齐、致密,且其叶面积、Pn、Fv′/Fm′和ΦPSⅡ较高,幼苗的壮苗指数最高,株型更紧凑。R、2R1B和1R1B处理下番茄幼苗的干质量显著高于其他处理。综上所述,2R1B和1R1B处理植株生长最好,可做为番茄育苗的合适光质比例。
参考文献Reference:
[1] KRUMBEIN A,PETERS P,BRÜCKNER B.Flavour compounds and a quantitative descriptive analysis of tomatoes(LycopersiconesculentumMill.) of different cultivars in short-term storage[J].PostharvestBiologyandTechnology,2004,32(1):15-28.
[2] 牛 玉,戚志强,韩 旭,等.矮壮素和乙烯利对樱桃番茄幼苗生长的影响[J].热带作物学报,2013,34(12):2353-2357.
NIU Y,QI ZH Q,HAN X,etal.Effect of plant chlormequat and ethephon on growth of cherry tomato seedlings [J].ChineseJournalofTropicalCrops,2013,34(12):2353-2357.
[3] BEROVA M,ZLATEV Z.Physiological response and yield of paclobutrazol treated tomato plants(LycopersiconesculentumMill.)[J].PlantGrowthRegulation,2000,30(2):117-123.
[4 ] 佘佳荣,杨仁斌,王海萍,等.多效唑在油菜植株、油菜籽和土壤中的残留[J].农药学学报,2008,10(1):113-116.
SHE J R,YANG R B,WANG H P,etal.Paclobutrazol residue in rapeseed plant,rapeseed and soil[J].ChineseJournalofPesticideScience,2008,10(1):113-116.
[5] 包媛媛,张新永,邵金良,等.多效唑在番茄和土壤中的残留与降解动态研究[J].生态环境学报,2014,23(5):864-869.
BAO Y Y,ZHANG X Y,SHAO J L,etal.Dynamics of the residue and degradation of paclobutrazol in tomato and soil[J].EcologyandEnvironmentSciences,2014,23(5):864-869.
[6] HERNNDEZ R,KUBOTA C.Physiological responses of cucumber seedlings under different blue and red photon flux ratios using LEDs [J].EnvironmentalandExperimentalBotany,2016,121(1):66-74.
[7] 徐圆圆,覃 仪,吕蔓芳,等.LED光源在植物工厂中的应用[J].现代农业科技,2016(6):161-162,170.
XU Y Y,QIN Y,LÜ M F,etal.Current status and developmental trends of LED light source utilization in plant factory [J].ModernAgriculturalScienceandTechnology,2016(6):161-162,170.
[8] 崔 瑾,徐志刚,邸秀茹.LED在植物设施栽培中的应用和前景[J].农业工程学报,2008,24(8):249-253.
CUI J,XU ZH G,DI X R.Applications and prospects of light emitting diode in plant protected culture [J].TransactionsoftheChineseSocietyofAgriculturalEngineering,2008,24(8):249-253.
[9] WANG J,LU W,TONG Y,etal.Leaf morphology,photosynthetic performance,chlorophyll fluorescence,stomatal development of lettuce(LactucasativaL.) exposed to different ratios of red light to blue light[J].FrontiersinPlantScience,2016,7:1-9.
[10] 苏娜娜,邬 奇,崔 瑾.LED光质补光对黄瓜幼苗生长和光合特性的影响[J].中国蔬菜,2012(24):48-54.
SU N N,WU Q,CUI J.Effects of supplemental lighting with LED light quality on growth and photosynthetic characteristics of cucumber seedlings [J].ChinaVegetables,2012(24):48-54.
[11] 陈祥伟,刘世琦,王 越,等.不同LED光源对乌塌菜生长、光合特性及营养品质的影响[J].应用生态学报,2014,25(7):1955-1962.
CHEN X W,LIU SH Q,WANG Y,etal.Effects of different LED light qualities on growth,photosynthetic characteristics and nutritional quality of savoy [J].ChineseJournalofAppliedEcology,2014,25(7):1955-1962.
[12] 邢泽南,张 丹,李 薇,等.光质对油葵芽苗菜生长和品质的影响[J].南京农业大学学报,2012,35(3):47-51.
XING Z N,ZHANG D,LI W,etal.Effects of light quality on the growth and quality ofHelianthusannuussprouts [J].JournalofNanjingAgriculturalUniversity,2012,35(3):47-51.
[13] POUDEL P R,KATAOKA I,MOCHIOKA R.Effect of red-and blue-light-emitting diodes on growth and morphogenesis of grapes [J].PlantCell,TissueandOrganCulture,2008,92(2):147-153.
[14] REED J W,NAGPAL P,POOLE D S,etal.Mutations in the gene for the red/ far-red light receptor phytochrome B alter cell elongation and physiological responses throughoutArabidopsisdevelopment[J].PlantCell,1993,5(2):147-157.
[15] GUPTA V,TRIPATHY B C.Effect of light quality on chlorophyll accumulation and protein expression in wheat(TriticumaestivumL.) seedlings [J].InternationalJournalofBiotechnology&Biochemistry,2010,6(4):521-536.
[16] TALBOTT L D,SHMAYEVICH I J,CHUNG Y,etal.Blue light and phytochrome-mediated stomatal opening in the npq1 and phot1 phot2 mutants ofArabidopsis[J].PlantPhysiology,2003,133(4):1522-1529.
[17] SBA,KREKLING T,APPELGREN M.Light quality affects photosynthesis and leaf anatomy of birch plantlets in vitro [J].PlantCellTissue&OrganCulture,1995,41(2):177-185.
[18] 王丽伟,李 岩,辛国凤,等.不同比例红蓝光对番茄幼苗生长和光合作用的影响[J].应用生态学报,2017,28(5):1595-1602.
WANG L W,LI Y,XIN G F,etal.Effects of different proportions of red and blue light on the growth and photosynthesis of tomato seedlings[J].ChineseJournalofAppliedEcology,2017,28(5):1595-1602.
[19] MIZUNO T,OKA H,YOSHIMURA F,etal.Insight into the mechanism of end-of-day far-red light(EODFR)-induced shade avoidance responses inArabidopsisthaliana[J].JournaloftheAgriculturalChemicalSocietyofJapan,2015,79(12):1987-1994.
[20] LI H M,XU ZH G,TANG C M.Effect of light-emitting diodes on growth and morphogenesis of upland cotton(GossypiumhirsutumL.) plantlets in vitro[J].PlantCellTissueandOrganCulture,2010,103(2):155-163.
[21] LIN K H,HUANG M Y,HUANG W D,etal.The effects of red,blue,and white light-emitting diodes on the growth,development,and edible quality of hydroponically grown lettuce(LactucasativaL.var.capitata)[J].ScientiaHorticulturae,2013,150:86-91.
[22] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:74-77.
GAO J F.Plant Physiology Experiment Guide[M].Beijing:Higher Education Press,2006:74-77.
[23] 吴 涛,耿云芬,柴 勇,等.三叶爬山虎叶片解剖结构和光合生理特性对3种生境的响应[J].生态环境学报,2014,23(10):1586-1592.
WU T,GENG Y F,CHAI Y,etal.Response of leaf anatomical structure and photosynthesis characteristics ofParthenocissushimalayanato three habitat types[J].EcologyandEnvironmentalSciences,2014,23(10):1586-1592.
[24] HE X,LIU B.Oolong tea extract as a substitute for uranyl acetate in staining of ultrathin sections based on examples of animal tissues for transmission electron microscopy[J].JournalofMicroscopy,2017,267(1):27-33.
[25] SHIMAZAKI K,DOI M,ASSMANN S M,etal.Light regulation of stomatal movement [J].AnnualReviewofPlantBiology,2007,58(1):219-247.
[26] YORIO N C,GOINS G D,KAGIE H R,etal.Improving spinach,radish,and lettuce growth under red light-emitting diodes(LEDs) with blue light supplementation[J].HortscienceAPubicationoftheAmericanSocietyforHorticulturalScience,2001,36(2):380-383.
[27] 徐文栋,刘晓英,焦学磊,等.不同红蓝配比的LED光调控黄瓜幼苗的生长[J].植物生理学报,2015,51(8):1273-1279.
XU W D,LIU X Y,JIAO X L,etal.Different ratio of red and blue LED regulation growth and development of cucumber seedlings[J].PlantPhysiologyJournal,2015,51(8):1273-1279.
[28] KEIKO O K,TAKASE M,MON N,etal.Effect of light quality on growth and vegetable quality in leaf lettuce,spinach and komatsuna [J].EnvironmentControlinBiology,2007,45(3):189-198.
[29] NHUTD T,TAKAMURA T,WATANABE H,etal.Responses of strawberry plantlets cultured in vitro under superbright red and blue light-emitting diodes(LEDs) [J].PlantCellTissue&OrganCulture,2003,73(1):43-52.
[30] SANDER W,HOGEWONING,GOVERT TROUWBO- RST,etal.Blue light dose-responses of leaf photosynthesis,morphology,and chemical composition of Cucumis sativus grown under different combinations of red and blue light [J].JournalofExperimentalBotany,2010,61(11):3107-3117.
[32] TERASHIMA I,HANBA Y T,THOLEN D,etal.Leaf functional anatomy in relation to photosynthesis [J].PlantPhysiology,2011,155(1):108-116.
[33] MEIER I C,LEUSCHNER C.Leaf size and leaf area index in Fagus sylvatica forests:competing effects of precipitation,temperature,and nitrogen availability[J].Ecosystems,2008,11(5):655-669.
[34] 张 超,杨晓盆,王文梅,等.不同光质对美国红栌叶片结构的影响[J].山西林业科技,2008(1):4-6.
ZHANG CH,YANG X P,WANG W M,etal.Effect of light quality on tissue of leaf ofCotinuscoggygria‘Royal purple’[J].ShanxiForestryScienceandTechnology,2008(1):4-6.
[35] LEE D W,OBERBAUER S F,JOHNSON P,etal.Effects of irradiance and spectral quality on leaf structure and function in seedlings of two Southeast Asian Hopea(Dipterocarpaceae) species[J].AmericanJournalofBotany,2000,87(4):447-455.
[36] MACEDO A F,LEAL-COSTA M V,TAVARES E S,etal.The effect of light quality on leaf production and development of in vitro-cultured plants ofAlternantherabrasilianaKuntze[J].Environmental&ExperimentalBotany,2011,70(1):43-50.
[37] LIU X Y,GUO SH R,XU ZH G,etal.Regulation of chloroplast ultrastructure,cross-section anatomy of leaves,and morphology of stomata of cherry tomato by different light irradiations of light-emitting diodes[J].JournalofBiotechnology,2011,24(2):129-139.
[38] SCHREIBER U,BILGER W,NEUBAUER C.Chlorophyll Fluorescence as a Nonintrusive Indicator for Rapid Assessment of in vivo Photosynthesis[M]//Ecophysiology of Photosynthesis.Springer Berlin Heidelberg,1995:49-70.
[39] 周成波,张 旭,崔青青,等.LED补光光质对小白菜生长及光合作用的影响[J].植物生理学报,2017,53(6):1030-1038.
ZHOU CH B,ZHANG X,CUI Q Q,etal.Effects of supplementary light quality on growth and photosynthesis of pakchoi(Brassicacampestris)[J].PlantPhysiologyJournal,2017,53(6):1030-1038.
[40] KAI C,CUI L,LIN Y,etal.Effects of red light night break treatment on growth and flowering of tomato plants [J].FrontiersinPlantScience,2016(7):527.
