小麦 TaCYP78A5基因的克隆及生物信息学分析
2018-06-06郑雅月张炳慧赵万春李晓燕西北农林科技大学农学院陕西杨凌7200陕西省小麦工程技术研究中心陕西省小麦新品种培育工程研究中心陕西杨凌7200
郑雅月,杨 璐,张炳慧,赵万春,2,董 剑,2,高 翔,2,李晓燕,2(.西北农林科技大学 农学院,陕西杨凌 7200;2.陕西省小麦工程技术研究中心/陕西省小麦新品种培育工程研究中心,陕西杨凌 7200)
小麦产量由单位面积穗数、穗粒数和千粒质量3因素构成,其中千粒质量在产量构成因素中受遗传特性的影响最大,广义遗传力高达59%~80%[1]。小麦籽粒大小影响千粒质量的形成,属于受多基因控制的数量性状[2]。在前人的研究中,利用不同的群体材料,小麦籽粒大小和产量相关的QTL被鉴定出来。例如,Kumar等[3]将控制粒质量的QTL定位在1AS、2BS、7AS上,这些QTL可解释9.06%~19.85%的表型变异;王瑞霞等[4]在多个环境下将21个与千粒质量相关的 QTL定位在小麦1A、1B、2A、2D、3B、4A、4D、5A、6D和7D染色体上。这些QTL的鉴定与定位,为小麦籽粒大小基因的精细定位与克隆奠定了很好的前期基础。
目前,对于小麦籽粒大小相关基因的克隆已经取得了一些进展。Song等[5]研究发现,水稻粒宽基因(OsGW2)的同源基因TaGW2通过控制种子发育影响千粒质量。常成等[6]在小麦中克隆了水稻GS3的同源基因PEBP-like基因,发现PEBP-like基因的变异对籽粒的大小以及粒质量产生影响。Wang等[7]克隆了水稻籽粒大小基因OsGS5的同源基因TaGS5,TaGS5-A1与粒宽、粒质量相关,TaGS5-A1b等位基因在种子发育的各个时期其表达量均高于TaGS5-A1a。在水稻中,许多与种子大小相关的基因已经被克隆和功能研究;但在小麦中种子大小相关基因的功能研究还未深入,小麦籽粒大小形成缺乏相应的分子证据。因此,对小麦籽粒大小相关基因进行克隆,并对这些基因如何调控小麦籽粒大小的形成进行解析,是阐释小麦籽粒大小形成的分子机制的重要前提。
细胞色素P450(Cytochromes P450)是植物中最大的蛋白家族之一[8]。对细胞色素P450的研究发现,CYP78A家族成员具有控制籽粒大小的功能[9-13]。拟南芥中CYP78A5/KLUH基因控制种子的大小,其作用独立于其他母系因素,通过促进种皮细胞增殖而决定种子大小[9]。拟南芥中CYP78A9基因也是通过控制胚珠和种子发育阶段表皮细胞的增殖,进而控制种子表皮的大小,影响种子的大小[13]。在水稻中CYP78A13通过调节胚与胚乳之间的大小平衡来调节种子的大小,CYP78A13基因功能缺失突变体的种子胚增大但胚乳减小,而过表达CYP78A13则会导致种子的胚减小和胚乳增大[12,14];番茄中CYP78A5/KLUH的同源基因SlKLUH也通过增加细胞数量调控果实大小[15-17]。前人通过遗传和蛋白结构分析认为CYP78A家族成员之间具有相似功能,然而,小麦中关于CYP78A5的功能研究报道还比较少,CYP78A5基因在小麦中对种子生长发育的调控机理还未被揭示。本研究通过克隆小麦不同籽粒大小材料中CYP78A5基因,分析TaCYP78A5在大粒小麦‘P271’和小粒小麦‘中国春’(‘CS’)序列变异,并进行生物信息学分析,探究其在小麦种子大小形成中的作用,为小麦中细胞色素P450基因调控种子大小提供新的证据。
1 材料与方法
1.1 试验材料
小麦大粒材料‘P271’和小粒材料‘中国春’(‘CS’)均由西北农林科技大学农学院小麦品质遗传育种实验室提供(图1)。将‘中国春’和‘P271’小麦种子用质量分数为3%的次氯酸钠消毒,然后利用体积分数1%的H2O2溶液催芽处理后在培养箱中培养。2周后,取幼嫩的叶片提取DNA。2016年10月,‘中国春’和‘P271’按常规方法种植在杨凌小麦综合试验站实验田,进行常规播种与田间管理。
1.2 试验方法
1.2.1 籽粒表型测定 籽粒的粒长、粒宽、千粒质量均由万深SC-A型种子自动考种仪千粒质量仪测定,表1所示的数据结果是284粒‘中国春’籽粒和285粒‘P271’籽粒经仪器测量和软件处理所得。
1.2.2 总DNA提取 采用CTAB法[18]提取小麦叶片基因组总DNA。
1.2.3 引物设计和基因克隆 根据NCBI中已公布的基因序列号KT266824.1,采用Primer premier 5.0软件设计特异性引物TaCYP78A5-F和TaCYP78A5-R,由上海生工生物工程技术服务有限公司合成。以‘中国春’和‘P271’幼苗中提取的DNA为模板,用引物进行PCR扩增,按2×EsTaqMasterMix (CWBIO)说明书配制反应体系25.0 μL,含2×TaqMasterMix 12.5 μL、10 μmol·L-1上下游引物各2.0 μL、DNA 2.0 μL、ddH2O 6.5 μL。扩增程序为 95 ℃ 5 min;95 ℃ 50 s,58 ℃ 50 s,72 ℃ 2 min,30个循环,72 ℃ 10 min。扩增产物经琼脂糖凝胶电泳检测后回收目标产物,将目的片段与克隆载体PEASY-T1(TransGen Biotech)连接并转化入感受态细胞Transl-T1中,筛选阳性单克隆,送上海生工生物工程技术服务有限公司测序。
1.2.4TaCYP78A5基因生物信息学分析 利用NCBI中BLAST在线软件(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRA)进行基因序列比对分析,利用NCBI中ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测序列开放阅读框,利用DNAMAN 7.0进行基因序列及蛋白质序列比对,在NCBI中CDD(http s:// www. ncbi . nlm.nih.gov/Structure/cdd/docs/cdd_search.html)在线预测氨基酸序列保守结构域,利用ProtParam进行蛋白质一级序列分析(http://web.expasy.org/protparam/),利用NPS@网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsaautomat.pl=/NPSA/npsa_sopma.html)预测蛋白质二级结构,利用SWISS-MODEL软件(https://swissmodel.expasy.org/ repository)预测蛋白质三级结构。利用pfam预测蛋白质的信号肽(http://pfam.xfam.org/search#tabview=tab1),利用TMHMM预测蛋白质的跨膜区(http://www.cbs.dtu.dk/ services/TMHMM/)。利用CYP78A5基因全长及其推导的氨基酸序列,在GenBank数据库查找其同源序列,发现近缘物种中已克隆CYP78A家族的基因序列,通过MEGA 5.0的最大似然法(Maximum Likelihood method)构建系统进化树。
2 结果与分析
2.1 籽粒表型变异
利用自动考种仪千粒质量仪测量‘中国春’和‘P271’种子。经过仪器自带的软件处理得出‘中国春’籽粒的平均宽度为2.59 mm,平均长度为5.32 mm,千粒质量为27.68 g,而‘P271’籽粒的平均宽度3.54 mm,平均长度为7.59 mm,千粒质量为57.48 g,‘P271’的籽粒长、宽、千粒质量都明显高于‘中国春’(表 1)。因此,本试验将‘中国春’作为小粒材料,‘P271’作为大粒材料研究TaCYP78A5基因与小麦籽粒大小形成的关系。

图1 小麦‘CS’和‘P271’的籽粒粒型

表1 ‘CS’和‘P271’籽粒的表型数值
2.2 TaCYP78A5基因克隆和序列分析
以特异性引物TaCYP78A5-F:TCTTTCCATGGTTACCGGCC和TaCYP78A5-R:CAG- CTCTCTCTGGCCCTAG扩增得到‘中国春’和‘P271’的TaCYP78A5基因序列各18个,这18条序列聚集成3类,将3类序列提交到小麦资源库(https://urgi.versailles.inra.fr /blast/blast.php)进行BLAST比对,分别定位到小麦2AS、2BS、2DS染色体上,命名为TaCYP78A5-2A、TaCYP78A5-2B和TaCYP78A5-2D。将TaCYP78A5基因的氨基酸序列在NCBI进行比对,结果显示TaCYP78A5属于细胞色素P450家族成员(图2-A)。利用NCBI中ORF Finder预测序列开放阅读框,TaCYP78A5与其他CYP78A家族成员一样均由2个外显子和1个内含子组成,不同染色体上的TaCYP78A5-2A、TaCYP78A5-2B和TaCYP78A5-2D序列之间显示出98.17%的高度相似性。TaCYP78A5-2A、TaCYP78A5-2B和TaCYP78A5-2D的编码区长度分别为1 608、1 638和1 650 bp,编码534、544、549个氨基酸(图2-B)。
2.3 TaCYP78A5的蛋白结构预测
利用Protparam网站进行TaCYP78A5蛋白质3个染色体组上序列一级序列理化性质预测如表2,结果显示蛋白不稳定系数大于40,亲水性均为正值,说明TaCYP78A5蛋白可能是不稳定的脂溶性疏水蛋白,且3条染色体上的结果相一致。利用NPS@的SOPMA网站预测TaCYP78A5蛋白序列的二级结构,以TaCYP78A5-2A为例,如图3-A中的预测结果表明,α-螺旋比例最高,达到49.63%左右;29.96%左右为无规则卷曲;伸展链的比例在12.55%,β-转角最少,约占7.87%。二级结构预测,该蛋白主要以α-螺旋和无规卷曲为主,含少量β-转角。TaCYP78A5-2B和TaCYP78A5-2D的二级结构组成与TaCYP78A5-2A相似度很高,TaCYP78-A5-2B蛋白的α-螺旋、无规则卷曲、伸展链、β-转角分别各占47.79%、28.86%、14.15%、9.19%。TaCYP78A5-2D蛋白的α-螺旋、无规则卷曲、伸展链、β-转角分别各占45.36%、29.87%、16.76%、8.01%。在SWISS-MODEL网页提交TaCYP78A5基因的氨基酸序列,在蛋白结构库中搜索比对模板,得到4i8v.1.A序列与TaCYP78A5氨基酸序列的第48~544个残基的一致性达28%,且4i8v.1.A序列编码蛋白也是P450家族蛋白,具备同源建模的条件。从而得到本研究中TaCYP78A5-2A基因所编码蛋白的三维结构模型如图3-B,TaCYP78A5-2B和TaCYP78A5-2D蛋白的三级结构组成与TaCYP78A5-2A相似度很高,都是由α-螺旋和两个反向平行的β-折叠及一对β-转角组成。将TaCYP78A5编码的蛋白氨基酸序列输入TMHMM网址进行蛋白跨膜区结构分析,跨膜区预测结果分析表明该蛋白是膜锚定蛋白,具有跨膜结构域,第 1~8 个氨基酸为膜内区域,第 9~31个氨基酸为跨膜区域,其余的均为膜外区域。Pfam的预测结果(图3-C)也表明第 1~44 个氨基酸为信号肽区域,其余的为与数据库比对到的P450家族的序列区域,由此推测TaCYP78A5是一种分泌蛋白。

A.TaCYP78A5基因蛋白家族预测 Proteins prediction ofTaCYP78A5;B.不同植物中CYP78A5氨基酸序列比对,深蓝色区域为保守结构域 Alignment of amino acid sequence of CYP78A5 in different plants,the dark blue regions are conserved domain
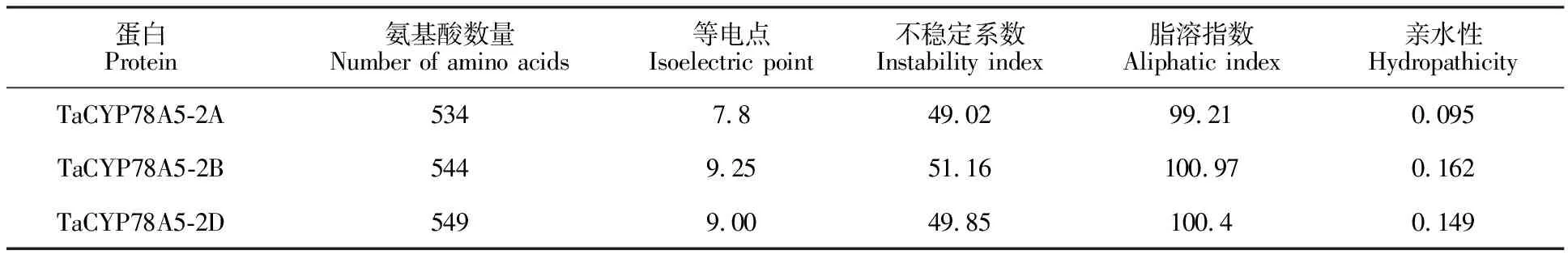
图2 小麦CYP78A5蛋白家族预测及推测的氨基酸序列与其他植物的CYP78A5氨基酸序列比对
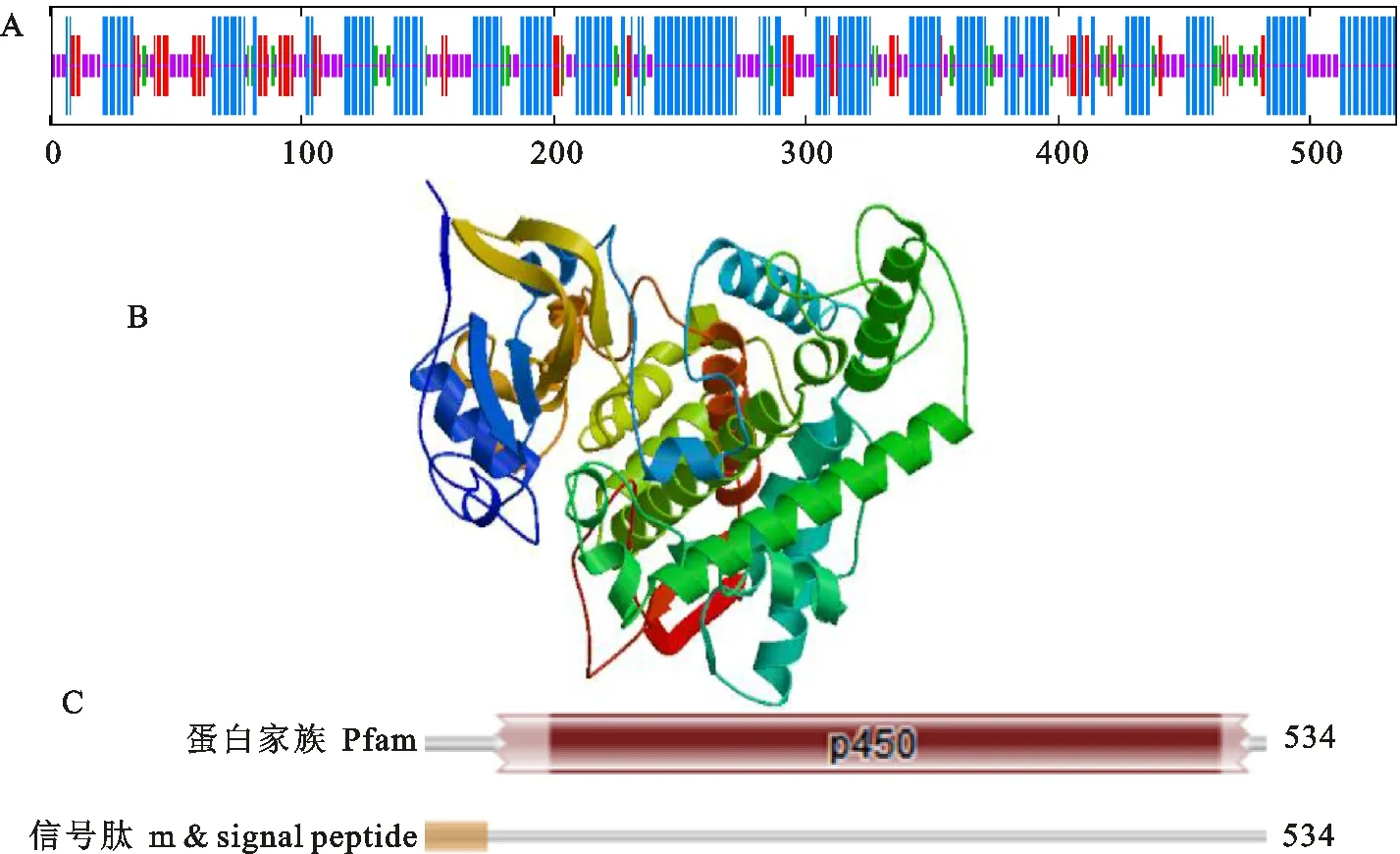
A.TaCYP78A5-2A蛋白的二级结构,蓝色区域为α-螺旋,紫色区域为无规卷曲,红色区域为伸展链,绿色区域为β-转角 Secondary structure of TaCYP78A5-2A protein,blue area shows alpha helix,purple region as a random coil,the red area is extended strand,the green area is beta turn;B.TaCYP78A5-2A蛋白的三级结构预测 Predicted tertiary structure of TaCYP78A5 protein;C.TaCYP78A5序列匹配和特征 TaCYP78A5 sequence matches and features
图3TaCYP78A5的蛋白结构预测
Fig.3PredictedstructureofTaCYP78A5protein
2.4 CYP78A基因进化分析
根据TaCYP78A5氨基酸序列与NCBI中的同源序列比对,发现TaCYP78A5序列与水稻及节节麦序列达到85%的一致性(图2-B),其中TaCYP78A5-2D与节节麦的CYP78A5-like(GenBank登录号为XM_020344923)蛋白有很高的一致性(93%),进一步构建TaCYP78A5和其他已知CYP78A家族成员的系统进化树(图4),水稻CYP78A13(GenBank登录号为AB780362.1)与水稻CYP78A5(GenBank登录号为XM_015790749)基因聚于一个分支,显示出更高的一致性(100%)。且CYP78A家族的其他基因如CYP78A11在不同单子叶物种中的相似性都比较高,可以推测CYP78A家族在单子叶植物中的功能相对保守。而且Xu等[14]研究显示水稻CYP78A13基因能够在拟南芥中恢复cyp78a5的缺失表型,这表明CYP78A13和CYP78A5可能是直系同源基因。因此,本研究克隆到的TaCYP78A5基因编码一个小麦细胞色素P450蛋白,并且可能是拟南芥CYP78A5的直系同源基因。
3 讨 论
在CYP450家族中,CYP78A与其他成员不同,它参与植物种子发育等植物特异反应[9,12]。通过对一个新的CYP78A5基因突变体的表型观察,证明了CYP78A5基因参与多个生长发育调控途径,包括可能调控植物体的细胞增殖以及发育时期的转换等,而这些调控途径又通过CYP78A5这样的基因形成复杂的调控网络,从而保证植物的正常生长[19]。CYP78A5基因间接调控赤霉素合成代谢相关基因[20],且不直接调控植物激素如生长素、细胞分裂素以及油菜素内酯等的代谢[19]。
在模式植物拟南芥和水稻中的研究已经证明CYP78A基因家族多个成员如CYP78A5,CYP78A9和CYP78A13等均具有控制种子大小的功能[9,13-14]。在拟南芥中,Adamski等[9]发现了调控籽粒大小的KLUH/CYP78A5,籽粒中过表达KLU基因,种子的体积和质量都会显著增加;而当该基因功能缺失时,种子的体积和质量又会显著降低;KLU基因在花后的胚珠内表皮中表达,通过促进内表皮细胞的增殖,增大表皮细胞的数目,从而达到增大种子表皮的效果,进而增加种子的大小和质量。在水稻中,CYP78A9和其同源基因CYP78A6、CYP78A8,通过促进细胞增殖来调控花器官的生长及种子发育[13,17]。编码CYP78A13的GE基因在平衡胚和胚乳大小方面有重要的影响,GE基因功能缺失后,胚变大而胚乳变小;相反地,CYP78A13蛋白过表达后,胚变小而胚乳变大,从而导致水稻种子增大[12,14]。而水稻的CYP78A13基因能够在拟南芥中恢复cyp78a5的缺失表型,这表明CYP78A13和CYP78A5可能是直系同源基因[14]。

图4 CYP78A家族进化分析
Miyoshi等[21]发现水稻PLA1/CYP78A11基因通过影响顶端分生组织的细胞增殖来调控生殖器官的发育,但在顶端分生组织未检测到CYP78A11基因的表达,CYP78A11基因可能通过非细胞自制模式控制生殖器官发育。Anastasiou等[22]仅在拟南芥叶、花器官基部检测到CYP78A5基因的表达,其促生作用却贯穿整个植株;并提出CYP78A5基因可能依赖于一个可以在细胞间移动的信号,通过非细胞自制模式促进器官生长。相似的,Adamski等[9]发现,PINO:CYP78A5转基因拟南芥植株中仅在胚珠中过表达CYP78A5基因,却导致拟南芥花器官的增大、花序的伸长,这一现象也支持CYP78A5基因非细胞自制的作用模式。
本研究克隆的TaCYP78A5与其他CYP78A家族成员一样均由2个外显子和1个内含子组成,并与水稻中CYP78A5具有很高的相似性。因此,我们可以推测CYP78A5的同源基因TaCYP78A5在小麦中也可能具有在水稻、拟南芥中类似的功能,通过促进胚珠和种子发育阶段表皮细胞增殖来影响种子大小。本研究通过对核酸序列和编码的氨基酸序列比对分析发现‘P271’和‘中国春’克隆到的TaCYP78A5基因序列一致,说明TaCYP78A5基因在这2个粒型的小麦中相对保守。推测TaCYP78A5基因对这2种粒型的小麦的作用可能是通过在小麦‘P271’的根、茎、叶各组织或籽粒发育过程中基因表达量较高引起的,也可能是TaCYP78A5基因的启动子在2个材料中的差异所引起。关于TaCYP78A5基因在小麦中的具体的分子作用机制还需进一步证明。
参考文献Reference:
[1] 庄巧生.中国小麦品种改良及系谱分析[M].北京:中国农业出版社,2003:497-518.
ZHUANG Q SH.Analysis of Chinese Wheat Improvement and Pedigree [M].Beijing:China Agriculture Press,2003:497-518.
[2] CAMPBELL K G,BERGMAN C J,GUALBERTO D G,etal.Quantitative trait loci associated with kernel traits in a soft× hard wheat cross[J].CropScience,1999,39(4):1275-1285.
[3] KUMAR N,KULWAL P L,GAUR A,etal.QTL analysis for grain mass in common wheat [J].Euphytica,2006,151(2):135-144.
[4] 王瑞霞,张秀英,伍 玲,等.不同生态环境下冬小麦籽粒大小相关性状的QTL分析[J].中国农业科学,2009,42(2):398-407.
WANG R X,ZHANG X Y,WU L,etal.QTL Analysis of grain size and related traits in winter wheat under different ecological environments [J].ScientiaAgriculturaSinica,2009,42(2):398-407.
[5] SONG X J,HUANG W,SHI M,etal.A QTL for rice grain width and mass encodes a previously unknown RING-type E3 ubiquitin ligase [J].NatureGenetics,2007,39(5):623-630.
[6] 常 成,张海萍,张秀英,等.小麦PEBP-like基因等位变异与籽粒大小,粒重关系研究[J].分子植物育种,2009,7(1):23-27.
CHANG CH,ZHANG H P,ZHANG X Y,etal.Study on relationship between allelic variation inPEBP-likegene and grain size and mass in common wheat [J].MolecularPlantBreeding,2009,7(1):23-27.
[7] WANG S,ZHANG X,CHEN F,etal.A single-nucleotide polymorphism ofTaGS5 gene revealed its association with kernel mass in Chinese bread wheat [J].FrontiersinPlantScience,2015,6(1166):1166.
[8] NELSON D R,SCHULER M A,PAQUETTE S M,etal.Comparative genomics of rice andArabidopsis.Analysis of 727 cytochrome P450 genes and pseudo genes from a monocot and a dicot [J].PlantPhysiology,2004,135(2):756-772.
[9] ADAMSKI N M,LENHARD M,ERIKSSON S,etal.Local maternal control of seed size byKLUH/CYP78A5-dependent growth signaling [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2009,106(47):20115-20120.
[10] ITO T,MEYEROWITZ E M.Overexpression of a gene encoding a cytochrome P450,CYP78A9,induces large and seedless fruit inArabidopsis[J].PlantCell,2000,12(9):1541-1550.
[11] WANG J W,SCHWAB R,CZECH B,etal.Dual effects of miR156-targeted SPL genes andCYP78A5/KLUHon plastochron length and organ size inArabidopsisthaliana[J].PlantCell,2008,20(5):1231-1243.
[12] NAGASAWA N,HIBARA K I,HEPPARD E P,etal.GIANT EMBRYO encodesCYP78A13,required for proper size balance between embryo and endosperm in rice [J].PlantJournalforCell&MolecularBiology,2013,75(4):592-605.
[13] SOTELO-SILVEIRA M,CUCINOTTA M,CHAUVIN A L,etal.Cytochrome P450CYP78A9 is involved inArabidopsisreproductive development [J].PlantPhysiology,2013,162(2):779-799.
[14] XU F,FANG J,OU S,etal.Variations inCYP78A13 coding region influence grain size and yield in rice[J].PlantCell&Environment,2015,38(4):800-811.
[15] MONFORTE A J,DIAZ A,CANO-DELGADO A,etal.The genetic basis of fruit morphology in horticultural crops:lessons from tomato and melon [J].JournalofExperimentalBotany,2014,65(16):4625-4637.
[16] VAN D K E,CHAKRABARTI M,CHU Y H,etal.What lies beyond the eye:the molecular mechanisms regulating tomato fruit mass and shape [J].FrontiersinPlantScience,2014,5(5):227.
[17] FANG W J,WANG Z B,CUI R F,etal.Maternal control of seed size byEOD3/CYP78A6 inArabidopsisthaliana[J].PlantJournalforCell&MolecularBiology,2012,70(6):929-939.
[18] MURRAY M G,THOMPSON W F.Rapid isolation of high molecular mass plant DNA [J].NucleicAcidsResearch,1980,8(19):4321-4325.
[19] 柴燕群,罗 达,杨 军.细胞色素P450基因CYP78A5/KLUH控制拟南芥叶发育的时期转换[J].植物生理学报,2012,48(6):605-610.
CHAI Y Q,LUO D,YANG J.Cytochrome P450CYP78A5/KLUHparticipates in regulating phase transition of leaf development inArabidopsisthaliana[J].PlantPhysiologyJournal,2012,48(6):605-610.
[20] NEMHAUSER J L,HONG F,CHORY J.Different plant hormones regulate similar processes through largely nonoverlapping transcriptional responses [J].Cell,2006,126(3):467-475.
[21] MIYOSHI K,AHN B O,KAWAKATSU T,etal.PLASTOCHRON1,A timekeeper of leaf initiation in rice,encodes cytochrome P450 [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2004,101(3):875-880.
[22] ANASTASIOU E,LENHARD M.Growing up to one’s standard [J].CurrentOpinioninPlantBiology,2007,10(1):63-69.
