G族黄曲霉毒素半抗原分子设计、抗原合成及抗体特性
2018-06-06王亚楠王晓斐牛琳琳张海棠王自良河南科技学院动物科技学院河南新乡453003河南科技学院新科学院河南新乡453003
王亚楠,王晓斐,牛琳琳,雷 壮,张海棠,王自良(.河南科技学院 动物科技学院,河南新乡 453003;.河南科技学院 新科学院,河南新乡 453003)
黄曲霉毒素(Aflatoxin,AF)对机体具有急性、慢性、致癌和免疫抑制等毒性作用,其中以AFB1毒性最强,污染广泛,比例最高(占 50% 以上)。世界上大多数国家对食品中 AFB1最大残留限量(Maximum residue limit,MRL)都做出明确规定[1-2]。自然条件下产生的 AF 主要包括 B1、B2、G1、G24 种,其污染食品的特点是多种毒素几乎同时存在,且具有毒性加性效应,制订 AF 总量(Total aflatoxins,TAFs)(B1+B2+G1+G2)的 MRL 及相应检测方法已成为发展趋势[3]。至 2013 年,世界上已有 91 个国家采用TAFs限量标准,如国际食品法典委员会(CAC)、美国食品与药物监督管理局(FDA)等规定食品中 TAFs 限量标准为 15 μg·kg-1,日本为 10 μg·kg-1,欧盟为 4 μg·kg-1,中国现有标准尚未涉及 TAFs 限量要求,但在《GB/T 5009.23-2006 食品中黄曲霉毒素 B1、B2、G1、G2的测定》标准中规定了 TAFs 限量的检测方法[4]。
食品中TAFs分析方法主要有理化分析和免疫分析两类,其中免疫分析方法由于具有选择性强、灵敏度高、快速简便、样品筛检量大、可现场操作等优势,已成为TAFs检测研究的热点课题,并在TAFs快速检测中发挥重要作用[5]。高质量的抗体是建立免疫分析方法的核心试剂,就目前的研究进展而言,实现TAFs免疫分析的主要途径之一是分别制备针对B族AF和G族AF的灵敏度高、特异性强的单一抗体,之后形成混合通用抗体,而高质量抗体的制备依赖于半抗原分子设计与抗原合成[6]。关于G族AF抗原合成方法的研究国内外已有相关报道,但对不同半抗原分子设计、抗原合成及抗体特性比较分析方面的研究尚未见报道。本研究以AFG1为反应起始原料,旨在通过不同AFG1半抗原分子设计与抗原合成方法合成人工抗原,制备多克隆抗体(pAb),并对其特性进行分析,筛选出最佳半抗原分子设计与抗原合成方法,为特异性强、亲和力高、识别谱广的G族AF高质量抗体的制备和TAFs免疫分析方法的建立奠定基础。
1 材料与方法
1.1 材 料
1.1.1 试剂 AFB1、B2、G1、G2标准品,德国Prio-Lab公司产品,购自郑州市盈科试剂耗材经营部;牛血清白蛋白 (BSA)、鸡卵清蛋白(OVA)、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA),Pierce公司产品,购自郑州市中原区云科试剂耗材站;辣根过氧化物酶标记羊抗兔IgG抗体(GaRIgG-HRP),华美生物工程有限公司产品。其他试剂市售所得,均为分析纯或色谱纯。试验用水均为三蒸水。
1.1.2 溶液 ELISA所用稀释液为0.01 mol·L-1pH 7.4的磷酸盐缓冲液(PBS);洗液为含0.5 g·L-1Tween-20(PBST)的PBS;封闭液为含50 g·L-1猪血清的PBST;包被液为0.1 mol·L-1pH 9.6的碳酸盐缓冲液(CBS)。
1.1.3 主要仪器 Pharmacia蛋白质核酸分析仪,Amersham公司;WD-9403D型紫外仪,北京六一仪器厂;RF-5301 PC荧光光谱仪,日本岛津公司;JY-3000电泳仪,北京君意东方电泳设备有限公司;F-4500型荧光分光光度计,日本日立公司;多功能全自动酶标仪(MK3型),美国热电公司。
1.1.4 试验动物 SPF级4周龄雌性Balb/C小鼠,新乡医学院实验动物中心提供,动物许可号:SCXK(豫)2010-0002。
1.2 方 法
1.2.1 G族AF半抗原分子设计与人工抗原合成 以AFG1为起始原料,根据其分子结构上存在的活性基团和活性位点(图1),参照文献[7-11],采用半缩醛法(semi acetal,SA)、环氧化物法(Epoxide,EP)、烯醇醚衍生物法(Enol ether derivative,EED)合成AFG1-BSA。

1、2、3、4表示活性位点 1,2,3 and 4 indicates active sites
图1AFG1分子结构式
Fig.1MolecularstructureofAFG1
SA法:AFG1在H2SO4作用下转化为AFG2a,AFG2a的醛基与BSA的氨基生成不稳定的希夫氏碱,在NaBH4的还原作用下,生成稳定的AFG2a-BSA[7-8],合成路线见图2。

图2 AFG1-BSA SA法合成路线
EP法:利用AFG1双呋喃环双键,在氧化作用下, AFG1的3位、4位形成环氧化物,与BSA的-NH2反应形成二级胺,以-CONH-形式与BSA偶联合成AFG1-BSA[9-10],合成路线见图3。
EED法:利用AFG14位的活性位点,通过添加乙醇酸连接臂,得到AFG1烯醇醚衍生物(AFG1-GA),利用AFG1-GA的羧基与BSA偶联合成AFG1-BSA[11],合成路线见图4。
1.2.2 G族AF人工抗原鉴定 UV鉴定:称取一定量的AFG1、BSA和AFG1-BSA,AFG1用甲醇溶解,以甲醇作空白对照;BSA和AFG1-BSA用甲醇PBS溶液[V(甲醇)∶V(PBS)=4∶6)]溶解,为空白对照,在波长200~450 nm进行紫外扫描,分析扫描图谱,参照文献[12-13]所述方法计算AFG1与BSA的分子结合比。
SDS-PAGE鉴定:浓缩胶质量浓度为50 g·L-1,电压90 V;分离胶质量浓度为120 g·L-1,电压45 V;上样量每孔10 μL,蛋白每孔10 μg;考马斯亮蓝染色,用紫外凝胶成像系统分析软件计算AFB1与BSA的分子结合比。
荧光强度鉴定:称取一定量的BSA和AFG1-BSA溶解于甲醇PBS溶液[V(甲醇)∶V(PBS)=4∶6)],质量浓度均为1.0 mg·mL-1,在激发波长365 nm、发射波长440 nm的条件下测定荧光强度。

图3 AFG1-BSA EX法合成路线

图4 AFG1-BSA EED法合成路线
1.2.3 AFG1pAb制备与免疫学特性分析 AFG1pAb制备:用3种不同方法合成的抗原AFG1-BSA分别免疫Balb/C小鼠,每种抗原免疫1组,共3组,每组5只。免疫剂量按AFG1-BSA中BSA的量计算,每只50 μg,体积为0.2 mL,背部皮下4~6点注射,共免疫5次,时间间隔4 d。最后1次免疫后21 d摘除眼球眶下窦采血,分离血清,得到AFG1pAb。
AFB1pAb免疫学特性分析:采用间接ELISA进行效价检测[14]。敏感性鉴定,间接竞争ELISA(icELISA)测定AFG1pAb对AFG1的50%抑制质量浓度(IC50),以IC50衡量敏感性[15]。特异性鉴定,采用交叉反应试验,选择AFG1、G2、B1、B2作为抑制物,icELISA测定各抑制物的IC50,以AFG1pAb对AFG1的IC50与AFG2、B1、B2的IC50百分比为其交叉反应率(CR)。
2 结果与分析
2.1 G族AF人工抗原鉴定
2.1.1 UV鉴定 由图5可知,BSA的最大吸收峰在278 nm,AFG1在200~500 nm有243、257、264和362 nm 4个吸收峰,最大吸收峰在362 nm。SA和EP均在346 nm和413 nm出现特征吸收峰, EED在423 nm出现特征吸收峰,与BSA和AFG1有不同的紫外吸收特征,表明采用3种方法均成功合成人工抗原AFG1-BSA。AFG1与BSA的分子结合比见表1。
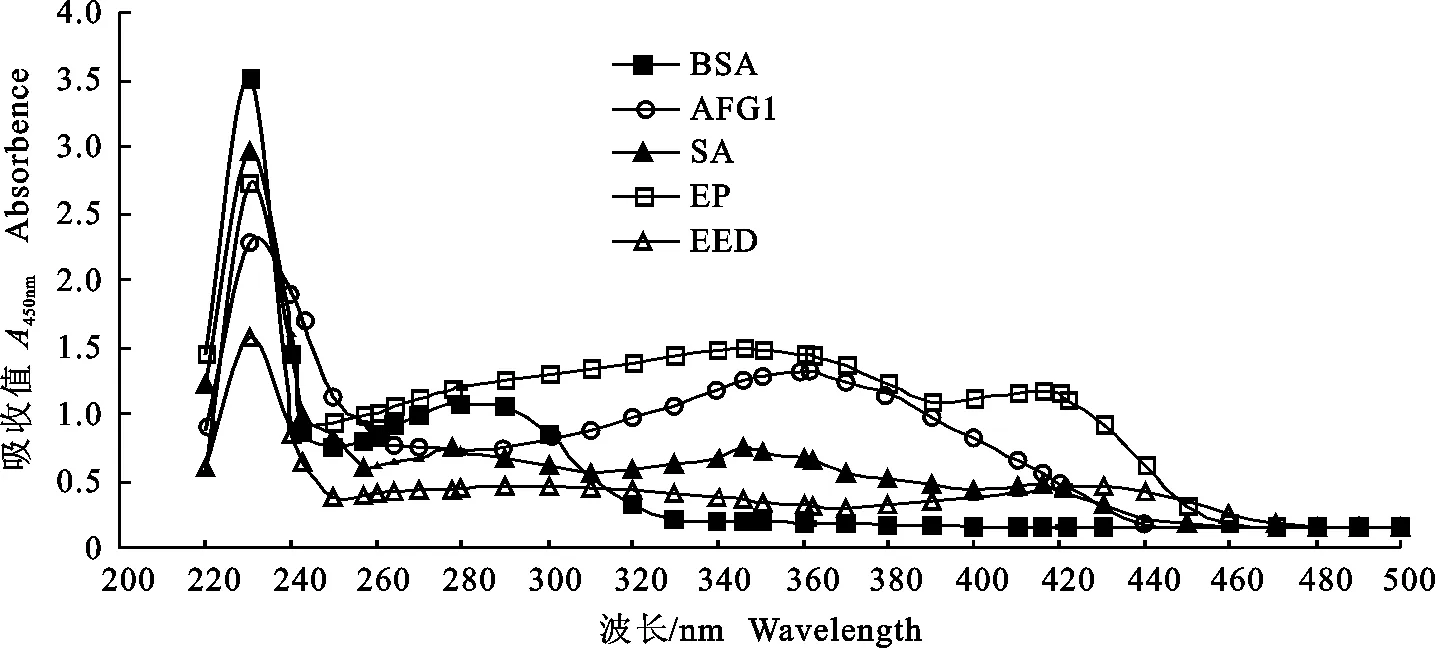
图5 合成人工抗原AFG1-BSA的紫外光谱图
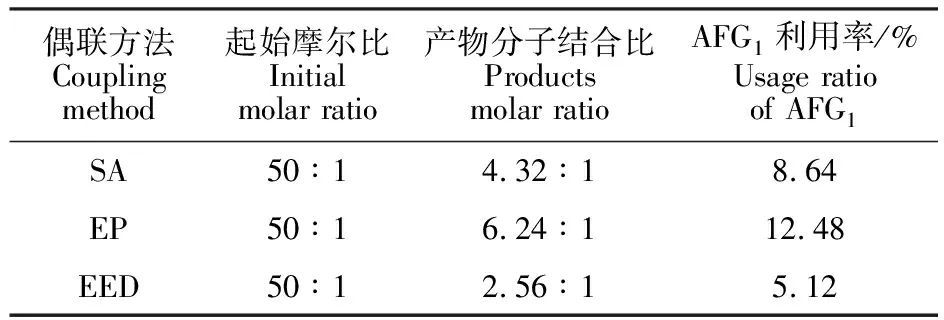
表1 不同偶联方法合成AGB1-BSA的分子结合比
注:由于BSA的相对分子质量为66 200,AFG1为328,BSA远大于AFG1,因而在计算利用率时,设定BSA被100%利用。
Note:Due to relative molecular mass of BSA is 66 200,AFG1is 328,the relative molecular mass of BSA is much larger than that of AFB1,so in the calculation of usage ratio of BSA,set BSA to be used by 100%.
2.1.2 SDS-PAGE鉴定 由图6可知,3种方法合成的免疫原AFG1-BSA在凝胶板上的迁移速率小于BSA,表明AFG1-BSA的MW大于BSA,说明AFG1-BSA合成成功。
2.1.3 荧光强度鉴定 由图7可知,在相同激发光源、相同蛋白质质量浓度(1.0 mg·mL-1)条件下,3种方法合成的抗原与BSA相比,荧光强度均有不同程度增强,表明完全抗原合成成功。
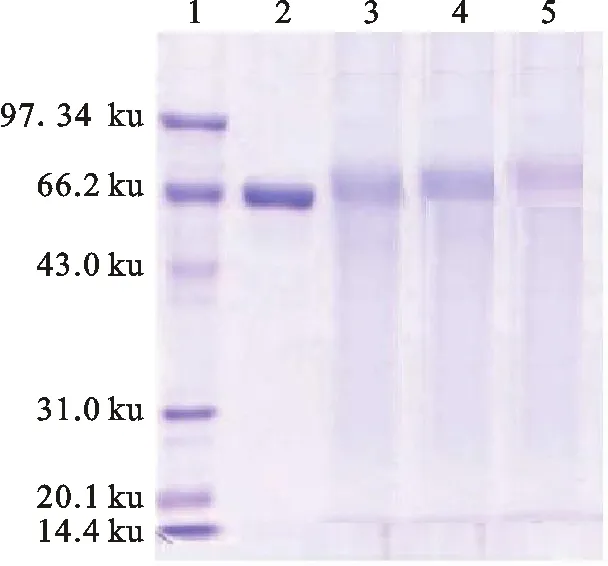
1.Maker;2.BSA;3.SA;4.EP;5.EED
2.2 AFG1 pAb免疫学特性分析
2.2.1 效价测定 由图8可知,经5次免疫后,每组挑选出1只效价最高的小鼠,共挑选出3只,间接ELISA测定其效价,并进行比较,3只小鼠的AFG1pAb效价均达到1∶(1.6×103)以上,说明合成的3种完全抗原AFG1-BSA均具有很好的免疫原性,按效价评价3组的免疫效果,顺序依次为SA、EP和EED。

图7 合成人工抗原AFG1-BSA的荧光强度
2.2.2 敏感性分析 由图9可知,免疫后挑选出效价最高的3只小鼠的阻断ELISA曲线呈良好的线性关系,将A450nm值转化为B/B0%,再对lg[AFG1/100]进行回归分析,均符合线性关系的判定标准。该 3 只小鼠血清AFG1pAb抑制曲线的回归方程、R2值和IC50值见表2,其中抑制效果最好的是SA 组小鼠的血清,IC50为13.6 μg·kg-1,其次是EP组(20.28 μg·kg-1), EED组小鼠的敏感性较差。
2.2.3 特异性分析 由表3可知,3种偶联方法
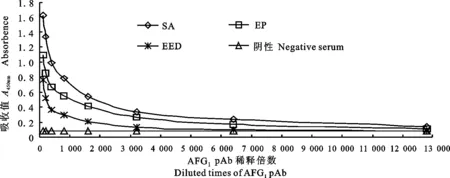
图8 AFG1 pAb效价测定曲线
合成抗原免疫动物后获得的AFG1pAb均能100%识别AFG1,其中AFG1pAb(SA)敏感性最好,IC50为13.6 μg·kg-1,广谱性也最好,与AFG2的CR为82.19%,与AFB1、B2的CR均小于10%。AFG1pAb(EP)具有较好的敏感性,IC50为20.28 μg·kg-1,但广谱性较差,与其他AF的CR均小于10%。AFG1pAb(EED)对AFG1的敏感性较差,IC50为65.32 μg·kg-1。结果表明,半缩醛法制备的AFG1-BSA敏感性高、特异性强、广谱性最好。
3 讨 论
3.1 AF人工抗原合成路径
高质量的抗体是建立免疫分析方法的核心试剂,就目前的研究进展而言,实现TAFs总量免疫分析的途径有两条,一是分别制备B族AFs和G族AFs灵敏度高、特异性强的单一抗体,之后混合为混合通用抗体,该方法目前较为常用,并取得很好的应用效果;二是制备能够同时识别AF B1、B2、G1、G2且灵敏度高、识别谱广的单一通用抗体,这是最为理想的技术方法,但制备这种高质量的单抗较为困难。由于AF是小分子半抗原,必须合成人工免疫原,借助活化的T细胞辅助B细胞增殖及分化,从而获得合格的抗体。
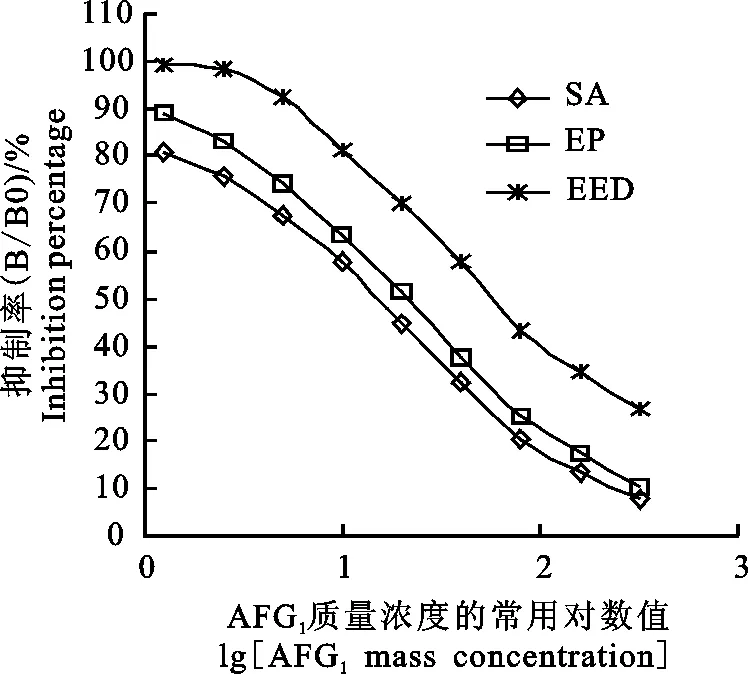
图9 AFG1 pAb对AFG1的抑制曲线
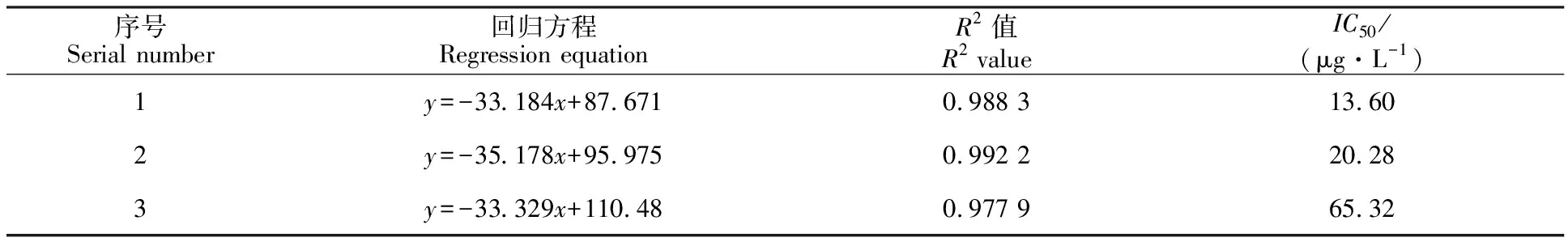
表2 AFB1 pAb对AFB1抑制曲线的回归方程、R2值和IC50值
注:“y”表示抑制率,即不同质量浓度AFG1标准品溶液A450值与空白溶液A450值的百分率;“x”表示不同质量浓度AFG1标准品溶液的常用对数值。
Note: “y”indicates the inhibition percentage, that is the percentage of A450value of AFG1standard solution with different mass concentration and A450value of blank solution;“x” indicates the common logarithm value of AFG1standard solution with different mass concentration.
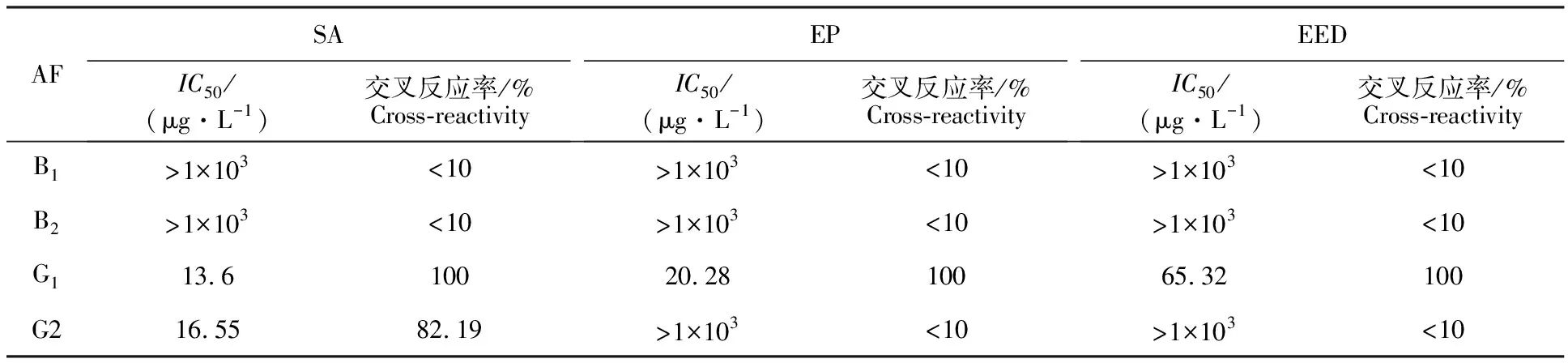
表3 AFG1 pAb与AFB1、B2、G1、G2的交叉反应
3.2 G族AF人工免疫原合成方法及免疫效果
由于对G族AF半抗原分子设计、抗原合成方法及所产生抗体特性的研究起步较晚,综合分析上述3种方法,笔者认为,半缩醛法效果最优,将AFG1酸化形成AFG2a,利用AFG2a的3位羟基活性基团,以希夫氏碱为间隔臂合成抗原,所产生抗体具有效价高、敏感性好、特异性强和识别谱广的特性。环氧化物法可以诱导机体快速产生抗体,但其敏感性方面不及半缩醛法。烯醇醚衍生物法存在明显的缺陷,诱导机体产生抗体的能力较差,且产生的抗体对AFG1的敏感性较差,因此,该方法在科学研究中具有较好的应用价值,但实际生产中应用很少。
3.3 AF人工免疫原合成方法的发展趋势
由于 AFB1与其他 AF 污染密切相关,AFB2污染伴随AFB1,高浓度AFB1对AFG1和AFG2有抑制作用,因此,对于食品AF污染免疫检测评价方法有两种,包括中国在内部分国家采用AFB1限量标准,但为解决多种毒素污染同时存在且具有毒性叠加效应及在检测标准方面的相应缺失,部分国家采用AF总量(B1+B2+G1+G2)限量标准。鉴于此,AF免疫分析技术的研究重点在于通过AF半抗原分子设计与抗原合成,一方面提高抗体对AFB1识别的敏感性和特异性,满足对AFB1限量标准的要求;另一方面,提高抗体对AFB1、AFB2、AFG1、AFG2识别的敏感性和广谱性,满足对AF总量限量标准的要求。目前,AF半抗原分子设计与抗原合成仍停留在经验设计与预测设计层面,多采用试错法(Trial-and-error assays)进行,尽管对合成的人工抗原已建立红外(IR)、紫外(UV)、质谱(MS)、凝胶电泳(SDS-PAGE)和核磁共振(NMR)等多种鉴定方法,但最终是需通过动物试验验证其科学性和合理性,一定程度上存在盲目性和偶然性[16]。随着分子免疫学、量子化学、分子力学等新型学科的兴起,分子信息技术、分子模拟技术、计算机辅助技术的推广应用,这些为提高半抗原分子设计与抗原合成的合理性、时效性和预见性提供可供借鉴的理论与方法[17-19]。Kim等[20]通过计算机辅助技术,制备出特异性强、识别谱广的TAFs mAb,对AFB1、AFB2、AFG1、AFG2的IC50分别为4.36、7.22、6.61、29.41 μg·kg-1,以ELISA技术模式实现TAFs检测。周茜等[21]借助分子模拟技术,成功制备G族AF mAb,对AFG1、AFG2的IC50分别为17.18、19.75 μg·kg-1,并建立AF G族ELISA检测方法。
4 结 论
根据AFG1的分子结构和活性位点,采用SA法、EP法和EED法3种方法制备G族AF人工免疫原AFG1-BSA,通过UV、SDS-PAGE和荧光强度测定对合成的人工抗原进行鉴定。结果表明,在G族AF人工免疫原合成的3种方法中,SA法效果最好,AFG1与BSA的分子结合比为4.32∶1,动物免疫所产生的AFG1pAb具有效价高、敏感、特异、广谱等特性。研究结果为G族AF和AF总量免疫检测方法的建立奠定基础。
参考文献Reference:
[1] HABIBIPOUR R,TAMANDEGANI P R,FARMANY A.Monitoring of aflatoxin G1,B1,G2,and B2occurrence in some samples of walnut[J].EnvironmentalMonitoringandAssessment,2016,188(12):669.
[2] 王亚楠,王晓斐,牛琳琳,等.黄曲霉度B1半抗原分子设计与抗原合成及抗体特性研究进展[J].食品工业科技,2016,37(23):367-376.
WANG Y N,WANG X F,NIU L L,etal.Research progress in hapten molecule design and immunogen synthesis and antibody characteristics of aflatoxin B1[J].ScienceandTechnologyofFoodIndustry,2016,37(23):367-376.
[3] AIKO V,MEHTA A.Occurrence,detection and detoxification of mycotoxins[J].JournalofBiosciences,2015,40(5):943-954.
[4] 马海华,孙楫舟,甄 彤,等.我国国家标准和行业标准中黄曲霉毒素测定方法综述[J].食品工业科技,2016,37(6):360-366.
MA H H,SUN J ZH,ZHENG T,etal.A review on aflatoxins determination methods in China’s national and industry standards[J].ScienceandTechnologyofFoodIndustry,2016,37(6):360-366.
[5] SIAHI SHABAD M R,ANSARIN M,TAHAVORI A,etal.Determination of aflatoxins in nuts of Tabriz confectionaries by ELISA and HPLC methods[J].AdvancedPharmaceuticalBulletin,2012,2(1):123-126.
[6] GEFEN T,VAYA J,KHATIB S,etal.The effect of haptens on protein-carrier immunogenicity[J].Immunology,2015,144(1):116-126.
[7] CHU F S,STEINERT B W,GAUR P K.Production and characterization of antibody against aflatoxin G1[J].JournalofFoodSafety,1985,7(3):161-170.
[8] LI P W,ZHOU Q,WANG T,etal.Development of an enzyme-linked immunosorbent assay method specific for the detection of G-group aflatoxins[J].Toxins,2016,8(1):5-15.
[9] MARYIN C N,GARNER R C.Aflatoxin B-oxide generated by chemical or enzymic oxidation of aflatoxin B1causes guanine substitution in nucleic acids[J].Nature,1977,267(5614):863-865.
[10] ZHANG J Y,LI P W,ZHANG W,etal.Production and characterization of monoclonal antibodies against aflatoxin g(1)[J].Hybridoma,2009,28(1):60-70.
[11] LYER R S,HARRIS T M.Preparation of aflatoxin B18,9-epoxide using m-chloroperbenzoic acid[J].ChemicalResearchinToxicology,1993,6(3):313-316.
[12] 王亚楠,王淑云,张海棠,等.抗重金属Cd2+单克隆抗体杂交瘤细胞株的建立及其免疫学特性鉴定[J].西北农业学报,2014,23(11):24-29.
WANG Y N,WANG SH Y,ZHANG H T,etal.Establishment of hybridoma cell lines secreting anti-cadmium ion monoclonal antibody and identification of their immunological properties[J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(11):24-29.
[13] 王亚楠,丁 菡,王晓斐,等.抗重金属Cr3+单克隆抗体的研制及其免疫学特性分析[J].西北农业学报,2016,25(11):1597-1602.
WANG Y N,DING H,WANG X F,etal.Preparation of anti-chromium ion monoclonal antibodies and analysis of their immunological properties[J].ActaAgriculturaeBoreali-occidentalisSinica,2016,25(11):1597-1602.
[14] 张金阳,李培武,张 文,等.黄曲霉毒素 G1人工抗原的合成[J].食品科学,2008,29(6):194-197.
ZHANG J Y,LI P W,ZHANG W,etal.Synthesis of aflatoxin G1artificial antigen[J].FoodScience,2008,29(6):194-197.
[15] LI P W,ZHOU Q,WANG T,etal.Development of an enzyme-linked immunosorbent assay method specific for the detection of G-group aflatoxins[J].Toxins(Basel),2015,8(1):1-11.
[16] 管 露,张银志,杨婷婷,等.百草枯半抗原分子设计合成及表征[J].食品与生物技术学报,2013,32(5):524-528.
GUAN L,ZHANG Y ZH,YANG T T,etal.Synthesis and characterization of the hapten for paraquat[J].JournalofFoodScienceandBiotechnology,2013,32(5):524-528.
[17] XU Z L,SHEN Y D,BEIER R S,etal.Application of computer-assisted molecular modeling for immunoassay of low molecular weight food contaminants:a review[J].AnalyticaChimicaActa,2009,647(2):125-136.
[18] SEVY A M,MEILER J.Antibodies:computer-aided prediction of structure and design of function[J].MicrobiologySpectrum,2014,2(6):1-14.
[19] KORTKHONJIA E,BRANDMAN R,ZHPU J Z,etal.Probing antibody internal dynamics with fluorescence anisotropy and molecular dynamics simulations[J].Mabs,2013,5(2):306-322.
[20] KIM S H,CHA S H,KARYN B,etal.Production of group specific monoclonal antibody to aflatoxins and its application to enzyme-linked immunosorbent assay[J].ToxiicolResearch,2011,27(2):125-131.
[21] 周 茜,张 文,张 奇,等.黄曲霉毒素G族人工抗原的合成与免疫效果研究[J].化学试剂,2010,32(10):869-872,876.
ZHOU Q,ZHANG W,ZHANG Q,etal.Synthesis of aflatoxin G class artificial antigen[J].ChemicalReagents,2010,32(10):869-872,876.
