表达猪瘟E2基因的重组伪狂犬病毒构建及其生物学特性分析
2018-06-06陈晓春吴华伟曹明慧李俊平夏业才
韩 爽,陈晓春,邓 永,吴华伟,曹明慧,李俊平,夏业才
(中国兽医药品监察所,北京100081)
猪瘟(Classical swine fever,CSF)作为世界动物卫生组织(OIE)规定必须报告的疫病,对世界养猪业造成极大危害,是养猪业防控的重要疾病[1]。因此,涉及猪病防控用新型疫苗的研究非常活跃。E2囊膜糖蛋白是猪瘟病毒的主要结构蛋白,介导病毒感染,诱导机体产生中和抗体,是重要的保护性抗原[2]。因此,猪瘟E2蛋白是研制新型活载体疫苗、亚单位疫苗及研究猪瘟病毒致病机理的重要靶蛋白。已有研究表明,杆状病毒表达E2亚单位灭活疫苗、重组猪瘟E2基因的腺病毒活载体疫苗、重组猪瘟E2基因的伪狂犬病毒活疫苗均表现出良好的免疫效果[3-6]。
伪狂犬病(Pseudorabies,PR或Aujeszky's disease,AD)是一种由伪狂犬病毒(Pseudorabies virus,PRV)感染引起的急性传染病,可引起仔猪的高死亡率,母猪的繁殖障碍,育肥猪的神经及呼吸系统症状,公猪的种用性能降低或丧失等,对养猪业危害极大[7]。PRV基因组为线性双链DNA,约145 kb,可编码70~100种病毒蛋白,其中含有大量与病毒增殖无关的非必需区可供外源基因的插入,是优良的活病毒载体[8]。PRV重组活疫苗对由与载体遗传关系相近的PRV强毒引起的PR具有良好的免疫效果。
2011年以来,一度得到很好控制的猪伪狂犬病在我国又出现广泛流行态势。有研究表明,当前流行毒株与之前的PRV毒株相比发生了较大变异,现使用的弱毒疫苗株无法对变异株的感染提供完全保护[9]。基于PRV流行情况的变化,实验以CSFV(C株)的主要保护性抗原基因E2为目标基因,用一株由PRV流行株(SX株)构建的五基因缺失绿色荧光标记病毒rPRV-BE[10]为亲本株,通过同源重组技术构建了表达猪瘟病毒E2基因的四基因缺失重组伪狂犬病毒rPRV-CSFV PE2SC,并对其体外增殖特性进行了初步研究,以期为重组病毒的进一步开发应用提供实验基础。
1 材 料
1.1 毒株 PRV(SX株)为中国兽医药品监察所病毒制品检测室人员在2012年于山西某猪场分离到的一株高致病性流行毒株;rPRV-BE,是以PRV(SX株)为基础构建的gI、gE、US9、TK和部分UL49.5基因缺失,引入增强型绿色荧光蛋白基因EGFP的重组病毒[10];CSFV (C株)由中国兽医药品监察所菌种保藏室保存。
1.2 细胞 PK15细胞,由中国兽医药品监察所保存。
1.3 载体及质粒 pMD18-T载体购自宝生物工程(大连)有限公司;pEASY-Blunt Simple Cloning Kit购自北京全式金生物技术有限公司;质粒pMD-US6-EGFP-US2由实验室自行制备保存。
1.4 主要试剂 限制性内切酶SbfI、AflII、AgeI、SpeI,T4 DNA连接酶购自纽英伦生物技术(北京)有限公司;Top10感受态细胞、质粒小提试剂盒、质粒小提中量试剂盒购自天根生化科技(北京)有限公司;EX-Taq酶、2×GC EX-Taq Buffer、dNTPs,One Step RT-PCR Kit购自宝生物工程(大连)有限公司;CSFV E2单抗为勃林格公司惠赠;FITC标记的羊抗鼠IgG购自Sigrna(上海)贸易有限公司;DNA/RNA提取试剂盒购自康宁生命科学(吴江)有限公司;KOD FX Neo购自东洋纺(上海)生物科技有限公司。
1.5 主要仪器设备 二氧化碳培养箱(三洋)、恒温培养箱(三洋)、 水浴锅(上海博信)、PCR仪(Biometra)、电泳仪(Bio-Rad)、荧光倒置显微镜(奥林巴斯)、凝胶成像系统(GOLD-SIM)等。
2 方 法
2.1 引物设计与合成 根据GenBank上的PRV和CSFV序列,自行设计合成系列扩增及鉴定引物(表1),用于扩增左同源臂和gI基因、E2基因以及鉴定重组病毒。

表1 各片段扩增引物Tab 1 Sequences of PCR primer pairs
下划线部分为引物酶切位点
The underline part is the enzyme cutting site
2.2 转移质粒pMD-US6-US7-E2-US2的构建
2.2.1 CSFV E2基因扩增 采用DNA/RNA提取试剂盒提取CSFV(C株)基因组,以其为模板用下游引物CSFVrE2R反转录成cDNA,然后用引物CSFVrE2Fs/CSFVrE2R扩增E2基因,连接pEASY-Blunt Simple 克隆载体,构建质粒pEASY-Blunt-PE2S,测序正确后备用。
2.2.2 左同源臂+gI基因扩增 采用DNA/RNA提取试剂盒提取PRV(SX株)基因组,以其为模板,用引物rUS6F/rUS7R2扩增左同源臂和gI基因,扩增的目的片段连接pEASY-Blunt Simple克隆载体,构建重组质粒pEASY-Blunt-US6-US7,测序正确后备用。
2.2.3 转移质粒构建 质粒pMD-US6-EGFP-US2与pEASY-Blunt-US6-US7经SbfI/AflII双酶切,回收目的片段后用T4连接酶连接,获得转移质粒pMD-US6-US7-EGFP-US2;再以AgeI/SpeI分别双酶切质粒pEASY-Blunt-PE2S和pMD-US6-US7-EGFP-US2,回收相应片段后用T4连接酶连接,最终获得转移质粒pMD-US6-US7-E2-US2(构建示意图见图1),提取高浓度质粒,备用于转染。
2.3 重组病毒的拯救
2.3.1 同源重组 病毒的同源重组在24孔细胞培养板上进行,取rPRV-BE病毒液15 μL,与3 μg转移质粒pMD-US6-US7-E2-US2采用脂质体法共转染长至90%左右的PK15细胞。转染24 h后,观察细胞病变情况,当病变达80%以上后冻融裂解细胞,裂解液在PK15细胞上盲传3代,出现无绿色荧光细胞病变即可初步判断重组病毒拯救成功。
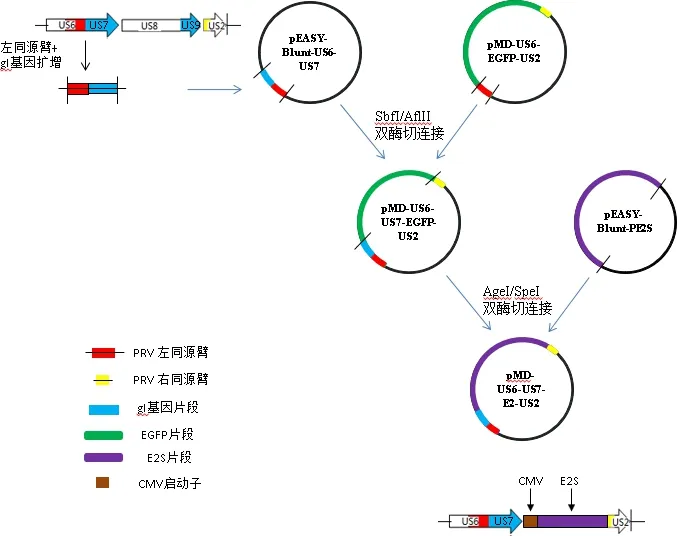
图1 pMD-US6-US7-E2-US2转移载体构建示意图Fig 1 Schematic diagram of transfer carrier construction
2.3.2 重组病毒的筛选 将初步获得的疑似含有CSFV E2基因的拯救病毒rPRV-CSFV PE2SC病毒液接种已长成良好单层的PK15细胞6孔细胞板,吸附1 h后,弃去吸附液,铺上1%的低熔点琼脂糖,继续培养。接种48 h后在荧光显微镜下观察,挑选无荧光的单个噬斑于0.5 mL DMEM营养液中,震荡混匀后,继续接种已长成良好单层的PK15细胞6孔细胞板,如此纯化4次,将获得的重组病毒命名为rPRV-CSFV PE2SC。
2.3.3 鉴定
2.3.3.1 基因鉴定 将获得的重组病毒rPRV-CSFV PE2SC用PUS6dF/PUS9bR引物进行PCR鉴定,同时与野毒PRV(SX株)、亲本毒rPRV-BE相同鉴定引物扩增结果进行比较。
2.3.3.2 免疫荧光鉴定 用针对CSFV E2蛋白的单克隆抗体(Mab)进行IFA试验,检测E2蛋白表达情况。将重组病毒rPRV-CSFV PE2SC接种PK15细胞96孔细胞板,待病变达到80%~90%时弃掉上清,经灭菌PBS洗细胞2次后用80%冷丙酮固定,晾干后加入抗CSFV E2的Mab,置于湿盒中37 ℃作用1 h,再用PBS洗涤3次后,加入FITC标记的羊抗鼠IgG,再次置于湿盒中37 ℃作用1 h,用PBS洗涤3次后,置于荧光倒置显微镜下观察。
2.4 重组病毒的遗传稳定性研究 将筛选获得的病毒rPRV-CSFV PE2SC在PK15细胞上连续传20代,每5代提取感染细胞总DNA,按步骤2.3.3.1的方法进行PCR鉴定,重组病毒rPRV-CSFV PE2SC、第20代重组病毒rPRV-CSFV PE2SC按步骤2.3.3.2的方法进行IFA鉴定。
2.5 重组病毒一步生长曲线测定 将重组病毒rPRV-CSFV PE2SC、野毒PRV(SX株)、亲本毒rPRV-BE,以0.01 MOI各接种PK15细胞12瓶,吸附1 h,用含有2%胎牛血清的DMEM补液后继续培养,分别在感染后6、12、18、24、30、36、48、60、72、84、96、108 h收集感染细胞,冻融3次后收毒,分别测定三种病毒不同收毒时间的滴度并绘制一步生长曲线。
3 结 果
3.1 转移质粒的构建 质粒pEASY-Blunt-US6-US7用SbfI/AflII双酶切,切出大小约为2324 bp和3830 bp的两个片段(图2);质粒pEASY-Blunt-PE2S用AgeI/SpeI双酶切,切出大小约为1208 bp和3830 bp的两个片段(图2),与预期大小一致。经测序,结果与理论序列一致,表明质粒pEASY-Blunt-US6-US7和质粒pEASY-Blunt- PE2S构建成功。质粒pMD-US6-US7-EGFP-US2用AgeI/SpeI能切出大小约为733 bp和6852 bp的两个片段(图3),引入CSFV E2基因构建的质粒pMD-US6- US7- E2-US2,用AgeI/SpeI能切出大小约为1208 bp和6852 bp 的两个片段(图3)。经测序,结果与理论序列一致,表明转移质粒pMD-US6-US7- EGFP-US2和pMD-US6-US7- E2-US2构建成功。
3.2 重组病毒的拯救、纯化及鉴定 转染所收细胞裂解液,在PK15细胞上盲传3代后出现了无绿色荧光细胞病变(图4A),初步判定重组病毒拯救成功。挑选无荧光的单个噬斑接种于长成良好细胞单层的PK15细胞,纯化4次后获得重组病毒rPRV-CSFV PE2SC(图4B)。用引物PUS6dF/PUS9bR进行PCR鉴定,rPRV-CSFV PE2SC扩增到大小约为3469 bp的条带,野毒PRV (SX株)和亲本毒rPRV-BE用相同引物扩增,分别得到大小约为3550 bp和1584 bp的条带(图5)。经测序证实,重组病毒缺失了EGFP基因,并成功引入了PRV gI基因和CSFV(C株) E2基因。
用针对CSFV E2蛋白的MAb进行IFA试验,结果显示,感染重组病毒rPRV-CSFV PE2SC的PK15细胞孔中出现明显的荧光,而阴性对照组则没有荧光出现(图6)。
3.3 重组病毒的遗传稳定性 重组病毒rPRV-CSFV PE2SC在PK15细胞上连续传了20代,分别以重组病毒rPRV-CSFV PE2SC、第5、10、15、20代重组病毒DNA为模板,用引物PUS6dF/PUS9bR进行PCR扩增鉴定,结果均扩增出大小约为3469 bp的目的片段(图7)。取重组病毒rPRV-CSFV PE2SC、第20代重组病毒进行免疫荧光鉴定,结果重组病毒rPRV-CSFV PE2SC、第20代重组病毒感染孔中均出现明显的荧光(图6、8),且荧光亮度相似,表明重组病毒能够稳定遗传。
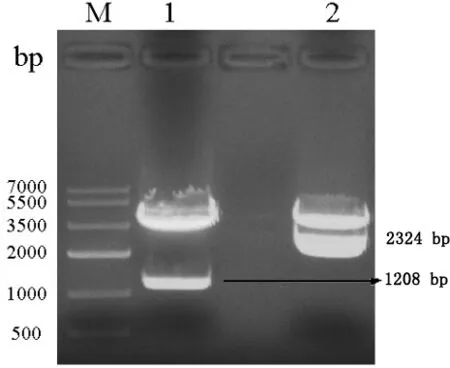
M:Marker IV;1:pEASY-Blunt-PE2S的Age I/Spe I双酶切产物;2:pEASY-Blunt-US6-US7的Sbf I/Afl II双酶切产物M:Marker IV;1:pEASY-Blunt-PE2S enzyme digestion with Age I/Spe I;2:pEASY-Blunt-US6-US7 enzyme digestion with Sbf I/Afl II图2 质粒pEASY-Blunt-PE2S和pEASY-Blunt-US6-US7的双酶切鉴定电泳图Fig 2 The double enzyme digestion results of pEASY-Blunt-PE2S and pEASY-Blunt-US6-US7

M1:Marker IV;M2:Marker DL2000;1:pMD-US6-US7-EGFP-US2的Age I/Spe I双酶切产物;2:pMD-US6-US7-E2-US2的Age I/Spe I双酶切产物M1:Marker IV;M2:Marker DL2000;1:pMD-US6-US7-EGFP-US2 enzyme digestion with Age I/Spe I;2:pMD-US6-US7-E2-US2 enzyme digestion with Age I/Spe I图3 转移质粒pMD-US6-US7-EGFP-US2和pMD-US6-US7-E2-US2的双酶切鉴定电泳图Fig 3 The double enzyme digestion results of pMD-US6-US7-EGFP-US2 and pMD-US6-US7-E2-US2

A.盲传出现的无绿色荧光细胞病变;B.纯化得到的重组病毒rPRV-CSFV PE2SCA.Cytopathy without green fluorescence;B.Purified recombinant virus rPRV-CSFV PE2SC图4 筛选到的重组病毒rPRV-CSFV PE2SC(10×10)Fig 4 Screened recombinant virus rPRV-CSFV PE2SC(10×10)

M:Marker DL5000;1:PRV(SX株);2:rPRV-BE;3:rPRV-CSFV PE2SC图5 重组病毒rPRV-CSFV PE2SC的PCR扩增鉴定电泳图Fig 5 Identification of recombinant virus rPRV-CSFV PE2SC by PCR
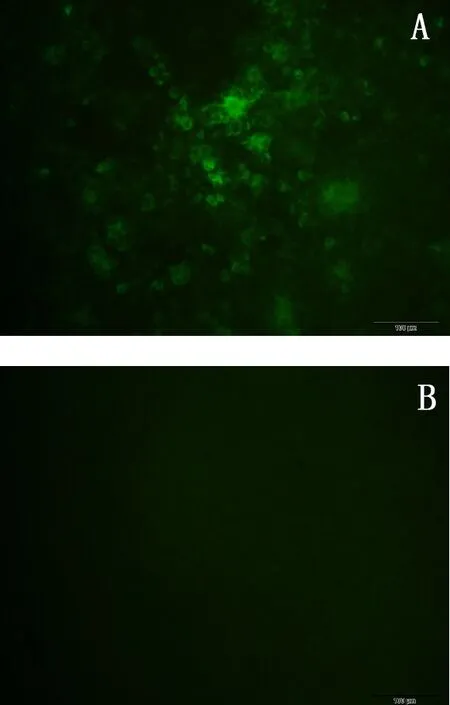
A.纯化后的重组病毒rPRV-CSFV PE2SC感染PK15细胞;B.阴性对照A. Purified recombinant virus rPRV-CSFV PE2SC infected PK15 cells;B. Negative control图6 重组病毒rPRV-CSFV PE2SC 在PK15细胞中E2蛋白表达的IFA检测结果Fig 6 Detection of E2 expression in PK15 cells infected with recombinant virus rPRV-CSFV PE2SC by IFA
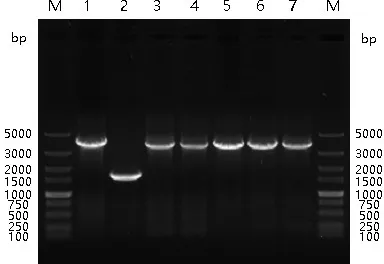
M:Marker DL5000;1:PRV(SX株);2:rPRV-BE;3:rPRV-CSFV PE2SC;4:rPRV-CSFV PE2SC(P5);5:rPRV-CSFV PE2SC(P10);6:rPRV-CSFV PE2SC(P15);7:rPRV-CSFV PE2SC(P20)图7 重组病毒rPRV-CSFV PE2SC各代次PCR扩增鉴定电泳图Fig 7 Identification of several generations of recombinant virus rPRV-CSFV PE2SC by PCR
A.纯化后的重组病毒rPRV-CSFV PE2SC第20代感染PK15细胞;B.阴性对照A.The 20th generation purified recombinant virus rPRV-CSFV PE2SC infected PK15 cells;B. Negative control图8 第20代重组病毒rPRV-CSFV PE2SC在PK15细胞中E2蛋白表达的IFA检测结果Fig 8 Detection of E2 protein expression in PK15 cells infected with the 20th generation recombinant virus rPRV-CSFV PE2SC by IFA
3.4 一步生长曲线测定 将重组病毒rPRV-CSFV PE2SC、野毒PRV(SX株)、亲本毒rPRV-BE感染PK15细胞,6、12、18、24、30、36、48、60、72、84、96、108 h后所收病毒液分别进行病毒滴度测定,绘制了一步生长曲线(图9)。结果表明,重组病毒rPRV-CSFV PE2SC在细胞内增殖速度较快,接种后6 h滴度达101.7TCID50/mL,而且接种18 h之前滴度一直高于另外两株毒,病毒滴度到达平台期时间较快;最高滴度出现时间三株毒都在72 h,之后重组病毒rPRV-CSFV PE2SC的滴度开始下降,其最高滴度(106.7TCID50/mL)低于野毒PRV(SX株)的108.0TCID50/mL,与亲本毒rPRV-BE(107.0TCID50/mL)相近,到达平台后滴度下降比另外两株病毒快。

图9 重组病毒rPRV-CSFV PE2SC及野毒PRV(SX株)、亲本毒rPRV-BE感染PK15细胞的一步生长曲线Fig 9 One step growth curve of recombinant virus rPRV-CSFV PE2SC,wild strain(PRV SX) and parental strain(rPRV-BE)
4 讨 论
基因缺失的伪狂犬病毒因其具备安全性好、基因组容量大、培养简单、免疫期长、宿主范围广等优点,作为病毒载体极具开发潜力[11]。同时,随着对伪狂犬病毒基础研究的逐步深入,其作为重组表达载体的类型也越来越丰富。目前,已有猪繁殖与呼吸综合征病毒(PRRSV) GP5基因[12]、乙型脑炎病毒(JEV) NS1基因[13]、H3N2亚型猪流感病毒(SIV) HA基因[14]、犬瘟热病毒(CDV) H基因[15]、猪细小病毒(PPV) VP2基因和猪圆环病毒2型(PCV2) ORF2基因[16]等多种外源基因在伪狂犬病毒中获得高效表达。
猪瘟发病率和死亡率较高,对养猪业危害很大,该病和伪狂犬病是目前威胁我国养猪业健康发展的两种主要传染病,如果防控不好,能够造成严重的经济损失。因此,开发一种安全有效的二价疫苗同时预防猪瘟和伪狂犬病两种疾病,在实际生产中具有重要意义。Hooft等[17]于1996年构建了表达猪瘟病毒囊膜蛋白E1的重组伪狂犬病毒二联基因工程疫苗M402,该疫苗免疫猪后,能同时低抗CSFV和PRV 的强毒攻击,展示了以基因缺失型伪狂犬病毒作为活病毒载体构建重组疫苗的良好前景。除E1外,猪瘟病毒主要保护性抗原基因E2也是构建重组病毒时优先考虑的基因。重组猪瘟E2基因的伪狂犬病毒rPRVTJ-delgE/gI-E2、rPRVTJ- delgE/gI/TK-E2、SA215(A)等[18-20],均表现出良好的免疫原性。
gI、gE和TK基因已被证实与PRV致病性有关,是构建PRV缺失株的主要靶基因,gI、gE双基因缺失疫苗[18],gI、gE和TK三基因缺失疫苗[19-20]已广泛使用。近年来,对疱疹病毒的研究结果表明,US9形成KIF1A-US9复合物,介导病毒在神经细胞中的顺行传导过程[21-23],US9基因的缺失能降低PRV的毒力;UL49.5基因编码囊膜蛋白gN,gN能抑制TAP介导的多肽往内质网的转运,从而阻断MHC I类复合体的装配,下调其在细胞表面的表达,从而使病毒有可能逃避宿主CD8+T细胞的识别。1型牛疱疹病毒(BHV-1)UL49.5胞质尾缺失和胞外域30~40aa部分缺失能增强病毒侵染宿主的能力,诱导更强的细胞免疫和体液免疫[24],在疫苗研制方面更具优势,为伪狂犬病毒缺失株的构建提供了新思路。同时,gI、gE都属于糖蛋白,可以产生中和抗体,保留gI有助于提高PRV的免疫原性。因此,兼顾降低PRV的致病性、提高PRV免疫原性和保证目的基因的高效表达,构建成功了TK、gE、US9全基因缺失及部分gN基因缺失,表达猪瘟病毒(CSFV C株) E2蛋白的重组伪狂犬病毒rPRV-CSFV PE2SC。
重组病毒rPRV-CSFV PE2SC在PK15细胞传20代后,PCR及IFA检测其插入和缺失不变,该结果与周国辉等[14]构建的表达H3N2亚型猪流感病毒HA基因的重组伪狂犬病毒rPRV-HA,Lei等[19]构建的重组病毒rPRVTJ-delgE/gI/TK-E2株的研究结果一致,表明这种插入和缺失是稳定的。重组病毒能在PK15细胞中快速增殖,到达平台期时间早,病毒滴度峰值可达106.7TCID50/mL,与方六荣等[12]构建的表达猪繁殖与呼吸综合征病毒(PRRSV)GP5的重组伪狂犬病毒TK-/gG-/GP5+株(107.2TCID50/mL),Wang等[18]构建的rPRVTJ-delgE/gI-E2株(107.0TCID50/mL)的实验结果相近。而且重组病毒rPRV-CSFV PE2SC最高滴度与亲本毒rPRV-BE相近,低于野毒PRV(SX株)的实验结果与Wang等[18]构建的rPRVTJ-delgE/gI-E2株的实验结果相一致。因此,用伪狂犬病毒作为载体构建含有猪瘟E2基因的重组活载体疫苗株,在理论和实践上均是可行的。研究结果为表达猪瘟E2基因重组伪狂犬病毒rPRV-CSFV PE2SC的进一步开发应用提供了依据。
除此之外,基因缺失的疫苗株免疫动物后,不产生针对缺失蛋白的抗体;重组疫苗只产生针对重组CSFV E2蛋白的抗体,不会产生针对CSFV其他蛋白的抗体,所以可以通过血清学的方法将疫苗免疫猪和野毒感染猪加以区分[25],可为CSFV和PRV根除计划的实施提供技术保障。
参考文献:
[1] 王 琴. 猪瘟病毒流行病学、病原致病特性及猪瘟综合防制研究[J]. 中国农业科技导报,2006,8(5):13-18.
Wang Q. Epidemiology,characterization of pathogenicity of classical swine fever virus and control strategies of classical swine fever[J]. Review of China Agricultural Science and Technology,2006,8(5):13-18.
[2] Wang Z,Nie Y,Wang P,etal. Characterization of classical swine fever virus entry by using pseudotyped viruses:E1 and E2 are sufficient to mediate viral entry[J]. Virology,2004,330(1):332-341.
[3] 张文杰,李向东,赵铁柱,等. 猪瘟病毒E2基因在昆虫细胞/杆状病毒中的表达[J]. 中国实验动物学报,2007(1):30-34.
Zhang W J,Li X D,Zhao T Z,etal. Expression of E2 gene of classical swine fever virus in insect cell/baculovrius expression system[J]. Acta Lab Anim Sci Sin,2007(1):30-34.
[4] 范学政,王 琴,陈振海,等. 绿色荧光蛋白基因与猪瘟兔化弱毒疫苗株E2基因在杆状病毒中的融合表达[J]. 中国兽医学报,2005(6):6-8.
Fan X Z,Wang Q,Chen Z H,etal. Fusion expression of GFP and HCLV E2 gene in baculovirus system[J]. Chin J Vet Sci,2005(6):6-8.
[5] 何 雷,张彦明,徐彦召,等. 共表达猪瘟病毒E2基因和猪白细胞介素2基因的重组腺病毒的构建及其免疫原性研究[J]. 病毒学报,2010,26(5):385-391.
He L,Zhang Y M,Xu Y Z,etal. Construction and immuno-genicity of a recombinant adenovirus co-expressing the E2 protein of classical swine fever virus and the porcine interleukin 2 in rabbits[J]. Chinese Journal of Virology,2010,26(5):385-391.
[6] 孙 元,祁巧芬,梁冰冰,等. 表达猪瘟病毒E2蛋白的重组腺病毒的构建及其在兔体内的免疫原性分析[J]. 生物工程学报,2008(10):1734-1739.
Sun Y,Qi Q F,Liang B B,etal. Generation and immunogenicity of a recombinant adenovirus expressing the E2 protein of classical swine fever virus in rabbits[J]. Chinese Journal of Biotechnology,2008(10):1734-1739.
[7] 陆承平,黄青云,吴 润,等. 兽医微生物学[M]. 4版. 北京:中国农业出版社,2007.
Lu C P,Huang Q Y,Wu R,etal. Veterinary Microbiology[M]. 4th edition. Beijing:China Agricultural Press,2007.
[8] Tian Z,Zhou G,Zheng B,etal. A recombinant pseudorabies virus encoding the HA gene from H3N2 subtype swine influenza virus protects mice from virulent challenge[J]. Vet Immunol Immunopathology,2006,111(3/4):211-218.
[9] An T Q,Peng J M,Tian Z J,etal. Pseudorabies virus variant in Bartha-K61- vaccinated pigs,China,2012[J]. Emerging Infectious Diseases,2013,19(11):1749-1755.
[10] 李俊平. 伪狂犬病病毒双荧光标记5基因缺失株的构建[P]. 中国:CN105385666A,2016-03-09.
Li J P. Construction of a 5 genes deletion and double fluorescent labeling pseudorabies virus[P]. China:CN105385666A,2016-03-09.
[11] 陈焕春,何启盖. 伪狂犬病[M]. 北京:中国农业出版社,2015:225-229.
Chen H C,He Q G. Pseudorabies[M]. Beijing:China Agri-cultural Press,2015:225-229.
[12] 方六荣,肖少波,江云波,等. 表达猪繁殖与呼吸综合征病毒(PRRSV)GP5的重组伪狂犬病毒TK-/gG-/GP5+的构建及其生物学特性初步探讨[J]. 病毒学报,2004,20(3):249-254.
Fang L R,Xiao S B,Jiang Y B,etal. Construction of the recombinant pseudorabies virus TK-/gG-/GP5+expressing GP5 of porcine reproductive and respiratory syndrome virus(PRRSV) and the preliminary study on its biological characterization[J]. Chinese Journal of Virology,2004,20(3):249-254.
[13] Xu G,Xu X,Chen H C. Construction of recombinant pseudorabies virus expressing NS1 protein of Japanese encephalitis(SA14-14-2) virus and its safety and immunogenicity[J].Vaccine, 2004, 22(15/16):1846-1853.
[14] 周国辉,倪健强,田志军,等. 表达H3N2亚型猪流感病毒HA基因重组伪狂犬病病毒的构建[J]. 畜牧兽医学报,2005(10):1043-1048.
Zhou G H,Ni J Q,Tian Z J,etal. Construction of a recombinant pseudorabies virus expressing the HA gene of H3N2 subtype swine influenza virus[J]. Acta Veterinaria et Zootechnica Sinica,2005(10):1043-1048.
[15] 李业伟,孙程龙,韩乃君,等. 表达犬瘟热H基因重组伪狂犬病毒的构建及生物学特性研究[J]. 安徽农业科学,2011,39(24):14899-14901,14974.
Li Y W,Sun C L,Han N J,etal. Construction of recombinant pseudorabies virus expressing canine distemper virus H gene and analysis on its biological characters[J]. Anhui Agricultural Science,2011,39(24):14899-14901,14974.
[16] 徐志文,郭万柱,陈 杨,等. 联合表达PPV VP2和PCV2 ORF2基因的重组 PRV的构建[J]. 中国兽医科学,2009,39(10):873-879.
Xu Z W,Guo W Z,Chen Y,etal. Construction of recombinant pseudorabies virus co-expressing ORF2 gene of porcine circovirus type 2 and VP2 gene of porcine parvovirus[J]. Chinese Veterinary Science,2009,39(10):873-879.
[17] Hooft van Iddekinge B J,de Wind N,Wensvoort G,etal. Com-parison of the protective efficacy of recombinant pseudorabies viruses against pseudorabies and classical swine fever in pigs;influence of different promoters on gene expression and on protection[J]. Vaccine,1996,14(1):6-12.
[18] Wang Y M,Yuan J,Cong X,etal. Generation and efficacy evaluation of a recombinant pseudorabies virus variant expressing the E2 protein of classical swine fever virus in pigs[J]. Clinical and Vaccine Immunology,2015,22(10):1121-1129.
[19] Lei J L,Xia S L,Wang Y,etal. Safety and immunogenicity of a gE/gI/TK gene-deleted pseudorabies virus variant expressing the E2 protein of classical swine fever virus in pigs[J]. Immunol Lett,2016,174(1):64-71.
[20] 徐志文,郭万柱,朱 玲,等. 猪瘟伪狂犬病重组病毒 SA215(A) 株的构建及生物学特性研究[J]. 畜牧兽医学报,2005,36(10):1033-1037.
Xu Z W,Guo W Z,Zhu L,etal. Construction and characteriza-tion analysis of the recombinant virus SA215(A) strain of pseudo-rabies virus hog cholera virus[J]. Acta Veterinaria et Zootechnica Sinica,2005,36(10):1033-1037.
[21] Kratchmarov R,Kramer T,Greco T M,etal. Glycoproteins gE and gI are required for efficient KIF1A-dependent anterograde axonal transport of alpha herpesvirus particles in neurons[J]. Virology,2013,87 (17):9431-9440.
[22] Gu Z,Dong J,Wang J,etal. A novel inactivated gE/gI deleted pseudorabies virus (PRV) vaccine completely protects pigs from an emerged variant PRV challenge [J]. Virus Research,2015,195:57-63.
[23] Lyman M G,Feierbach B,Curanovic D,etal. Pseudorabies virus Us9 directs axonal sorting of viral capsids[J]. Journal of Virology,2007,81(20):11363-11371.
[24] Wei H, Wang Y, Chowdhury SI. Bovine herpesvirus type 1 (BHV-1) UL49.5 luminal domain residues 30 to 32 are critical for MHC-I down-regulation in virus-infected cells[J]. PLoS One,2011,6(10):257-264.
[25] Kimman T G,de Leeuw O,Kochan G,etal. An indirect double-antibody sandwich enzyme-linked immunosorbent assay(ELISA) using baculovirus- expressed antigen for the detection of anti-bodies to glycoprotein E of pseudorabies virus and comparison of the method with blocking ELSIAs[J]. Clin Diagn Lab Immunol,1996,3(2):167-174.
